HPL (Human Placental Lactogen): ormone glicoproteico, descritto per la prima volta nel 1963, e chiamato somatomammotropina corionica (HCS), composto da 191 aminoacidi, prodotto quasi esclusivamente dal sincizio-trofoblasto. HPL geneticamente apppartiene ad una ristretta famiglia di ormoni polipeptici omologhi, (hanno un’omologia di sequenza aminoacidica dell’85% mentre i corrispondenti RNA messaggeri mostrano omologia di sequenza nucleotidica >90%), che include l’ormone della crescita (GH) e la prolattina. prodotti questi due ultimi, dall’adenoipofisi (1-4). Oltre ad avere geni in comune, questi tre ormoni hanno in comune il precursore. Il locus genico per la sintesi dell’HPL è localizzato sul braccio q (braccio lungo) del cromosoma 17 rispettivamente nella regione 17q22-24q. Il numero di alterazioni di tali geni si riflettono sul deficit della produzione di HPL (5-7). Oltre che dall’integrità genica, la quantità di HPL prodotta è correlata alla massa di trofoblasto attivo, sede di sintesi dell’HPL, e all’irrorazione ottimale della placenta (8-10).
L’HPL esercita un importante ruolo nel metabolismo glicidico, lipidico e proteico materno e fetale: stimola la sintesi di glicogeno, il trasporto di aminoacidi, la sintesi di DNA, la produzione di insulin-like growth factor (IGF) nei tessuti fetali e quindi è direttamente interessato nella crescita fetale. A digiuno esplica un effetto diabetogeno (neo-glucogenesi) ed esalta la lipolisi. Dopo i pasti esalta l’azione dell’insulina e inibisce la lipolisi e la neoglucogenesi. Queste azioni combinate permettono di aumentare la disponibilità dei glicidi per le esigenze del feto sia aumentandone la concentrazione e l’assimilabilità in caso di abbondanza sia creando la disponibilità di acidi grassi che vengono utilizzati dalla madre come fonte di energia risparmiando il consumo dei glicidi che restano a disposizione del feto (11-16).
In gravidanza induce la proliferazione differenziazione delle cellule della ghiandola mammaria (11-14). Studi recenti hanno dimostrato che l’HPL, pur essendo importante, non è indispensabile per il proseguimento della gravidanza, come dimostrato in casi di delezione genica (15). L’ormone lattogeno placentare si lega al recettore del GH e/o della PRL, ma sembra, inoltre, legare un suo specifico recettore (16-19).
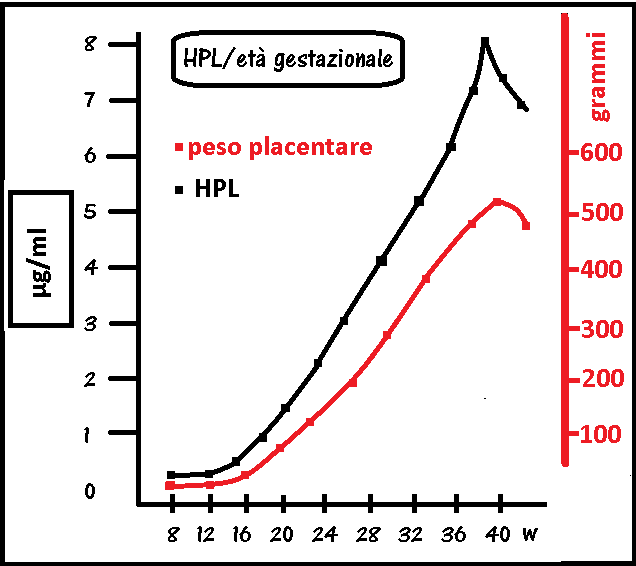
È rilevabile nel sangue materno dalla 6a settimana di gravidanza; trascurabili sono le concentrazioni nel sangue fetale, nelle urine materne e nel liquido amniotico. La concentrazione sierica materna aumenta in correlazione all’età gestazionale raggiungendo i massimi livelli a termine di gravidanza (5–7 µg/ml) ed è correlato all’aumento di peso della placenta (17). La concentrazione di HPL decade molto velocemente dopo il parto. Livelli alti di HPL si possono riscontrare nel caso di diabete mellito, eritroblastosi (30), gravidanze gemellari.
Il dosaggio seriale, e non il dato singolo, dell’HPL a termine di gravidanza permette di monitorare il benessere feto-placentare. in associazione al monitoraggio ecografico e cardiotocografico. Una produzione di HPL <10% prevede una prognosi fetale infausta (“Fetal Danger Zone” di Spellancy) (18-21). Essendo l’emivita dell’HPL di soli 15 minuti, le sue variazioni esprimono immediatamente situazioni placentari di emergenza, anche in assenza di evidenza clinica, e perciò attualmente si dà scarsa importanza ad un unico valore in assoluto dell’HPL mentre il suo monitoraggio seriale può ancora essere di aiuto in casi sospetti e non ben definiti da altre indagini (22,26). L’HPL non presenza variazioni nicturali nè in rapporto a sonno/veglia, nè in rapporto con le contrazioni uterine (27-30).
References:
- William H. Walker, Susan L. Fitzpatrick, Hugo A. Barrera-Saldaña, Diana Resendez-Perez, Grady F. Saunders: The Human Placental Lactogen Genes: Structure, Function, Evolution and Transcriptional Regulation. Endocr Rev (1991) 12 (4): 316-328.
- Vezzani, S., De Vincentis, S., Simoni, M. et al. La leptina nella fisiologia e patologia della funzione riproduttiva femminile. L’Endocrinologo (2015) 16: 219.
- Forsyth IA. Comparative aspects of placental lactogens: structure and function. Exp Clin Endocrinol. 1994; 102: 244-51.
- Barrera-Saldana HA, Seeburg PH and GF Saunders. Two structurally different genes produce the same secreted human placental lactogen hormone. J. Biol. Chem. 1983; 258: 3787-3793.
- Josimovich JB, Atwood BL, Goss DA (October 1963). “Luteotrophic, Immunologic and Electrophoretic Properties of Human Placental Lactogen”. Endocrinology. 73: 410–20.
- Guyton and Hall (2005). Textbook of Medical Physiology (11 ed.). Philadelphia: Saunders. p. 1033. ISBN 81-8147-920-3.
- PAUL A. KELLY, HAMISH A. ROBERTSON & HENRY G. FRIESEN Temporal pattern of placental lactogen and progesterone secretion in sheep Nature 248, 435 – 437 (29 March 1974);
- Beck T., Schweikhart G, Stolz E.: Immunohistochemical location of HPL, SP1 and β-HCG in normal placentas of varying gestational age. Arch. Gynecol. (1986) 239: 63. doi:10.1007/BF02133965
- Lacroix M, Guibourdenche J, et al: Placental growth hormones. Endocrine 2002;19,1:73-79.
- Hull, K. L. and Harvey, S. (2001). J. Endocrinol. 168, 1–23.
- Lacroix, M. C., Bolifraud, P., Durieux, D., Pauloin, A., Vidaud, M., and Kann, G. (2002). Biol. Reprod. 66, 555–561.
- Melen, L., Hennen, G., Dullaart, R. P., Heinen, E., and Igout, A. (2001). Clin. Endocrinol. 53, 645–647.
- Frendo, J. L., Vidaud, M., Guibourdenche, J., Luton, D., Muller, F., Bellet, D., Giovagrandi, Y., Tarrade, A., Porquet, D., Blot, P., and Evain-Brion, D. (2000). J. Clin. Endocrinol. Metab. 85, 3700–3707.
- Lacroix, M. C., Guibourdenche, J., Frendo, J. L., Muller, F., and Evain-Brion, D. (2002). Placenta 23(Suppl. A), S87-S94.
- Chellakooty, M., Skibsted, L., Juul, A., Petersen, J. H., Main, K. M., Andersson, A. M., Skouby, S., and Sakkebaek, N. E. (2000). Horm. Res. 53(Suppl. 2), 24.
- Serby M.J., Barta A., Baxter J.D., Bell G.I. and Eberhardt N.L.. Analysis of a Maior Human Chorionic Somatomammotropin Gene J. Mol. Biol. Chem. 1984; 259 No. 21, 13131-13138.
- Neville M. C., McFadden T. B., and Forsyth I.. Hormonal Regulation of Mammary Differentiation and Milk Secretion. J. of Mammary Gland Biology and Neoplasia, 2002; 7, No. 1
- Coutant, R., Boux de Casson, F., Douay, O., Mathieu, E., Rouleau, S., Beringue, F., Gillard, P., Limal, J. M., and Descamps, P. (2001). J. Clin. Endocrinol. Metab. 86, 4854–4859.
- Massin, N., Frendo, J. L., Guibourdenche, J., Luton, D., Giovangrandi, Y., Muller, F., Vidaud, M., and Evain-Brion, D. (2001). Placenta 22, S93-S97.
- Niall H. D., Hogan M.L., Sauer R., Rosenblum I.Y., Greenwood F. C.. Sequences of pituitary and placental lactogenic and growth hormone: evolution from a primordial peptide by gene reduplication. Proc. Natl. Acad. Sci. U.S.A. 1971; 68, 866.
- Boime I, McWilliams D, Szczesna E, Camel M: Synthesis of human placental lactogen messenger RNA as a function of gestation. J Biol Chemistry1976;251,10:820-825. February 10, 1976
- Badri N. Saxena, Kendall Emerson, Jr., and Herbert A. Selenkow,: Serum Placental Lactogen (HPL) Levels as an Index of Placental Function. N Engl J Med 1969; 281:225-23
- Guibourdenche J, Porquet D, Evain-Brion D: Hormones placentaires et croissance fœtale. Gynécologie Obstétrique & Fertilité Volume 29, Issues 7–8, July–August 2001, Pages 532–533
- Owerbach D., Rutter W.J., Martial J.A., Baxter J.D., Shows T.B. Genes for growth hormone, chorionic somatomammotropin, and growth hormones-like gene on chromosome 17 in humans. Science; 1980; 209 (4453); 289-92.
- Freemark M, Comer M, Korner G and S Handwerger. A unique placental lactogen receptor: implications for fetal growth. Endocrinology. 1987; 120: 1865-1872.
- Freemark M. and Handwerger S. The role of placental lactogen in the regulation of fetal metabolism and growth. J. Pediatr. Gastroenterol Nutr. 1989; 8, 281-287.
- Handwerger S, Freemark M: The roles of placental growth hormone and placental lactogen in the regulation of human fetal growth and development. J Pediatric Endocrinol Metab 2000;13:343-356
- Walsh ST, Kossiakoff AA (May 2006). “Crystal structure and site 1 binding energetics of human placental lactogen”. J. Mol. Biol. 358 (3): 773–84.
- SINGER, W, DESJARDINS P, FRIESEN H G.: Human Placental Lactogen: An Index of Placental Function. Obstetrics & Gynecology: August 1970
- Potter EL, 1943: Universal edema of fetus unassociated with erythroblastosis. Am J Obstet Gynecol 46:130-134.