Ultimo aggiornamento 2020-03-19 10:23:26
L’unico possibile trattamento eziologico attuale dell’ipertensione gestazionale è l‘interruzione della gravidanza o l’espletamento del parto, che spesso però comporta una prematurità neonatale.
Indicazioni al T.C. – indicazione elettiva assoluta in tutte le forme gravi (ipertensione grave, eclampsia, insufficienza renale acuta, sofferenza fetale acuta) oltre la 35ª w. Invece IUGR, CTG poco reattivo, flussi alterati/centralizzazione del circolo fetale costituiscono indicazioni relative al taglio cesareo, e la scelta terapeutica dovrà considerare i rischi neonatali, primi fra tutti la prematurità polmonare, le possibilità di assistenza intensiva neonatale e la risposta alla terapia medica. Oltre alla terapia medica è opportuno ospedalizzare e tenere a letto la paziente. il riposo a letto riduce edemi e ipertensione; l’ospedalizzazione consente una rapida personalizzazione della terapia (1-3).
Non tutti gli AA. sono concordi sull’utilità della terapia medica in caso di ipertensione arteriosa lieve o moderata (2). Infatti non esiste un’immediata necessità di abbassare la pressione arteriosa e la terapia non modifica il decorso della patologia. Il trattamento farmacologico antipertensivo sembra ridurre il rischio di parto pre-termine e distacco di placenta, migliora la crescita fetale e consente di guadagnare tempo utile per completare la maturazione polmonare fetale.
Occorre evitare improvvise riduzioni dei valori pressori che possono determinare ipossia fetale e distacco di placenta. D’altra parte un effetto rapido ed efficace é ricercato nelle forme di crisi ipertensive acute per prevenire danni fetali e complicanze renali a distanza (4). Differenti trattamenti sono stati proposti negli anni per il controllo dell’ipertensione in gravidanza:
1 – AGONISTI α-ADRENERGICI CENTRALI (α-metil-dopa e clonidina) – inibiscono la stimolazione ortosimpatica mediante meccanismo competitivo recettoriale: essi cioè # si legano ai recettori pre-sinaptici della noradrenalina (NA). In tal modo impediscono alla NA di legarsi ai recettori e di svolgere le sue funzioni ed inoltre
# deprimono la secrezione di NA mediante meccanismo di feed-back negativo sui centri modulatori vaso-cardiaci bulbari.
# stimolano la proteina Gi accoppiata agli α–2-recettori pre-sinaptici; questa proteina inibisce l’azione dell’adenilciclasi riducendo pertanto la formazione di c-AMP indispensabile per la contrazione della muscolatura liscia vascolare.
# gli agonisti α–2-recettoriali pre-sinaptici inibiscono i canali L (lenti) del calcio impedendo l’ingresso intracellulare degli ioni calcio (Ca++) e deprimono la sensibilità dei chemiocettori carotidei e barocettori dell’arco aortico. Con questi meccanismi gli agonisti α–2-recettori pre-sinaptici inducono diminuzione delle resistenze vascolari periferiche, aumentano il flusso renale e il filtrato glomerulare mentre non modificano la frequenza e la gittata cardiaca (121).
1A) α-metil-dopa (Aldomet® cpr 250 e 500 mg); posologia: 500 mg – 2 gr/die. Somministrato preferibilmente per via orale, è ben assorbito nel tratto gastroenterico, ma subisce un effetto di primo passaggio a livello epatico, per cui la sua biodisponibilità è solo del 25% (range 6-68%). Una dose orale di α-metil-dopa produce un effetto massimo antipertensivo in 4-6 ore, che persiste per 24 ore. Possiede una emivita di circa 2 ore, ed è escreto per via renale.
Nonostante gli effetti cardiovascolari vantaggiosi, questa sostanza possiede una efficacia terapeutica modesta. Perciò se da un lato l’α-metil-dopa viene utilizzata nella terapia dell’ipertensione lieve e moderatamente grave, dall’altro non può essere impiegata durante le crisi ipertensive, situazioni nelle quali assume una maggiore indicazione la somministrazione endovenosa di clonidina (4-24).
USO IN GRAVIDANZA: Quantunque abbia determinato alcuni casi di ipotensione fetale (5), l’α-metil-dopa è considerato sicuro per la madre e per il feto. Introdotto in terapia nel 1964, non ha finora mostrato effetti collaterali negativi sul feto (4-21). Come tale, è il farmaco da poter utilizzare come farmaco di prima scelta nella terapia della ipertensione cronica di lieve e media gravità in gravidanza.
EFFETTI COLLATERALI: un trattamento prolungato può comportare effetti collaterali materni anche a bassi dosaggi: sedazione, depressione, ipotensione posturale, secchezza delle fauci, iperprolattinemia, positività del test di Coombs diretto nel 10-20% delle pazienti; anemia emolitica (5%), febbre, alterazione della funzionalità epatica, granulocitopenia e trombocitopenia (24).
1B) Clonidina cloridrato (Catapresan® cpr 150 e 300 μg – imidazolina che agisce selettivamente sui recettori alfa2 presinaptici bloccando la liberazione della noradrenalina dal nucleo del fascicolo solitario del tratto ponto-midollare. Possiede inoltre un’azione di stimolo sui recettori imidazolici (25) e sui recettori alfa-2-adrenergici vascolari con riduzione delle resistenze vascolari periferiche, bradicadia, e riduzione del volume/minuto.
Ben tollerata dopo somministrazione orale, presenta stessa efficacia clinica, stessi dosaggi terapeutici ed effetti collaterali dell’α-metil-dopa, ma a differenza di questa, viene impiegata per via endovenosa nel trattamento delle crisi ipertensive (25-27). Dosaggio: 150-1200 microgrammi/die per os, o endovena in 3-4 somministrazioni; le infusioni endovenose vanno effettuate lentamente e diluite con 10 cc di soluzione) .
Effetti collaterali: bradicardia, pericoloso effetto rebound alla sospensione della terapia.
Antagonista della clonidina é la tolazolina (Priscol®).
1C) Guanabenz (Guanoxabenz cpr) e Guafacina: aminoguanidine che stimolano i sottotipi α2A dei recettori α2 adrenergici del tronco encefalico (nucleo solitario del pavimento del IV° ventricolo) determinando riduzione dell’efferenza simpatica dal SNC. Effetto ipotensivo direttamente proporzionale alle concentrazioni plasmatiche di noradrenalina L’attivazione dei recettori α2B-adrenergici delle cellule muscolari lisce vasali con vasocostrizione a dosi elevate (122-128).
Effetti collaterali: Determinano ipotensione ortostatica meno frequentemente rispetto ai simpaticolitici periferici; il flusso renale e funzionalità renale restano inalterati. Sindrome da sospensione. In corso di terapia con guanabenz si possono verificare diversi disturbi gastrointestinali: dispepsia, secchezza delle fauci, nausea e vomito, stipsi o diarrea, dolore addominale. Molti pazienti possono sperimentare cefalea, vertigini, sedazione, sonnolenza, disturbi del sonno. Con minore frequenza si possono osservare dolore toracico, aritmie, cardiopalmo, blocco atrioventricolare. Sono state segnalate anche turbe delle funzioni sessuali ed in particolare diminuzione della libido ed impotenza (129-136).
1D) Nitroprussiato di Na: è un sale complesso di Fe+++, cianuro e sodio. .Potente farmaco antipertensivo ad azione rapida e breve; somministrato per via endovenosa, consente un eccellente controllo pressorio momento per momento. Agisce come vasodilatatore sulle arteriole e, in misura minore, sulle venule tramite il monossido di azoto (NO) che permette la trasformazione di GPT in GMP-c che stmola il passaggio del Ca++ dal citoplasma al reticolo sarcoplasmatico e relativo rilasciamento miocellulare. Ne derivano una diminuzione delle resistenze vascolari periferiche, quindi del post-carico, ed un minor ritorno venoso, quindi una riduzione del pre-carico. La somma di questi effetti comporta una marcata riduzione della pressione arteriosa. Dosaggio: 0,5 – 10 γ/ Kg /min, diluita in solu8zione glucosata al 5% e somministrata per infusione ev continua aumentando di 0,5 gamma/Kg/min ogni 5 minuti fino al raggiungimento dell’effetto desiderato sulla pressione arteriosa.
Effetti collaterali del nitroprussiato di sodio:
– vertigini, cefalea, agitazione, nausea, vomito, acidosi metabolica
– oppressione retrosternale
– tachicardia
– tossicità da cianuro
2- β-bloccanti – Fin dal 1964 i beta-bloccanti sono stati utilizzati in gravidanza per il trattamento di patologie cardiovascolari e tiroidee (26). Agendo sui recettori β-presinaptici, questi farmaci riducono il rilascio dei neurotrasmettitori (27): ciò determina una diminuzione dell’attività simpatica cardiaca con inotropismo e cronotropismo negativi e riduzione della gittata cardiaca e della pressione arteriosa.
Nell’ambito dei beta-bloccanti, si ritrovano meccanismi d’azione differenti: Atenololo e Metoprololo, sono considerati “bloccanti specifici beta1 o cardioselettivi”, poiché capaci di bloccare i recettori beta1 a basse dosi, mentre agiscono sui recettori beta2 solo a dosaggi elevati. Per contro il Pindololo, Oxprenololo e Acetabulolo, esplicano una attività simpaticomimetica, e quindi a differenza di altri, non riducono significativamente ne la frequenza, ne la gittata cardiaca. Dati i loro scarsi effetti collaterali, i beta-bloccanti sono considerati sicuri per la madre e per il feto (28), e quindi impiegati nel trattamento dell’ipertensione in gravidanza. Oltre ad essere terapeuticamente efficaci, determinano una graduale riduzione della pressione arteriosa, pur non inducendo ipotensione posturale, ed attenuano anche gli aumenti pressori che si verificano durante l’esercizio fisico. Inoltre esplicano un effetto preventivo nei confronti della nefropatia, oltreché antiaggregante piastrinico nella preeclampsia. I beta-bloccanti sono poco indicati in presenza di malattie polmonari ostruttive croniche, ed in caso di diabete mellito; per i loro effetti cardiodepressivi non devono essere somministrati in pazienti con insufficienza cardiaca e renale (29,30).
Labetalolo (Trandate® cpr 100 mg, 200 mg) – Nell’ambito dei beta-bloccanti, merita una attenzione particolare il Labetalolo, in grado di bloccare sia i recettori β1, che quelli α; possiede altresì una modica azione β2-agonista, per la quale riduce il tono della muscolatura uterina. L’effetto antipertensivo di questo farmaco si esplica attraverso il blocco dei recettori β1, con vasodilatazione arteriolare e riduzione delle resistenze periferiche vascolari, senza variazioni della frequenza e della gittata cardiaca (31). Come gli altri beta bloccanti, il Labetalolo è terapeuticamente efficace, non determina ipotensione posturale, neanche in caso di ipovolemia, e possiede un effetto antiaggregante piastrinico; tuttavia rispetto all’alfa-metil-Dopa non presenta grossi vantaggi. Poiché implica scarsi effetti collaterali, viene ritenuto sicuro per la madre e per il feto e quindi utilizzato nel trattamento dell’ipertensione in gravidanza. Il Labetalolo è somministrato preferibilmente per os, ma può essere utilizzato anche per via endovenosa, soprattutto in caso di crisi ipertensive (32), grazie alla sua rapida, ma breve azione. Ben assorbito attraverso il tratto gastroenterico, subisce un metabolismo di primo passaggio a livello epatico, tale da accreditargli una biodisponibilità di appena il 25%; ha una emivita di 6 ore. Dosaggio: 600-2400 mg/die per os in 2-3 somministrazioni (32). Per via endovenosa richiede dosi crescenti di 20, 40, 60, 80 mg ogni 10 minuti, fino ad un massimo di 300 mg (33). Alternativamente può essere somministrato per infusione costante alla dose di 0. 5 mg/Kg all’ora, che viene aumentata ogni 30 minuti fino ad un massimo di 3 mg/Kg all’ora (34).
Atenololo, Metaprololo – Sono beta-bloccanti cardioselettivi, che non esplicano effetti simpaticomimetici. Somministrati preferibilmente per via orale, in gravidanza non hanno mostrato complicazioni materno-fetali (35,36), soprattutto del sistema nervoso centrale, data la loro scarsa liposolubilità. Devono essere usati con cautela in pazienti affetti da asma, diabete, e fenomeno di Raynaud. Dosaggio Atenololo: 100-200mg/die per os, in due somministrazioni. Metoprololo: 50-200mg/die per os in due somministrazioni.
Propanololo – Utilizzato negli Stati Uniti fin dal 1976, il Propanololo è un β-bloccante che agisce a livello dei recettori β1 e β2, ma a differenza di altre sostanze appartenenti allo stesso gruppo, non possiede attività simpaticomimetica. Poiché altamente liposolubile, è in grado di attraversare la barriera emato-liquorale; questo implica molto spesso manifestazioni a carico del sistema nervoso centrale, quali sonnolenza, stato confusionale, depressione psichica, insonnia. Nonostante l’utilizzo del Propanololo in gravidanza abbia provocato in passato alcuni casi di morte fetale (37), l’associazione con altri farmaci, quali Idralazina, non rileva una maggiore incidenza di complicanze materno-fetali, ed evidenzia una buona capacità di controllo della pressione in gravidanza, che si mantiene al di sotto di 140/90 mmHg (38). Dosaggio: 40-480 mg/die per os, in 2-3 somministrazioni.
3° VASODILATATORI PERIFERICI
A) Idralazina- Negli anni passati l’idralazina (Apresolin retard® cpr 50 mg), soprattutto in associazione con β-bloccanti, α-metil-dopa e diuretici veniva usata regolarmente nella terapia della gestosi.
Meccanismo d’azione dell’idralazina:
- vasodilatazione periferica per azione diretta sulla muscolatura liscia delle arteriole;
- diminuzione del post-carico, cioè delle resistenze a valle, che è un fatto positivo; ma producono anche una diminuzione del ritorno venoso al cuore e quindi del pre-carico con conseguente possibilità di shock ipovolemico, diminuzione della perfusione ematica periferica, oliguria, diminuzione del flusso ematico utero-placentare. Questi effetti negativi possono essere mitigati da un aumento del volume circolatorio mediante plasma-expander monitorando però la pressione intravenosa per evitare un eccessivo aumento di essa con rischio di edema cerebrale e polmonare. Dosaggio: 100-400 mg/die per os, in tre-quattro somministrazioni. Per via endovenosa: dose di carico di 20 milligrammi, seguita da una infusione continua di 2-20 mg/h, secondo la risposta della pressione diastolica (39).
Effetti collaterali:
- La comparsa di sintomatologia lupoide, registrata nel trattamento dell’ipertensione cronica, anche se piuttosto rara in gravidanza, ne ha limitato notevolmente l’uso ai casi resistenti alla terapia di 1a scelta.
- Inoltre possono comparire cefalea e dolore epigastrico che possono essere confusi con ingravescenza della eclampsia.
- tachicardia (può essere evitata associando la clonidina);
- cefalea, hot flashes
- ipotensione (sono possibili effetti avversi pericolosi per la rapida caduta della pressione arteriosa);
B) Diidralazina (Nepresol® cpr 25 mg) stesso meccanismo d’azione dell’idralazina; però a differenza di quest’ultima aumenta il flusso plasmatico renale e migliora la circolazione utero-placentare. Controindicato nei pazienti coronaropatici e nefropatici. Dosaggio: per via orale 25 mg 2 volte al giorno, (dose massima 50 mg) (40).
C) Diazossido (Proglicem® cpr 25, 100 mg) – Ha le stesse caratteristiche farmacologiche dell’Idralazina: potente vasodilatatore periferico, riduce le resistenze vascolari e la pressione arteriosa con meccanismo diretto, mentre per via simpatica riflessa induce tachicardia e aumento della gittata cardiaca. Somministrato preferibilmente per via endovenosa, il Diazossido è un farmaco dotato di una azione efficace e duratura, tale da renderlo idoneo al trattamento delle crisi ipertensive in gravidanza. Tuttavia molto spesso le brusche variazioni della pressione arteriosa che determina, sono responsabili, da un lato di ipossia fetale, per improvvisa e drastica riduzione del flusso placentare (41), dall’altro di ictus cerebrale ed infarto miocardico materno, caratteristiche queste che tendono a limitarne l’utilizzo. Nonostante provochi ritenzione idrica e salina, questi effetti non si rendono manifesti, in quanto tale vasodilatatore viene utilizzato solo per breve periodi di tempo (41). Dosaggio: miniboli ev. di 50-100 mg ad intervalli di 10-15 min.
4- Calcio-antagonisti: nifedipina (Adalat A-R® cpr 20 mg, Adalat Crono® cpr 60 mg: 20-60 mg/die, Verapramil Teva® cpr 120 mg, 240 mg); Amlodipina (Norvasc cpr 5 mg, 10 mg).
La nifedipina è il farmaco di 1a scelta nella pre-eclampsia e nelle crisi ipertensive. Non associare a β-bloccanti. Blocca l’afflusso di calcio all’interno delle cellule muscolari. Bloccando il flusso di calcio extracellulare attraverso i canali lenti di membrana ed interferendo con il rilascio dello ione dai depositi, questi farmaci sono in grado di impedire l’interazione actina-miosina e conseguentemente l’accoppiamento eccitazione-contrazione. Il meccanismo con cui i Calcio antagonisti esplicano la loro azione di blocco del calcio va ricondotto ad una serie di possibilità: blocco del gate d’ingresso, competizione con gli ioni calcio al gate sul lato esterno della membrana plasmatica, modificazioni del canale o interferenza con il passaggio degli ioni calcio, interferenza con il rilascio di calcio attivato, sul cancello del lato interno della membrana cellulare (42). Dosaggio nifedipina: 40-120 mg/die per os.
L’utilizzazione clinica dei calcio-antagonisti in pazienti con ipertensione gestazionale ha consentito di raggiungere un livello stabile di pressione arteriosa in maniera rapida, senza effetti lesivi a livello del comparto utero-placentare, con una riduzione delle complicanze renali e circolatorie materni. I calcio-antagonisti possiedono anche una modesta azione tocolitica. La sua rapidità di azione anche come vasodilatatore si evidenzia maggiormente nelle situazioni in cui i valori di pressione arteriosa di partenza sono più elevati. La via di somministrazione sublinguale consente di avere un’azione che inizia dopo appena 2-5 minuti contrariamente alla somministrazione per via orale in cui l’azione dei farmaci viene avvertita dopo 10-15 minuti. (43,44).
5 – Diuretici: I Diuretici sono farmaci antipertensivi, che riducono gittata cardiaca e pressione sanguigna inibendo il riassorbimento di NaCl e di acqua a livello dei tubuli renali.
In teoria dovrebbero essere controindicati perché producono una diminuzione della perfusione periferica già compromessa dalla gestosi. Infatti l’ipertensione indotta dalla gravidanza ha basi fisiologiche diverse da quelle dell’ipertensione essenziale: nella gestosi si tratta di una patologia da ridotta espansione del volume plasmatico con aumento delle resistenze periferiche e i diuretici inducono emoconcentrazione, con ulteriore aumento delle resistenze periferiche..
I diuretici sono utili in caso di edemi notevoli in gravide portatrici di insufficienza cardiaca e in caso di pazienti affette da ipertensione cronica sodio-sensibile già in terapia con diuretici. Sono comunque rigorosamente controindicati nella pre-eclampsia e in caso di IUGR .(45).
Posologia: Dosi minori di 25 mg (12,5 mg di idroclorotiazide/die) hanno dimostrato pari efficacia soprattutto in associazione a beta-bloccanti. Dosi più elevate di diuretici hanno efficacia antipertensiva appena superiore, a prezzo di effetti collaterali più rilevanti: deplezione eccessiva di Na+, soprattutto se somministrate a pazienti che seguono diete iposodiche e conseguente rischio di attivazione adrenergica. Anche i diuretici dell’ansa a breve durata di azione (furosemide – Lasix cpr 25 mg, fiale), in genere riservati a soggetti con edema o insufficienza renale, hanno effetto antipertensivo in altri soggetti, ma necessitano di somministrazioni multiple giornaliere. Il metolazone é altrettanto potente e può essere somministrato una sola volta al giorno (45).
I diuretici, la cui azione si esplica principalmente attraverso una perdita di sodio, causano aumento delle renina plasmatica che a sua volta provoca vasocostrizione mediata da angiotensina.
I diuretici si associano bene ai β-bloccanti che inibiscono il rilascio di renina, ad ACE inibitori che inibiscono la formazione di angiotensina II ed a calcio antagonisti che si oppongono direttamente alla vasocostrizione da essi indotta.
Nonostante queste riserve i diuretici rimangono tra i farmaci di prima scelta in donne anziane obese o soggetti neri (46,47).
6 – ACE inibitori (Triatec cpr 5 mg, 10 mg): Sono farmaci che abbassano la pressione arteriosa inibendo l’enzima di conversione dell’angiotensina (ACE) l’inattivazione della chininasi II (48), e l’aumento delle prostaglandine con effetto vasodilatatore.
Sotto l’effetto degli ACE-Inibitori le resistenze periferiche vascolari diminuiscono, la gittata e la frequenza cardiaca, così come il flusso plasmatico renale e la filtrazione glomerulare non risultano significativamente modificati. L’inibizione dell’enzima di conversione dell’angiotensina,
Nell’ipertensione nefrovascolare in cui l’alta reninemia é alla base del meccanismo ipertensivo, gli ACE inibitori sono da considerarsi logicamente terapia di prima scelta. Gli Ace-inibitori agiscono sul sistema renina-angiotensina-aldosterone. La renina trasforma l’angiotensinogeno prodotto dal fegato in angiotensina I che a sua volta, per azione dell’enzima convertente (ACE), viene trasformato in angiotensina II. Quest’ultima è un potente vasocostrittore, in grado di stimolare il rilascio di aldosterone causando un aumento del riassorbimento del sodio a livello del tubulo distale, riduce il flusso renale determinando vasocostrizione delle arteriole efferenti dei glomeruli con effetto netto di riduzione del filtrato glomerulare, ha un effetto permissivo sul rilascio di noradrenalina dalle terminazioni nervose simpatiche. L’angiotensina induce inoltre la secrezione di vasopressina, con aumento della volemia. L’effetto netto principale è la ritenzione idrico-salino. Altra funzione degli ACE-inibitori è l’ìnibizione della degradazione delle bradichinine, peptidi vasodilatatori. Come effetto dell’Ace-inibizione si ha quindi diminuzione della sintesi di angiotensina II, riduzione della secrezione di aldosterone con aumento della natriuresi, riduzione della degradazione delle bradichinine con effetto vasodilatatore. Queste ultime possiedono azione mista di vasodilatazione arteriolare e venosa. Recentemente sono stati identificati sistemi renina-angiotensina in molti tessuti: vasi sanguigni, cuore, surrene, rene e cervello. La vasocostrizione può essere quindi indotta sia da angiotensina circolante sia da angiotensina sintetizzata in loco.
Il Captopril (Capoten® cpr 25, 50 mg) è il farmaco capostipite degli ACE inibitori ed il più studiato del gruppo; somministrato sperimentalmente nell’animale, si è dimostrato capace di attraversare in quantità considerevoli la barriera emato-encefalica, e di ridurre il flusso di sangue utero-placentare, con depressione neonatale, oltreché maggiore incidenza di IUGR, aborti e morte fetale (49-52).
7 – Renina inibitori: Aliskiren (Rasilez® cpr 150, 300 mg): è il primo inibitore diretto della renina, approvato dalla Commissione europea il 22 agosto 2007, legandosi all’enzima, ne blocca l’attività, impedendo la conversione dell’angiotensinogeno in angiotensina I, produce significativa riduzione, dose correlata, della pressione arteriosa sistolica e diastolica nei pazienti ipertesi; la risposta pressoria si amplifica con il pretrattamento con idroclorotiazide. Posologia: 150-300 mg/die in unica somministrazione, grazie all’emivita prolungata di aliskiren (>24 ore), sempre alla stessa ora. Lo stato di equilibrio, “steady state” viene raggiunti in 6-7 giorni. Deve essere evitata la somministrazione contemporanea con succo di frutta e/o con bevande contenenti estratti vegetali (inclusi gli infusi di erbe) che riducono del 30-50% l’efficacia di Rasilez (137-140). Sconsigliato nei pazienti con insufficienza renale.
8 – Aspirina a basse dosi (100 mg/die) ha fornito finora risultati incoraggianti nonostante il parere discorde di molti AA (54-56). I bassi dosaggi sono capaci di ridurre la produzione di trombossano senza diminuire la produzione di prostaciclina (87-91). Ha efficacia sul vasospasmo e sulle turbe coagulative. Riduce la percentuale dell’insorgenza di pre-eclampsia del 24% nelle donne a rischio, riduce il rischio di parto pretermine del 14%, previene l’insufficienza placentare e IUGR consentendo al feto di raggiungere il suo potenziale genetico di crescita (92-96). Tali risultati sono stati raccolti in studi multicentric coordinati dall’American College of Obstetricians and Gynecologists (ACOG), World Health Organization (WHO), National Institute for Health and Clinical Excellence, American Heart Association, American Stroke Association e American Academy of Family Practice (57).
Effetti collaterali indesiderati dell’aspirina:
- alterazioni dell’aggregazione piastrinica per cui possono provocare emorragie prolungate post-partum se il farmaco viene assunto negli ultimi 5 giorni prima del parto; Se invece viene sospeso negli ultimi 5 giorni prima del parto, non si hanno fenomeni clinici evidenti.
- Emorragie neonatali intracraniche e/o del tratto gastroenterico per alterazioni dell’aggregazione piastrinica e deficit del fattore XII. L’aggregazione piastrinica nel neonato è già molto inferiore rispetto all’adulto.
- Prolunga la durata della gravidanza con effetti variabili (effetti positivi se si desidera prolungare la durata della gestazione in caso di minaccia di parto prematuro o di basso peso del neonato. Lo stesso effetto in una gravidanza post-matura è pericoloso. Tale effetto è dovuto all’azione antiprostaglandinica dell’ac. acetil-salicilico; Le prostaglandine infatti al termine della gravidanza aumentano il tono della muscolatura liscia e stimolano al contrattilità uterina in modo ritmico; in tal modo influenzano l’inizio e la durata del travaglio.
- L’associazione con caffeina induce un rallentamento della crescita fetale.
- chiusura precoce del dotto di Botallo con ipertensione polmonare e distress grave respiratorio. E’ una rara complicazione nel regime terapeutico con dosi così basse di aspirina. Il dotto di Botallo permette alla circolazione fetale di bypassare i campi polmonari e favorisce il passaggio diretto del sangue ossigenato dall’arteria polmonare all’aorta. L’apertura del dotto di Botallo è mantenuta dalle prostaglandine mentre inibitori delle ciclossigenasi favoriscono la sua chiusura (66-70).
Cardioaspirina o aspirinetta? Il principio attivo è presente sia nell’aspirinetta che nella cardioaspirina nello stesso dosaggio, 100 mg, però nella cardioaspirna il medicinale appare associato ad un rivestimento gastro- protettivo, in modo da proteggere le pareti dello stomaco da eventuali irritazioni, ulcere e sanguinamenti. La presenza del rivestimento nella cardioaspirina sì e non nella aspirinetta, nonostante la stessa quantità di principio attivo, differenzia in maniera sostanziale il metabolismo dei due medicinali, rendendo l’aspirinetta un antinfiammatorio di pronto intervento, mentre la cardioaspirina è ad assorbimento più lento che la rende un farmaco perfetto da utilizzare come anti-trombotico (71-75).
protettivo, in modo da proteggere le pareti dello stomaco da eventuali irritazioni, ulcere e sanguinamenti. La presenza del rivestimento nella cardioaspirina sì e non nella aspirinetta, nonostante la stessa quantità di principio attivo, differenzia in maniera sostanziale il metabolismo dei due medicinali, rendendo l’aspirinetta un antinfiammatorio di pronto intervento, mentre la cardioaspirina è ad assorbimento più lento che la rende un farmaco perfetto da utilizzare come anti-trombotico (71-75).
9 – Fattori dietetici e nutrizionali
Dagli studi effettuati è emerso che né i supplementi proteico-calorici, né la riduzione delle proteine nella dieta hanno effetti sull’incidenza della preeclampsia (58) Altri studi riguardanti la supplementazione dietetica con antiossidanti, come le vitamine C ed E, non hanno dimostrato effetti protettivi sull’incidenza di preeclampsia (59). Secondo i ricercatori Padayatty and Levine del National Institute of Health statunitense, tuttavia, nello studio precedentemente citato era stato sottovalutato l’effetto di sostanze come l’acido ascorbico, le cui concentrazioni plasmatiche non erano state riportate dagli autori e potevano quindi essere simili tra il gruppo di trattamento e quello di controllo. Inoltre le dosi somministrate, pari a un grammo al giorno, sempre secondo i due ricercatori sarebbero state insufficienti ad aumentare adeguatamente i livelli plasmatici e intracellulari di ascorbato (60) e gli studi avrebbero dovuto prevedere dosaggi più alti di vitamina C per mostrarne gli effetti benefici. Anche bassi livelli di vitamina D potrebbero costituire un fattore di rischio per la preeclampsia (61,108,109). La supplementazione di calcio in donne con basse concentrazioni di questo elemento nella dieta non riduce l’incidenza di preeclampsia, ma diminuisce la frequenza di complicanze gravi (62,108). Studi epidemiologici hanno riportato una correlazione inversa tra incidenza di preeclampsia, ipertensione in gravidanza e calcio nella dieta: bassa incidenza nelle popolazioni etiopi e guatemalteca (alto calcio nella dieta), elevata incidenza nella popolazione giapponese (basso livello di calcio nell’alimentazione). Il basso apporto di calcio può causare ipertensione stimolando la liberazione di paratormone o di renina, provocando quindi un aumento del calcio nella muscolatura liscia vascolare e conseguentemente un aumento della contrattilità. Bassi livelli di selenio nel sangue sono associati con una maggiore incidenza di preeclampsia rispetto ai controlli (63,64,109).
Anche per gli acidi grassi essenziali (EFA, Essential Fatty Acids) o acidi grassi polinsaturi (omega 3: ALA + DHA + EPA) è stato dimostrato un ruolo nell’incidenza delle malattia. Il razionale dell’uso degli omega 3 risiede nella loro possibilità di interferire col metabolismo degli eicosanoidi riducendo la produzione di tromboxano (vasocostrittore ed aggregante piastrinico) senza interferire con la produzione endoteliale di prostaciclina come confermato .dalle osservazioni epidemiologiche sulla bassa incidenza di patologia cardiovascolare, preeclampsia ed eclampsia nelle popolazioni eschimesi nelle quali è elevato l’apporto dietetico di tali sostanze (65). Recentemente altri AA. contestano la fondatezza di tali conclusioni. Essi affermano che, dal punto di vista della ‘evidence-based medicine, il fish oil (Omega 3 fish oil capsule molli 1 gr) può ridurre l’incidenza di parti pretermine nel sottogruppo di pazienti con precedenti parti pretermine, ma non vi é alcun effetto positivo sul rischio di preeclampsia e ipertensione indotta dalla gravidanza e/o di ritardo di crescita intrauterina (110-115).

SCHEMI RIASSUNTIVI DI TRATTAMENTO DELL’IPERTENSIONE IN GRAVIDANZA
ll trattamento farmacologico adottato nell’ipertensione in gravidanza, per essere razionale, deve tenere conto di numerose variabili: effetti emodinamici, meccanismi patogenetici alla base dell’azione antipertensiva, caratteristiche dei singoli farmaci.
Qui di seguito esamineremo i procedimenti terapeutici più idonei da adottare in relazione al grado di ipertensione.
1) Ipertensione gestazionale moderata (PAD <110 mm Hg)
E’ caratterizzata dall’aumento delle resistenze sistemiche e dalla riduzione del volume plasmatico; richiede l’impiego dei calcio antagonisti (nifedipina 40mg/die), eventualmente associato all’infusione di albumina (25-50mg/die) per ripristinare la volemia o correggere l’iponchia (albuminemia al di sotto di 3,0g/dl), se presente, secondo la formula: mg di albumina da somministare = 2 x (incremento desiderato in g/dl x peso corporeo in Kg x 0.4).
2) Ipertensione gestazionale severa (PAD ≥/110 mm Hg) e preeclampsia
Una pressione diastolica superiore o uguale a 110 mmHg o una proteinuria significativa, o l’emergenza di danno degli organi bersaglio, sono segni prognostici e clinici peggiorativi. In queste condizione, è verosimile che a livello cellulare si presenti un deficit funzionale delle membrane plasmatiche.
La terapia va quindi improntata sui calcio antagonisti: nifedipina 40-60 mg/die da sola, o 60-120 mg/die in eventuale associazione a 25-50 mg/die di albumina, e completata con beta-bloccanti, quali labetalolo 200-400 mg/die o atenololo 100 mg/die.
3) Ipertensione cronica e gestosi sovrapposta
Presenta due possibilità evolutive:nella prima il letto vascolare uterino possiede le stesse caratteristiche della gravidanza normotesa. Col procedere della gravidanza, ne conseguirà un adattamento vascolare che richiederà una riduzione od una sospensione dei farmaci. Se la paziente era sottoposta prima della gravidanza a terapia, questa dovrà essere riconsiderata in base alle esigenze attuali, preferendo un trattamento con beta-bloccanti. Vanno comunque evitati tanto i farmaci diuretici quanto quelli ACE-inibitori.
La seconda possibilità evolutiva si esplica sul versante opposto: in questo caso, l’adattamento vascolare proprio della gravidanza non si svolge, per cui la trofoblastizzazione procede come nell’ipertensione gestazionale. Tutto ciò determina un aumento dei livelli pressori diastolici dopo la ventesima settimana o una proteinuria significativa. In tal caso si parla di ipertensione cronica con “gestosi” sovrapposta: la paziente sarà sottoposta alla stessa terapia dell’ipertesa gestazionale grave.
Qualora la donna abbia iniziato un trattamento farmacologico già prima della gravidanza, questo va sospeso, sostituendolo con un’associazione di calcio antagonisti: nifedipina 40-120 mg/die, se necessario albumina: 25-50 mg/die, beta-bloccanti: atenololo 100 mg/die, oppure con vasodilatatori: idralazina 75 mg/die.
TERAPIA DELLA PROTEINURIA: la proteinuria ortostatica e la proteinuria transitoria sono condizioni benigne che evolvono positivamente senza necessità di terapia medica. Nelle gravide con proteinuria persistente, la terapia è eziologica associando misure precauzionali che restano le uniche possibili in caso di proteinuria sintomatica:
- Alimentazione iperproteica
- Albumina umana endovena (obbligatoria se l’albuminemia è < 3 gr%)
- Pentossifillina (Trental® cpr 600 mg) dotata di proprietà proprietà anti-infiammatorie e antitrombotiche si è rivelata utile nelle gravide con nefropatia diabetica di tipo 2 per la riduzione della proteinuria e rallentare l’evoluzione della sindrome nefrosica verso l’insufficienza renale (53,76,77)
- ACE inibitori (Triatec cpr 5/10 mg, Capoten® cpr 25, 50 mg; Enapren® cpr 5 mg, 20 mg) (77)
- Limitazione di caffè, tè e cacao – La caffeina o 1, 3, 7-trimetilxantina è una tra le sostanze farmacologicamente attive più consumate nel mondo essendo contenuta in numerose bevande e aggiunta a diversi farmaci soprattutto analgesici. I principali meccanismi d’azione comprendono l’inibizione dell’enzima fosfodiesterasico e dei recettori adenosinici ed i suoi effetti si realizzano praticamente su tutto l’organismo. Solo recentemente la letteratura si è orientata a definire il rapporto esistente tra questa molecola ed il rene e non c’è ancora un accordo sulla sua eventuale tossicità. Se alcune ricerche sperimentali hanno infatti dimostrato che la caffeina può aggravare condizioni patologiche quali la policistosi e la proteinuria, altre ne hanno invece evidenziato le potenzialità protettive in diversi contesti.
TERAPIA DEGLI EDEMI:
- riposo a letto: è la misura terapeutica più efficace; Questa sola prescrizione fa diminuire di molto gli edemi fino talvolta a farli scomparire del tutto. Preferire il decubito laterale sinistro per evitare fenomeni compressivi sulla cava.
- Dieta iperproteica (1.5-2 gr/Kg/die)
- Somministrazione di albumina umana endovena in caso di ipoalbuminemia.

TERAPIA DELLA FASE ECLAMPTICA CONVULSIVANTE:
- Isolare la paziente in ambiente tranquillo
- Assicurare alla paziente una buona ventilazione polmonare
- inserire cannula venosa
- catetere vescicale per controllare diuresi
- bloccare le convulsioni
- abbassare la PA
- riequilibrare il metabolismo
Anticonvulsivanti:
- Solfato di Magnesio (MgSO4) fl e.v. (Magnorbin®): è il farmaco di 1a scelta nella terapia delle convulsioni eclamptiche. E’ utilizzato secondo lo schema Magpie Trial (84): 2-4 gr (2 fl da 2 gr) quindi 1-2 gr/60’ diluiti in 500 cc di soluzione fisiologica o Riger per infusione endovenosa continua. L’impiego orale del Mg non previene la pre-eclampsia; la somministrazione intramuscolare è dolorosa mentre Il bolo e.v. ha un’emivita troppo breve. Il Mg e il Ca hanno un’influenza complessa interdipendente sulla eccitabilità dei componenti della giunzione neuromuscolare (78,79). Il Mg iniettato ha un’azione curariforme sulla giunzione neuromuscolare bloccando il rilascio dell’acetilcolina con riduzione della contrattilità della muscolatura liscia e l’irritabilità del SNC. In condizioni di normalità non sono necessarie rilevazioni della concentrazione ematica del magnesio: non è noto nemmeno quale sia il livello terapeutico ottimale della magnesemia. Il trattamento va continuato per 24 ore o fino alla scomparsa delle contrazioni. E’ possibile ripetere il trattamento se compaiono nuove indicazioni. Se il trattamento precedente è terminato da sole 6-8 ore, non si deve ripetere il carico iniziale, ma si ricomincia la somministrazione di MgSO4 secondo lo schema di mantenimento. L’utilizzazione del solfato di magnesio per la terapia della pre-eclampsia e per la prevenzione delle varietà più gravi di eclampsia non è giustificata considerando i rischi e gli eventuali benefici (85,86).
Effetti collaterali del (MgSO4):
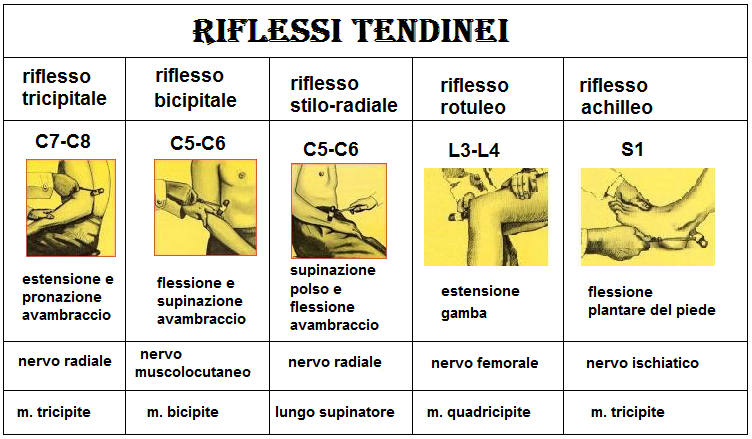
- riduzione dei riflessi tendinei; poichè la riduzione dei riflessi tendinei avviene a concentrazioni sieriche molto basse, la presenza anche parziale del riflesso rotuleo una situazione di assoluta sicurezza del dosaggio di MgSO4 adottato (80-82).
- riduzione della contrattilità uterina,
- diminuzione della diuresi fino all’anuria per blocco del muscolo detrursore, controllare la diuresi per rilevare tempestivamente una condizione di oliguria (meno di 100 ml in 4 ore). La diuresi può essere raccolta col dispositivo che calcola la diuresi oraria;
- paralisi respiratoria e blocco cardiaco in diastole (per dosaggi molto alti). La riduzione degli atti respiratori (<12-16 atti al minuto) dovrebbe essere associata all’assenza dei riflessi. Interrompere l’infusione, inoculare lentamente e.v. in circa 3 minuti 10 cc di calcio gluconato al 10%, mettere O2 in maschera (6 lt/min al 40%), allertare il servizio di anestesia per una eventuale assistenza respiratoria urgente. Sospendere tali procedure alla ricomparsa di una normale frequenza respiratoria e riprendere l’infusione di magnesio alla ricomparsa dei riflessi.
- Ematuria: dimezzare la dose di magnesio ed incrementare l’infusione di liquidi associata (circa 75-80 cc/ora di liquidi di supporto) fino alla ricomparsa di urine chiare.
4. Sedativi e tranquillanti (Diazepam)

PREVENZIONE DELL’IPERTENSIONE ARTERIOSA IN GRAVIDANZA (66-75, 111-113):
A) Attività fisica leggera per 45’ tre volte alla settimana
B) Dieta iposodica e ipoglicidica personalizzata
C) Esercizi di relax muscolare ogni giorno per 30’
D) Supplementazione di calcio (62,108)
F) Flussimetria aa. uterine e a. ombelicale: l’utilizzo della velocimetria doppler delle arterie uterine ha consentito di ‘ricodificare’ il rischio della gravidanza. L’assenza notch bilateralmente ha dimostrato un ottimo valore predittivo negativo nella popolazione ad alto rischio anamnestico. La sensibilità del test per la preeclampsia a insorgenza prima di 32 w e associata a ritardo di crescita intrauterina è risultata del 93%, mentre la sua sensibilità per la preeclampsia a qualsiasi epoca di gravidanza e non associata a ritardo di crescita è risultata solo del 24%, sottolineando quindi come nella valutazione della predittività di questo test e quindi del suo possibile utilizzo clinico, sia fondamentale non solo una corretta definizione diagnostica (preeclampsia versus ipertensione gestazionale isolata), ma anche una definizione della gravità della sindrome e della presenza di associata ‘insufficienza placentare (116-120).
PREVENZIONE DELLA CID

Bibliografia:
- Lubbe WF. Hypertension in pregnancy: pathophysiology and management. Drugs 1984; 28:170
- F.P. Schena, F.P. Selvaggi, L. Gesualdo, M. Battaglia, Malattie dei reni e delle vie urinarie, 4ª ed., Milano, McGraw-Hill, 2008, pp. 389-390
- Abalos E, Duley L, Steyn DW, Henderson-Smart DJ Antihypertensive drug therapy for mild to moderate hypertension during pregnancy (Review) The Cochrane Library 2007, Issue 4 Published by JohnWiley & Sons, Ltd
- Gallery EDM Saunders DM, Hunyor SN, Gyroy AZ. Randomized comparison of methyldopa and oxprenolol for treatment of hypertension in pregnancy Br Med J 1979; 1:1591
- Whitelaw A. Maternal methyldopa treatment and neonatal blood pressure. Br Med J 1981; 283:471
- Voto L, Lapidus A, Neira J, Margulies M. Atenolol vs alpha methyldopa in the treatment of hypertension in pregnancy. 5th International Congress for the International Society for the study of Hypertension in Pregnancy; 1986 July 7-10; Nottingham, UK. 1986:138.
- Voto LS, Lapidus AM, Neira J, Margulies M. Treatment of hypertension during pregnancy: Atenolol versus Methyldopa [Tratamiento de la hipertensión en el embarazo: Atenolol versus Alfa Metildopa].Obstetricia y Ginecología Latino-Americanas 1985;43(9-10):335–41
- Voto LS, Zin C, Neira J, Lapidus AM,Margulies M. Ketanserin versus alpha methyldopa in the treatment of hypertension during pregnancy: a preliminary report. Journal of Cardiovascular Pharmacology 1987;10(Suppl 3):S101–S103
- Casavilla F, Vega HR. Prospective and randomized study on mepindolol and alpha-methydopa efficacy in arterial hypertension (AH) treatment during pregnancy. World Congress of Gynecology and Obstetrics; 1988 October 23-28; Brazil. 1988:182.
- Livingstone I, Craswell PW, Bevan EB, Smith MT, Eadie MJ. Propranolol in pregnancy – three-year prospective study. Clinical and Experimental Hypertension 1983;2:341–50.
- Gallery EDM,Hunyor SN, SaundersDM,Gyory AZ. A randomized trial of oxyprenolol and a-methyl dopa in therapy of hypertension in pregnancy. 1stCongress of the International Society ofHypertension in Pregnancy; 1978 September 27-29; Dublin, Ireland. 1978:88.
- Gallery EDM, RossMR,Gyory AZ. Antihypertensive treatment in pregnancy: analysis of different responses to oxprenolol and methyldopa.BMJ 1985;291:563–6.
- Gallery EDM, Saunders DM, Hunyor SN, Gyory AZ. Randomised comparison of methyldopa and oxprenolol for treatment of hypertension in pregnancy. BMJ 1979;1:1591–4.
- Kahhale S, Zugaib M, Carrara W, Paula FJ, Sabbaga E, Neme B. Comparative study of chronic hypertensive pregnant women treated and non-treated with pindolol [Estudio comparativo de gestantes
- hipertensas crônicas tratadas e näo tratadas com betabloqueador pindolol]. Ginecologia e Obstetrícia Brasileiras 1985;8(2):85–9.
- Freire S, de França LA, Rau de Almeida Callou M, Alves de Oliveira JE, Barbosa Filho J. Comparative study with pindolol and methyldopa in pregnant women with chronic hypertension [Estudo comparativo
- com pindolol e metildopa em gestantes com hipertensão arterial crônica]. Jornal Brasileiro de Ginecologia 1988;98(3):157–60.
- Plouin PF, Breart G, Llado J, DalleM, KellerME,GoujonH, et al. A randomized comparison of early with conservative use of antihypertensive drugs in the management of pregnancy-induced hypertension. British Journal of Obstetrics and Gynaecology 1990;97:134–41.
- Plouin PF, Breart G, Maillard F, Papiernik E, Relier JP, Labetolol Methyldopa Study Group. Antihypertensive efficacy and perinatal safety of labetalol in the treatment of hypertension in pregnancy:
- a randomised comparison to methyldopa [Effets maternels et securite perinatale du labetalol dans le traitement des hypertensions de la grossesse. Comparaison a la methyldopa par un essai cooperatif randomise]. Archives des Maladies du Coeur 1987;80:952–5.
- Plouin PF, Breart G,Maillard F, Papiernik E,Relier JP, the Labetolol mMethyldopa Study Group. Comparison of antihypertensive efficacy and perinatal safety of labetalol and methyldopa in the treatment of hypertension in pregnancy: a randomized controlled trial. British Journal of Obstetrics and Gynaecology 1988;95:868–76.
- Blazquez, Lardoux H, Leperlier E. Randomized and comparative study of methyl dopa (MD), acebutolol (ACE) and labetalol for the treatment of moderate hypertension during pregnancy (HDP). 6th International Congress, International Society for the Study ofHypertension in Pregnancy; 1988May 22-26; Montreal, Quebec, Canada.1988:100.
- Lardoux H, Blazquez G, Leperlier E, Gerard J. Randomized and comparative study of methyldopa (MD), acebutolol (ACE) and labetalol for the treatment ofmoderate hypertension during pregnancy (HDP) [Essai ouvert, comparatif, avec tirage au sort pour le traitement de l’HTA gravidique moderee: methyldopa, acetbutolol, labetalol]. Archives des Maladies du Coeur 1988;91:137–40.
- Redman CW, Beilin LJ, Bonnar J. Treatment of hypertension in pregnancy with methyldopa: Blood pressure control and side effects. Br J Obstet Gynaecol 1977; 84:419
- Johnston CI, Aickin DR. The control of high blood pressure during labour with chlonidine (catapres) Med J Australia 1971; 2:132
- Rubin PC. Beta-blockers in pregnancy N Engl J Med 1981; 305:1323
- Rand M J, Majewsky H, Medgett I C, McCullough N W, Story D F Prejunctional receptors modulating autonomic neuroeffector transmission. Circulation Res 1980; 46 (Suppl 1) :1
- Liedholm H. Atenolol in the treatment of hypertension of pregnancy. Drugs 1983; 25 (Suppl 2) :206
- Jannet D, Carbonne B, Sebban E,Milliez J.Nicardipine vs metoprolol in the treatment of hypertension during pregnancy: a randomized comparative trial. International Journal of Gynecology & Obstetrics 1995;49:225.
- Jannet D, Carbonne B, Sebban E, Milliez J. Nicardipine vs metoprolol in the treatment of hypertension during pregnancy: a randomized comparative trial. Obstetrics & Gynecology 1994;84:354–9.
- MacCarthy EP, Bloomfield SS. Labetalol: a review of its pharmacology, pharmacokinetics, clinical uses, and adverse effects. Pharmacotherapy 1983; 3:193
- Cumming AM, Brown JJ, Lever AF, Mackay A, Robertson JI. Treatment of severe hypertension by repeated bolus injections of labetalol. Br J Clin Pharmacol 1979; 8:1998
- Mabie W C, Gonzalez A R, Sibai BM, Amon E. A comparative treat of labetalol and hydralazine in the acute management of severe hypertension complicating pregnancy. Obstet Gynecol 1987; 79:328
- Michael CA. Intravenous labetalol and intravenous diazoxide in severe hypertension complicating pregnancy. Aust NZ J Obstet Gynaecol 1986; 26:26
- Eliahou H E, Silverberg D S, Reisin E, et al. Propanolol for the treatment of hypertension during pregnancy. Br Med J 1978; 2:670
- Bott-Kanner G, Schweitzer A, Reisner SH, et al. Propanolol and hydralazine in the management essential hypertension in pregnancy. Br J Obstet Gynecol 1980; 87:110
- Bott-Kanner G, Schweitzer A, Reisner SH, et al. Propanolol and hydralazine in the management essential hypertension in pregnancy. Br J Obstet Gynecol 1980; 87:110
- Hogstedt S, Lindberg B, Peng DR, et al. Pregnancy-induced increase in metoprolol metabolism. Clin Pharmacol Ther 1985; 37:688
- Winderlov E, Karlman I, Storsater J. Hydralazine-induced neonatal thrombocitopenia (letter) N Engl J Med 1980; 301:1235
- British national formulary, Guisa all’uso dei farmaci 4 edizione, Lavis, agenzia italiana del farmaco, 2007.
-
Neuman J, Weiss B, Kabello Y, Cabal L, Freeman RK. Diazoxide for the acute control of severe hypertension complicating pregnancy: a pilot study. Obstet Gynecol 1979; 53:505
- David-Dufilho M, Devynck MA, Kazda S, Meyer P. Stimolation by nifedipine of calcium transport by cardiac sarcolemmel vescicles from spontaneously hypertensive rats. Eur J Pharmacol 1984; 97:121
- Romanini C, Tranquilli AL. Introducing nifedipine in the treatment of hypertensive disorders of pregnancy. It J Obstet Gynaecol 1991;2:2924)
- Broughton Pipkin F, Chinnery E. The effects of a calcium antagonist, nitrendipine, on the responses of isolated strips of human chorionic plate artery to prostaglandins E-2 and E-1. Br J Pharmacol 1985; 86:705
- Sibai BM, Grossman RA, Grossman HG. Effects of diuretics on plasma volume in pregnancies with long-term hypertension. Am J Obstet Gynecol 1984; 150:831
- Pritchard JA, Walley PJ. Severe hypokalaemiadue to prolonged administration of chlorothiazide during pregnancy. Am J Obstet Gynaecol 1961; 81:1241
- Rodriguez SU, Leikin SL, Hiller MC. Neonatal thrombocytopenia associated with antepartum administration of thiazide drugs. New Engl J Med 1964; 270:881
- KK. Ng, JR. Vane, Conversion of angiotensin I to angiotensin II. in Nature, vol. 216, nº 5117, novembre 1967, pp. 762-6
- Broughton-Pipkin F, Symonds EM Turner SR. The effect of captopril (SQ 14,225) upon mother and fetus in the chronically cannulated ewe and in the pregnant rabbit. J Physiol 1982; 323:415
- Duminy PC, du T Burger. Fetal abnormality associated with the use of captopril during pregnancy South Afr Med J 1981; 60:805Broughton-Pipkin F, Baker PN, Symonds EM. ACE-inhibitors in pregnancy. Lancet 1989; 2:96
- Mathews DD. A randomized controlled trial of bed rest and sedation or normal activity in late pregnancy Br J Obstet Gynaecol 1977; 84:108
- P. Castro-Moreno, JP. Pardo; R. Hernández-Muñoz; JJ. López-Guerrero; L. Del Valle-Mondragón; G. Pastelín-Hernández; M. Ibarra-Barajas; R. Villalobos-Molina, Captopril avoids hypertension, the increase in plasma angiotensin II but increases angiotensin 1-7 and angiotensin II-induced perfusion pressure in isolated kidney in SHR. in Auton Autacoid Pharmacol, vol. 32, 3 Pt 4, ottobre 2012, pp. 61-9
- J. Roozbeh, MA. Banihashemi; M. Ghezlou; R. Afshariani; S. Salari; M. Moini; MM. Sagheb, Captopril and combination therapy of captopril and pentoxifylline in reducing proteinuria in diabetic nephropathy. in Ren Fail, vol. 32, nº 2, gennaio 2010, pp. 172-8,
- Barton JR, Sibai BM. Prediction and prevention of recurrent preeclampsia. Obstet Gynecol. 2008 Aug;112(2 Pt 1):359-72. Review. PubMed PMID: 18669736.
- Duley L, Henderson-Smart DJ, Knight M, King JF, Antiplatelet agents for preventing pre-eclampsia and its complications in Cochrane Database of Systematic Reviews, nº 1, 2004
- Ann Intern Med. Pubblicato online 9 settembre 2014 doi:10.7326/M14-1884
- CA. Koelman, AB. Coumans; HW. Nijman; II. Doxiadis; GA. Dekker; FH. Claas, Correlation between oral sex and a low incidence of preeclampsia: a role for soluble HLA in seminal fluid? in J Reprod Immunol, vol. 46, nº 2, Mar 2000, pp. 155-66,
- Kramer MS, Kakuma R, Energy and protein intake in pregnancy in Cochrane Database of Systematic Reviews, nº 4, 2003, pp. CD000032, DOI:10.1002/14651858.CD000032, PMID 14583907.
- Rumbold AR, Crowther CA, Haslam RR, Dekker GA, Robinson JS, Vitamins C and E and the risks of preeclampsia and perinatal complications in The New England Journal of Medicine, vol. 354, nº 17, aprile 2006, pp. 1796–806, DOI:10.1056/NEJMoa054186, PMID 16641396.
- Padayatty SJ, Levine M, Vitamins C and E and the prevention of preeclampsia in The New England Journal of Medicine, vol. 355, nº 10, settembre 2006, pp. 1065; author reply 1066, DOI:10.1056/NEJMc061414, PMID 16957157.
- Bodnar LM, Catov JM, Simhan HN, Holick MF, Powers RW, Roberts JM, Maternal vitamin D deficiency increases the risk of preeclampsia in The Journal of Clinical Endocrinology and Metabolism, vol. 92, nº 9, settembre 2007, pp. 3517–22, DOI:10.1210/jc.2007-0718, PMID 17535985.
- Villar J, Abdel-Aleem H, Merialdi M, et al., World Health Organization randomized trial of calcium supplementation among low calcium intake pregnant women in American Journal of Obstetrics and Gynecology, vol. 194, nº 3, marzo 2006, pp. 639–49, DOI:10.1016/j.ajog.2006.01.068, PMID 16522392.
- Rayman MP, Bode P, Redman CW, Low selenium status is associated with the occurrence of the pregnancy disease preeclampsia in women from the United Kingdom in American Journal of Obstetrics and Gynecology, vol. 189, nº 5, novembre 2003, pp. 1343–9, DOI:10.1067/S0002-9378(03)00723-3, PMID 14634566.
- Vanderlelie J, Venardos K, Perkins AV, Selenium deficiency as a model of experimental pre-eclampsia in rats in Reproduction, vol. 128, nº 5, novembre 2004, pp. 635–41, DOI:10.1530/rep.1.00260, PMID 15509710.
- Rumiris D, Purwosunu Y, Wibowo N, Farina A, Sekizawa A, Lower rate of preeclampsia after antioxidant supplementation in pregnant women with low antioxidant status in Hypertension in Pregnancy, vol. 25, nº 3, 2006, pp. 241–53,
- Can an aspirin a day prevent a heart attack? U.S. Food and Drug Administration. http://www.fda.gov/ForConsumers/ConsumerUpdates/ucm390539.htm. Accessed Jan. 27, 2015.
- Hennekens CH. Benefits and risks of aspirin in secondary and primary prevention of cardiovascular disease. http://www.uptodate.com/home. Accessed Feb. 3, 2015.
- Aspirin and heart disease. American Heart Association. http://www.heart.org/HEARTORG/Conditions/HeartAttack/PreventionTreatmentofHeartAttack/Aspirin-and-Heart-Disease_UCM_321714_Article.jsp. Accessed Feb. 2, 2015.
- Sutcliff P, et al. Aspirin in primary prevention of cardiovascular disease and cancer: A systematic review of the balance of evidence from reviews of randomized trials. PLOS One. 2013;8:1.
- Halvorsen S, et al. Aspirin therapy in primary cardiovascular disease prevention. Journal of the American College of Cardiology. 2014;64:319.
- Aspirin for the prevention of cardiovascular disease. U.S. Preventive Services Task Force. http://www.uspreventiveservicestaskforce.org/uspstf/uspsasmi.htm. Accessed Feb. 3, 2015.
- Aspirin: Questions and answers. U.S. Food and Drug Administration. http://www.fda.gov/Drugs/ResourcesForYou/Consumers/QuestionsAnswers/ucm071879.htm. Accessed Feb. 2, 2015.
- Dietary Guidelines for Americans, 2010. U.S. Department of Health and Human Services. http://www.cnpp.usda.gov/DGAs2010-PolicyDocument.htm. Accessed. Accessed Feb. 3, 2015.
- Aspirin. Micromedex 2.0 Healthcare Series. http://www.micromedexsolutions.com. Accessed Feb. 3, 2015.
- Lopez-Jimenez F (expert opinion). Mayo Clinic, Rochester, Minn. Feb. 10, 2015.
- McCormick BB , Sydor A , Akbari A , Fergusson D , Doucette S , Knoll G: “The effect of pentoxifylline on proteinuria in diabetic kidney disease: a meta-analysis”. American journal of kidney diseases : the official journal of the National Kidney Foundation; 2008;52(3):454-63.
- Aminorroaya A, Janghorbani M, Rezvanian H, Aminian T, Gharavi M, Amini M. Comparison of the effect of pentoxifylline and captopril on proteinuria in patients with type 2 diabetes mellitus. Nephron. Clinical practice. 2005;99(3):c73-7.
- ACOG practice bulletin. Diagnosis and management of preeclampsia and eclampsia. Number 33, January 2002. ACOG Committee on Practice Bulletins-Obstetrics. Obstet Gynecol. 2002 Jan;99(l): 159-167
- Begum MR, Begum A, Quadir E. Loading dose versus standard regime of magnesiusulfate in thè management of eclampsia; a randomized trial, J Obstet Gynaecol 2002; 28: 154-9.
- Duley L et al. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database Syst Rev 2010;(12):CD000127
- Duley L. et al. Magnesium sulphate versus phenytoin for eclampsia. Cochrane Database Syst Rev 2010;(10):CD000128
- Duley L. et al. Magnesium sulfate versus lytic cocktail for eclampsia. Cochrane Database Syst Rev 2010;(9):CD002960
- Duley L,Wìllìams J, Henderson-Smart DJ. Plasma volume expansion for treatment women with pre-eclampsia, Cochrane Database SystRev 2000(2): CDOQ1805,
- The Magpie Trial Collaborative Group Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet 2002;359,9321:1877-1890.
- Magpie Trial Follow-Up Study Collaborative Group: “The Magpie Trial: a randomised trial comparing magnesium sulphate with placebo for pre-eclampsia. Outcome for children at 18 months”. BJOG. 2007 Mar 1; 114(3): 289–299.
- Baha M Sibai: “Magnesium sulfate prophylaxis in preeclampsia: lessons learned from recent trials”. American Journal of Obstetrics and Gynecology Volume 190, Issue 6, June 2004, Pages 1520–1526
- Beaufils M, Uzan S, Donsimoni R et al Prevention of preeclampsia by early antiplatelets therapy. Lancet 1985;1: 840
- Wallenburg HCS, Dekker GA, Makovitz JW et al. Low-dose aspirin prevents pregnancy-induced hypertension and preeclampsia in angiotensine-sensitive primigravidae. Lancet 1986; 1: 1
- BenigniA, Gregorini G, Frusca T et al. Effect of low-dose aspirin on fetal and maternal generation of tromboxane by platelets in women at risk for pregnancy-induced hypertension. N Engl J Med 1989; 321: 357
- CLASP: Collaborative Low-dose Aspirin Study in Pregnancy Collaborative Group: A randomized trial of low-dose aspirin for prevention and tretment of preeclampsia among 9364 pregnant women. Lancet 1994; 343: 619
- Italian Study of Aspirin in pregnancy. Low-dose aspirin in prevention and treatment of intrauterine growth retardation and pregnancy-induced hypertension. Lancet 1993; 8842: 396-399
- Knight M, Duley L et al. Antiplatelet agents for preventing and treating preeclampsia. The Cochrane Database of systematic reviews 2000;
- Coomarasamy A, Papaioannou S et al. Aspirin for the prevention of preeclampsia in women with abnormal uterine artery Doppler: a metanalysis. Obstet Gynecol 2001;98:861
- Goffinet F, Aboulker D et al. Screening with a uterine Doppler in low risk pregnant women followed by low dose aspirin in women with abnormal results: a multicenter randomised controlled trial. Br J Obstet Gynecol 2001;108:510-518
- Viinikka L, Hartikainen AL et al. Low dose aspirin in hypertensive pregnant women: effect on pregnancy outcome and psostacyclin-thromboxane balance in mother and newborn. Br J Obstet Gynaecol 1993;100:809-815
- Dumont A, et al. Effect of aspirin in pregnant women is dependent on increase of bleeding time Am J Obstet Gyn 1999; 180: 135-40
- Duley L. Magnesium sulphate versus phenytoin for eclampsia. Cochrane Database Syst Rev. 2003CD000128 [DOI: 10.1002/14651858.CD000128] [PubMed]
- Duley L. Magnesium sulphate versus lytic cocktail for eclampsia. Cochrane Database Syst Rev. 2000CD002960 [DOI: 10.1002/14651858.CD002960] [PubMed]
- Duley L. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database Syst Rev. 2003CD000127 [DOI: 10.1002/14651858.CD000127] [PubMed]
- Nelson KB. Magnesium sulfate and risk of cerebral palsy in very low-birth-weight infants. JAMA.1996;276:1843–4. [PubMed]
- Nelson KB. Can magnesium sulfate reduce the risk of cerebral palsy in very low birthweight infants?Pediatrics. 1995;95:263–9. [PubMed]
- Schendel DE. Prenatal magnesium sulfate exposure and the risk for cerebral palsy or mental retardation among very low-birth-weight children aged 3 to 5 years. JAMA. 1996;276:1805–10. [PubMed]
- Crowther C. for the Australasian Collaborative Trial of Magnesium Sulphate (ACTOMgSO4) Collaborative Group. Effect of magnesium sulfate given for neuroprotection before preterm birth. JAMA.2003;290:2669–76. [PubMed]
- Crowther CA. Magnesium sulphate for preventing preterm birth in threatened preterm labour. Cochrane Database Syst Rev. 2002 CD001060 [DOI: 10.1002/14651858.CD001060] [PubMed]
- Magpie Trial Follow Up Study Management Group. The Magpie Trial Follow Up Study: outcome after discharge from hospital for women and children recruited to a trial comparing magnesium sulphate with placebo for pre-eclampsia [ISRCTN86938761] BMC Pregnancy Childbirth. 2004. p. 5. [PMC free article][PubMed]
- Magpie Trial Follow Up Study Collaborative Group. The Magpie Trial: a randomised trial comparing magnesium sulphate with placebo for pre-eclampsia. Outcome for women at 2 years. BJOG. DOI: 10.1111/j.1471-0528.2006.01166.x. [PMC free article] [PubMed]
- Magpie Trial Follow-Up Study Collaborative Group The Magpie Trial: a randomised trial comparing magnesium sulphate with placebo for pre-eclampsia. Outcome for children at 18 months. BJOG. 2007 Mar 1; 114(3): 289–299.
- Atallah AN, Hofmeyr GJ, Duley L Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems The Cochrane Database of systematic reviews’ 2000
- Chappel LC, Seed PT,et al. Effects of antioxidants on the occurence of preeclampsia in women at increased risk: a randomised trial Lancet 1999; 354: 810-815
- Olsen SF, Secher NJ,Tabor A,et al Randomised clinical trials of fish oil supplementation in high risk pregnancies. Br J Ob Gyn 2000; 107: 382-95
- Cyberlipid. “Polyenoic Fatty Acids”. Retrieved 2007-01-17.
- Gunstone, Frank D. “Lipid Glossary 2″ (PDF). Archived from the original on 2006-08-13. Retrieved 2007-01-17.
- Adlof, R. O. and Gunstone, F. D. (2003-09-17). “Common (non-systematic) Names for Fatty Acids”. Archived from the original on 2006-12-06. Retrieved 2007-01-24.
- Heinz; Roughan, PG (1983). “Similarities and Differences in Lipid Metabolism of Chloroplasts Isolated from 18:3 and 16:3 Plants”. Plant Physiol 72 (2): 273–279. doi:10.1104/pp.72.2.273.
- Calder PC, Yaqoob P.: “Omega-3 polyunsaturated fatty acids and human health outcomes”. Biofactors. 2009 May-Jun;35(3):266-72. doi: 10.1002/biof.42.
- Gus Dekker, Baha Sibai Primary, secondary and tertiary prevention of pre-eclampsia The Lancet 2001; 357:209
- Chien PF, Arnott N, Gordon A et al How useful is uterineDoppelr flow velocimetry in the prediction f prreclampsia intrauterine growth retardation and perinatal death? An overview. Br. J Ob Gyn 2000;107: 196-208
- Papgeorghiou AT, Bindra R, Pandis G, Nicolaides KH Multicenter screening for preeclampsia and fetal growth restriction by transvaginal uterine artery Doppler at 23 weeks of gestation Ultras Ob Gyn 2001;18: 441
- Chien PF, Arnott N, Gordon A et al How useful is uterineDoppelr flow velocimetry in the prediction f prreclampsia intrauterine growth retardation and perinatal death? An overview. Br. J Ob Gyn 2000;107: 196-208
- Papgeorghiou AT, Bindra R, Pandis G, Nicolaides KH Multicenter screening for preeclampsia and fetal growth restriction by transvaginal uterine artery Doppler at 23 weeks of gestation Ultras Ob Gyn 2001;18: 441
- Recettore adrenergico in Tesauro del Nuovo soggettario, BNCF, marzo 2013.
- B. Clement, M. Demesmaeker, Formation of guanoxabenz from guanabenz in human liver. A new metabolic marker for CYP1A2. in Drug Metab Dispos, vol. 25, nº 11, novembre 1997, pp. 1266-71, PMID 9351903.
- ^ B. Clement, M. Demesmaeker; S. Linne, Microsomal catalyzed N-hydroxylation of guanabenz and reduction of the N-hydroxylated metabolite: characterization of the two reactions and genotoxic potential of guanoxabenz. in Chem Res Toxicol, vol. 9, nº 4, Giu 1996, pp. 682-8,
- B. Holmes, RN. Brogden; RC. Heel; TM. Speight; GS. Avery, Guanabenz. A review of its pharmacodynamic properties and therapeutic efficacy in hypertension. in Drugs, vol. 26, nº 3, Set 1983, pp. 212-29, PMID 6352237.
- ^ KC. Lasseter, D. Shapse; VL. Pascucci; ST. Chiang, Pharmacokinetics of guanabenz in patients with impaired liver function. in J Cardiovasc Pharmacol, 6 Suppl 5, 1984, pp. S766-70, PMID 6084122.
- ^ S. Nishio, S. Hayashi; H. Yoshihara, [Clinical and fundamental study of guanabenz in hypertensive patients with renal failure]. in Hinyokika Kiyo, vol. 34, nº 6, Giu 1988, pp. 1083-9, PMID 3223454.
- ^ RH. Meacham, ST. Chiang; CJ. Kick; SF. Sisenwine; WJ. Jusko; HW. Ruelius,Pharmacokinetic disposition of guanabenz in the rhesus monkey. in Drug Metab Dispos, vol. 9, nº 6, pp. 509-14, PMID 6120807.
- ^ P. Madeddu, N. Glorioso; P. Dessì-Fulgheri; A. Rappelli; E. Delle Gemme, [Effect of guanabenz alone and in association with a diuretic on blood pressure and on the renin-angiotensin-aldosterone system in hypertensive patients]. in Minerva Cardioangiol, vol. 32, nº 5, Mag 1984, pp. 281-4, PMID 6382055.
- BR. Walker, MW. Deitch; JA. Gold; BA. Levey, Evaluation of guanabenz added to hydrochlorothiazide therapy in hypertension. in J Int Med Res, vol. 10, nº 3, 1982, pp. 131-9, PMID 7047256.
- ^ AH. Hall, SC. Smolinske; KW. Kulig; BH. Rumack, Guanabenz overdose. in Ann Intern Med, vol. 102, nº 6, Giu 1985, pp. 787-8, PMID 3994191.
- ^ SJ. Rogers, Guanabenz overdose. in Ann Intern Med, vol. 104, nº 3, marzo 1986, p. 445, PMID 3946989.
- ^ J. Perrone, RS. Hoffman; B. Jones; JE. Hollander, Guanabenz induced hypothermia in a poisoned elderly female. in J Toxicol Clin Toxicol, vol. 32, nº 4, 1994, pp. 445-9,PMID 8057404.
- ^ K. Akatsuka, T. Hashimoto; K. Takeuchi; Y. Yanagisawa, [Reproduction study of Guanabenz, a new antihypertensive agent (2) – teratological test in rats]. in J Toxicol Sci, 7 Suppl 2, Dic 1982, pp. 107-21, PMID 7183767.
- ^ K. Akatsuka, T. Hashimoto; K. Takeuchi; M. Kogure, [Reproduction study of Guanabenz, a new antihypertensive agent (4) – teratological test in rabbits]. in J Toxicol Sci, 7 Suppl 2, Dic 1982, pp. 141-50, PMID 7183769.
- ^ K. Akatsuka, T. Hashimoto; K. Takeuchi, [Reproduction study of Guanabenz, a new antihypertensive agent (1) – fertility test in rats]. in J Toxicol Sci, 7 Suppl 2, Dic 1982, pp. 93-105, PMID 7183772.
- ^ Onyeka Otugo, Olabode Ogundare, Christopher Vaughan, Emmanuel Fadiran, Leyla Sahin, Consistency of Pregnancy Labeling Across Different Therapeutic Classes, Food and Drug Administration – Office of Women’s Health, 1979. URL consultato il 4 gennaio 2014.
- Parving HH, Persson F, Lewis JB, Lewis EJ, Hollenberg NK. “Aliskiren Combined with Losartan in Type 2 Diabetes and Nephropathy,” N Engl J Med 2008;358:2433-46.
- Ingelfinger JR, Aliskiren and dual therapy in type 2 diabetes mellitus, in N. Engl. J. Med., vol. 358, nº 23, giugno 2008, pp. 2503–5,
- PharmaXChange: Direct Renin Inhibitors as Antihypertensive Drugs
- PHARMASTAR: Approvata l’associazione Aliskiren più idroclorotiazide





3 commenti
I constantly emailed this web site post page to all my contacts, as if like to read
it after that my links will too.
Good post. I learn something new and challenging on sites I stumbleupon everyday.
It’s always helpful to read articles from other authors and practice something
from their sites.
hi!,I love your writing very a lot! share we communicate more about your article on AOL?
I need a specialist on this area to unravel my problem.
Maybe that’s you! Having a look forward to peer you.