Ultimo aggiornamento: 12.10.2023
ENDOCRINOLOGIA DELL’UNITA’ FETO-PLACENTARE:
Indice:
- HCG
- E3
- Progesterone
- ACTH
- HPL
- NPY
- Fattori di crescita
- Leptina
- Gn-RH
- TRH
- hCT
- CRF
- Vitamina D
- IGF-BP-1
- Glicodelina o proteina placentare 14 (PP14)
- Glicoproteina b1-placentare specifica per la gravidanza (SP1)
- PAPP-A
- Ossitocina
- Relaxina
- GH
- Placental Protein-5 (PP5)
L’unità feto-placentare è provvista di un’attività endocrina che per la sua straordinaria varietà non ha uguali con nessuna altra ghiandola endocrina. Detta attività è essenziale allo sviluppo e mantenimento della gravidanza. Infatti essa esercita effetti autocrini e paracrini tesi a permettere e favorire momenti essenziali della gravidanza come decidualizzazione, angiogenesi, annidamento, impianto e sviluppo embrionale e la modulazione della contrattilità uterina (1).
Gli ormoni placentari e altri mediatori chimici sono secreti principalmente dal sincizio-trofoblasto prima e dalla placenta poi; il fegato fetale è l’organo maggiormente coinvolto nel processo steroidogenetico.
Il sinciziotrofoblasto si origina dalla fusione dei trofoblasti embrionali più prossimi alla decidua uterina. Il sinciziotrofoblasto, detto anche chorion frondosum, invade la decidua e le arterie spirali per formare i villi coriali che poi evolvono in placenta (34-36). 
La placenta produce numerosi ormoni e sostanze che abitualmente riconoscono altre sedi di origine in condizione di non gravidanza: la placenta quindi assume funzioni molto simili all’ipotalamo, ipofisi, fegato, surrene, ovaio e corpo luteo.
Essendo gli ormoni feto-placentari riversati nel circolo materno, si è cercato di utilizzarne il dosaggio sierico materno come biomarkers per la valutazione del benessere feto-placentare (HCG, HPL, Estriolo, ß-inibina, α-attivina, PAPP-A).
Tuttavia lo studio della secrezione ormonale della placenta e la funzione dei diversi ormoni nei diversi eventi gestazionali rappresentano ancora oggetto di studio e conclusioni non completamente definite a causa di problematiche etiche che ovviamente limitano molto lo studio in vivo (37-39).
HCG: ormone glicoproteico strutturalmente simile all’LH con un’emivita più lunga rispetto al suo omologo ipofisario (36 vs. 24 ore). E’ costituito da 2 sub-unità non covalenti: α e β. La catena α è comune anche a LH e FSH mentre la sub-unità β è caratteristica e diversa per ognuno dei tre ormoni. La sub-unità β dell’HCG è modulata da un gene localizzato nel cromosoma 19 ed è utilizzata come test di gravidanza (40-42).
Secrezione HCG – L’mRNA di hCG è rilevabile negli embrioni già dallo stadio di 6-8 cellule. Dopo 8 giorni circa dalla fecondazione, il sinciziotrofoblasto inizia a produrre l’HCG in quantità crescenti; le concentrazioni sieriche raggiungono un picco massimo alla 10-11a w di gravidanza (100.000-150.000 mUI/ml). Tra 12 e 16 settimane, l’hCG medio diminuisce rapidamente con una concentrazione dimezzata ogni 2,5±1,0 giorni prima di raggiungere il 25% dei valori di picco del primo trimestre. La concentrazione sierica continua a scendere da 16 a 22 settimane a un ritmo più lento (tasso di dimezzamento medio di 4,0±2,0 giorni) per diventare circa il 10% dei valori di picco del primo trimestre (3.000-6.000 mUI/ml). Durante il terzo trimestre i livelli medi di hCG aumentano in modo graduale, ma significativo, da 22 settimane a termine. La secrezione ed il livello sierico di HCG, nl I° trimestre, è correlato direttamente alla massa dei tessuti trofoblastici che secernono hCG. Aumenta quindi con l‘epoca gestazionale e con il numero di feti e in caso di mola vescicolare e coriocarcinoma mentre diminuisce in caso di gravidanza extra-uterina, minaccia di aborto e aborto (43-45). L’HCG aumenta nelle cromosomopatie fetali sia aneuploidie che triploidie. La secrezione di hCG sembra essere correlata al rilascio di Gn-RH placentare.
L’HCG è metabolizzato principalmente a livello renale la cui clearance non varia durante tutta la gravidanza per cui la concentrazione sierica dell’ormone riflette l’entità della sintesi placentare.

- azione trofica e iperplastica sul miometrio
- azione trofica sui dotti mammari
- azione trofica sui genitali esterni
- sui legamenti pelvici e della sinfisi pubica trasformando il tessuto connettivo da compatto in lasso
- stimolano la formazione dei recettori per l’ossitocina
- stimolano la secrezione placentare di progesterone
- Inducono ipercortisolemia aumentando la produzione delle Binding Proteins del cortisolo (CBG).
—————————————————————————————-
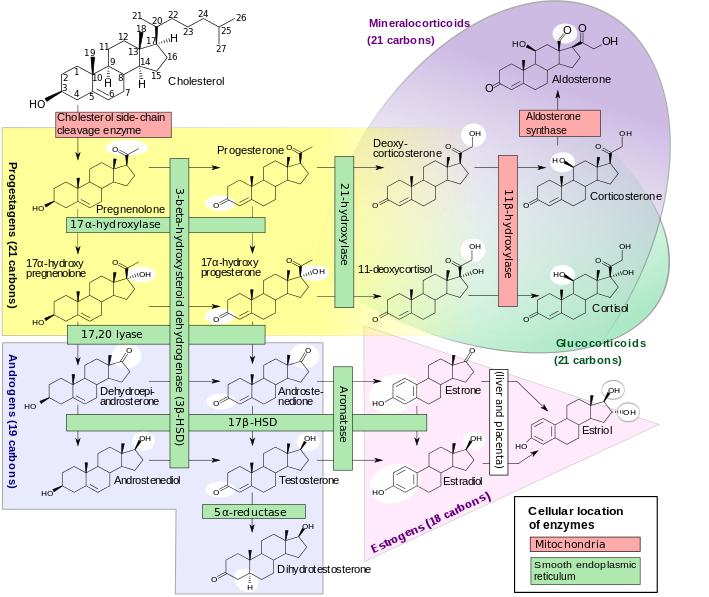
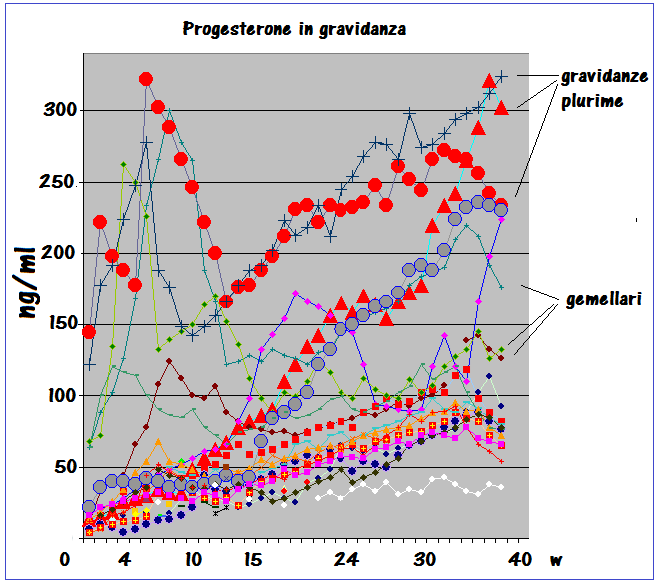
PROGESTERONE: principale ormone steroideo della gravidanza, secreto dal corpo luteo prima e dalla placenta dalla 10a settimana di gestazione quando la placenta ne diventa la maggiore fonte di produzione. La concentrazione plasmatica del progesterone in gravidanza presenta una curva di crescita qualitativamente simile a quella presente nel ciclo mestruale con un picco alla 10a settimana seguito da una modesta deflessione ed un secondo picco alla 34a settimana. La P450c17 non è espressa nella placenta umana e dunque il progesterone non può essere convertito a androgeni nella placenta (16-18).
Anche a livello placentare, come nell’ovaio e corpo luteo, il progesterone è sintetizzato a partire dal colesterolo che viene metabolizzato in OH-colesterolo che ad opera della desmolasi è convertito in pregnenolone nei mitocondri. Il pregnenolone è convertito in progesterone grazie all’azione degli enzimi 3-beta-idrossisteroidodeidrogenasi (3-β-HSD) e isomerasi nelle piccole cellule luteiniche e nelle cellule placentari. Tutto il procedimento è modulato dall’azione di LH e HCG.
Le funzioni principali del progesterone sono:
- stimolare la secrezione ghiandolare uterina e tubarica
- cambiare il pattern delle proteine secrete
- indurre la differenziazione stromale dell’endometrio
-
Facilitare l’impianto stimolando la sintesi di enzimi responsabili della lisi della zona pellucida e la secrezione endometriale di CRF e Attivina A
-
Indurre la proliferazione e differenziazione cellulare del prodotto gravidico nelle prime fasi di gravidanza attraverso la regolazione della sintesi dei fattori di crescita locali, l’espressione dei loro recettori specifici, la sensibilità cellulare agli effetti dei fattori di crescita
- evitare le contrazioni uterine inibendo la sintesi della prostaglandina PGF2alfa e aumentando la sintesi della prostaglandin-15-deidrogenasi in opposizione all’estradiolo; interferendo sulla capacità dell’estradiolo di indurre l’espressione di membrana di recettoriα-adrenergici; aumentando il potenziale di riposo delle cellule miometriali, prevenendo il coupling elettrico fra le cellule miometriali, inibendo l’uptake del calcio extra-cellulare e downregolando l’espressione di geni che codificano per le subunità dei canali del calcio voltaggio-dipendenti. Inoltre il progesterone inibisce l’azione dell’ossitocina.
- stimolare lo sviluppo degli alveoli mammari
- stimolare lo sviluppo delle sacche alveolari
- inibire la risposta immunitaria attraverso l’attivazione del Corticotropin-Releasing Factor (CRF)
- il progesterone è il principale substrato per la sintesi di cortisolo e aldosterone da parte del surrene fetale
- Inibisce la sintesi dei recettori per gli estrogeni .
L’ACTH placentare è strutturalmente simile all’ACTH ipofisario. Sotto l’influenza paracrina del CRH placentare rilasciato dai citotrofoblasti giustapposti, l’ACTH placentare viene secreto dai sincitiocitotropofoblasti nella circolazione materna. L’ACTH materno circolante è aumentato al di sopra dei livelli di non gravidanza, ma rimane ancora nell’intervallo normale.
L’ACTH placentare stimola un aumento del cortisolo libero materno in circolazione resistente alla soppressione del desametasone. Pertanto, l’ipercortisolismo relativo in gravidanza si verifica nonostante concentrazioni di ACTH normali. Questa situazione è possibile a causa di due principali differenze nelle relazioni endocrine durante la gravidanza. Innanzitutto, la risposta materna al CRH esogeno è ridotta. In secondo luogo, esiste una relazione paradossale tra CRH placentare, ACTH e il loro prodotto di organo finale, il cortisolo; i glucocorticoidi aumentano la secrezione di CRH e ACTH placentare, non la sopprimono. Questo meccanismo di feedback positivo consente un aumento della secrezione di glucocorticoidi in periodi di stress in eccesso rispetto alla quantità necessaria se la madre non era incinta.
Poiché l’hPL è secreto principalmente nella circolazione materna, la maggior parte delle sue funzioni si verificano nei siti di azione nei tessuti materni. Si ritiene che il lattogeno placentare umano sia responsabile del marcato aumento delle concentrazioni di fattore 1 di crescita insulino-simile del plasma materno (IGF-1) mentre la gravidanza si avvicina al termine. Il lattogeno placentare umano esercita effetti metabolici durante la gravidanza, attraverso il fattore di crescita Insukino-simile I (IGF-I). È associato all‘insulino-resistenza, migliora la secrezione di insulina che stimola la lipolisi, aumenta la circolazione degli acidi grassi liberi e inibisce la gluconeogenesi; in effetti, antagonizza l’azione dell’insulina, induce intolleranza al glucosio, nonché lipolisi e proteolisi nel sistema materno. In risposta al digiuno e al carico di glucosio, i livelli di hPL aumentano e diminuiscono. Questi effetti metabolici favoriscono il trasporto di glucosio, aminoacidi e acidi grassi nel feto nel tentativo di fornire nutrimento.
La gravidanza è associata a profonde alterazioni del metabolismo materno. La relazione fetale-materna favorisce l’uso del glucosio da parte del feto e costringe i tessuti materni ad aumentare il loro uso di fonti energetiche alternative. Il segno distintivo endocrino di questo ambiente ormonale è l’insulino-resistenza. Si ritiene che diversi ormoni prevalenti durante la gravidanza siano responsabili di questo ambiente alterato: estrogeni, progesterone, glucocorticoidi, lattogeno placentare umano (hPL) e somatomammotropina corionica umana (hCS).
I livelli circolanti di glucosio e aminoacidi sono ridotti, mentre sono aumentati i livelli di acidi grassi liberi, chetoni e trigliceridi. La secrezione di insulina viene aumentata in risposta a un carico di glucosio. I fabbisogni di carburante del feto in via di sviluppo sono soddisfatti principalmente dal glucosio. Fornisce l’energia necessaria per la sintesi proteica e funge da precursore per la sintesi dei grassi e la formazione di glicogeno. I livelli fetali di glucosio nel sangue sono generalmente inferiori di 10-20 mg / 100 ml a quelli della circolazione materna; quindi, la diffusione e il trasporto facilitato favoriscono il movimento netto del glucosio dalla madre al feto.
***********************************************************
- L’inibina è un eterodimero glicoproteico costituito da una subunità α e una sbunità β ci cui esistono due sottotipi (A e B) per cui esiste l’inibina α (α-βA) e l’inibina β (α-βB). Le inibine sono prodotte quasi esclusivamente dall’ovaio e, in gravidanza, da decidua, corpo luteo e placenta. Inibiscono la secrezione ipotalamica di di Gn-RH, la secrezione ipofisaria di FSH e LH e la secrezione del progesterone. La inibina beta deprime la secrezione di HCG da parte del sinciziotrofoblasto (20-22).
- Attivina: è secreta da organi extra-gonadali ed, in gravidanza, da decidua e placenta da cui viene riversata in circolo e nel liquido amniotico. L’attivina modula positivamente la secrezione di GH-RH, FSH, la differenziazione eritrocitaria, la secrezione di HPL e la steroidogenesi placentare (22). L’inibina inibisce la secrezione di GH-RH, FSH e anche Gn-RH.
- Insulin-Like Growth Factors (IGFs) o Somatomedine: peptidi con peso molecolare, struttura ed effetti metabolici simili all’insulina, inizialmente conosciuti esclusivamente come mediatori dell’azione dell’ormone della crescita (GH o Somatotropina) che ne stimola la sintesi a livello epatico, ovarico e placentare. In circolo gli IGFs viaggiano legati alle IGF-BP (IGF-binding proteins) che ne aumentano l’emivita plasmatica (da 10 minuti a 3-4 ore).
Al contrario del GH, l’IGF-I diminuisce l’insulino-resistenza e quindi contrasta l’insorgenza del diabete tipo II e facilita l’assorbimento dei glicidi sia nel compartimento materno che soprattutto in quello fetale. Sono dotati inoltre di azione anabolizzante (stimolando la proteosintesi tissutale) e perciò coinvolti nella crescita del feto e del bambino (40,,53-55) e continuano ad esercitare la loro azione metabolica nell’adulto. L’IGF-I stimola le connessioni neuronali, inibisce la morte dei neuroni e in generale produce grandi benefici ai malati di malattie neurodegenerative compresa la SLA oltre che nella terapia dell’osteoporosi ., distrofia muscolare e nanismo.
I due sottotipi più noti sono l’IGF-I (o Somatomedina C) e IGF-II (o Somatomedina C) secreti dalla placenta insieme alle IGF-BP fin dalla nona settimana di gestazione. Alla secrezione di IGF-BP contribuisce anche la decidua e l’IGF-BP aumenta fino alla 12a w per rimanere poi elevata fino a termine di gravidanza probabilmente per difendere l’endometrio da un’eccessiva invasione trofoblastica. Però l’eccessiva produzione di IGF-BP è stata identificata come principale fattore etiologico del mancato impianto embrionale e della sindrome gestosica ipertensiva. La produzione locale di IGFs è molto importante perché molti effetti di questo ormone ricadono direttamente sulle cellule vicine (meccanismo paracrino). Infatti gli IGFs svolgono da subito la loro azione facilitando l’impianto e l’invasione trofoblastica, la crescita dei villi coriali e la vasodilatazione distrettuale. IGFs, HG e HPL sono i principali fattori responsabili della crescita fetale.
- EGF (Epidermal Growth Factor), FGF (Fibroblast Growth Factor), NGF (Nerve Growth Factor) e il TGF (Transforming Growth Factor) sono altri fattori di crescita poco studiati ma inevitabilmente implicati nei fenomeni di crescita e proliferazione che caratterizzano la gravidanza.
***********************************************************
- Leptina: peptide prodotto dal tessuto adiposo bianco, esprime una modulazione negativa sul centro della fame in opposizione al NPY . E’ prodotto anche dalla placenta in concentrazioni correlate all’età gestazionale e al peso fetale e che risultano eccessivamente elevate in caso di pre-eclampsia (63,64). In gravidanza, come nella donna non gravida, esercita un’azione favorente la neoangiogenesi, la secrezione di FSH, TSH e GH. Gli estrogeni e il sovrappeso favoriscono la ipersecrezione della leptina . La placenta e la decidua sono provvisti di recettori specifici per la leptina (24,25)
Gn-RH: neuropeptide placentare simile a quello ipotalamico. La sua secrezione aumenta parallelamente a quella dell’HCG. Il Gn-RH stimola la sintesi e la secrezione di HCG dal sinciziotrofoblasto nel 1° trimestre di gravidanza (4,5).
Thyrotropin Releasing Hormone (TRH): prodotto dal sinciziotrofoblasto prima e dalla placenta poi durante tutta la gravidanza ed è riversato nel sangue materno ma soprattutto nel sangue fetale ed è capace di stimolare una minima quantità di TSH dall’ipofisi fetale (6,7).
Tirotropina corionica umana placentare (hCT)
La tireotropina corionica umana è strutturalmente simile al TSH ipofisario, ma non possiede la subunità comune. Il contenuto placentare di hCT è molto piccolo. Inoltre, poiché l’hCG ha anche un’attività tireotropica, si pensa che eserciti un effetto più significativo sulla tiroide materna rispetto all’hCT.
Avendo caratteristiche strutturali simili al TSH, l’HCG stimola la funzione tiroidea materna proponendosi come principale responsabile dell’ipertiroidismo materno nel I° trimestre (10-12).
Corticotropin Releasing Factor (CRF): neuropeptide simili a quello ipotalmico coinvolto nelle risposte dell’organismo allo stress, in grado di stimolare la secezione dell’adrenocorticotropin-releasing hormone (ACTH) ipofisario il quale a sua volta stimola la secrezione di cortisolo dal surrene. La placenta, la decidua e il miometrio sono in grado di sintetizzare il CRF con meccanismo sovrapponibile a quello ipotalamico. Il CRF placentare stimola le contrazioni uterine direttamente tramite i suoi recettori miometriali sia indirettamente tramite le prostaglandine, e l’ossitocina. Inoltre il CRF è in grado di indurre vasodilatazione del circolo utero-placentare tramite il pathwaydel monossido di azoto.In circolo è legato alla CRF-BP; in caso di eclampsia si riscontra una ridotta concemntrazione della CRF-BP (8,9).
Glicodelina o proteina placentare 14 (PP14) o progesterone-associated endometrial protein (PEP) o β uterin protein: è una proteina, omologa della β-lattoglobulina, è sintetizzata e secreta dalle ghiandole endometriali nella fase luteale tardiva sotto l’azione di stimolo del progesterone. La concentrazione di PP14 misurata sul liquido di secrezione endometriale al giorno LH + 10 o LH + 12 o nel sangue mestruale di un ciclo spontaneo erano significativamente più basse (P < 0.05) nelle pazienti con aborto ricorrente (media: 1000, range: 9-2900 ng/ml) che nelle donne che portano a termine la gravidanza (media: 1440, range: 4-12 100 ng/ml) durante una successiva gravidanza, ma non nel plasma. La concentrazione di glicodelina è inferiore alla norma nel plasma seminale di pazienti infertili (26-29).
Glicoproteina b1-placentare specifica per la gravidanza (SP1)
La glicoproteina b1 specifica per la gravidanza è un ormone glicoproteico che può essere rilevato circa 6-8 giorni dopo la fecondazione. È secreto dalle cellule del trofoblasto. Inizialmente, mostra un tempo di raddoppio da 2 a 3 giorni, raggiungendo le concentrazioni di picco tra 100-200 ng / mL a termine. La glicoproteina1 specifica per la gravidanza ha effetti immunosoppressori sulla proliferazione dei linfociti T e si pensa che sia coinvolta nella prevenzione del rigetto del concetto di impianto.
Proteina-A plasmatica associata alla gravidanza (PAPP-A)
La proteina A plasmatica associata alla gravidanza è la più grande delle glicoproteine legate alla gravidanza. Ha origine principalmente da sincitiocitotrofoblasti della placenta. La proteina A plasmatica associata alla gravidanza può essere rilevata per la prima volta circa 20 giorni dopo la fecondazione. Con un tempo di raddoppio di 3 giorni, i suoi livelli inizialmente aumentano rapidamente, quindi continuano a salire più lentamente fino al termine. Come SP-1 e hCG, si ritiene che PAPP-A svolga un ruolo immunosoppressivo in gravidanza. Recentemente ha guadagnato il favore come marker clinicamente utile del primo trimestre di screening della sindrome di Down (trisomia 21).
Ossitocina (OT): sintetizzata dalla neuroipofisi, è ulteriormente sintetizzata da decidua, miometrio e placenta in gravidanza (68-70). Le concentrazioni plasmatiche si mantengono costanti in gravidanza e aumentano solo in travaglio avanzato di parto.
Relaxina: proteina prodotta dal corpo luteo gravidico, placenta e decidua con incremento fino alla 12a settimana di gravidanza e costante diminuzione da tale epoca. Agisce sul collagene della cervice uterina e dei ligamenti pubici facilitandone la dilatazione.
Per la stabilizzazione dell’annidamento occorre il processo di scissione delle matrici  extra-cellulari. A tale scopo i trofoblasti secernono 22 tipi di enzimi specializzati. le Matrix Metallo-Proteinase (MMP), presenti sia sulle cellule endometriali che nell’embrione. Esse scindono le matrici extra-cellulari (ECM) della decidua permettendo la penetrazione del sinciziotrofoblasto e quindi l’impianto dell’embrione. Oltre ai substrati della matrice extracellulare (ECM), le metalloproteinasi degradano anche alcune molecole cellulari di superficie ed altre proteine pericellulari. La loro attività proteolitica è controllata dagli inibitori endogeni (α-macroglobulina) e dagli inibitori tissutali delle metalloproteinasi (Tissue Inhibitors Metalloproteinases – TIMPs) (91). Le principali classi di MMP sono le Collagenasi, le gelatinasi e le Stromelisine. Le metalloproteinasi-2 e -9 (dette anche gelatinasi 2 e 9) dirigono la proteolisi peri-cellulare e inoltre stimolano l’angiogenesi: favorendo la migrazione delle cellule endoteliali e la formazione della struttura dei capillari grazie al rilascio di fattori di crescita angiogenici dalla matrice extracellulare. Inoltre sono provviste di azione opposta inibente la neoangiogenesi mediante fattori inibitori in un complesso gioco di equilibrio fondamentale nello sviluppo placentare come nello sviluppo dei processi neoplastici che includono molteplici pathways (31-33).
extra-cellulari. A tale scopo i trofoblasti secernono 22 tipi di enzimi specializzati. le Matrix Metallo-Proteinase (MMP), presenti sia sulle cellule endometriali che nell’embrione. Esse scindono le matrici extra-cellulari (ECM) della decidua permettendo la penetrazione del sinciziotrofoblasto e quindi l’impianto dell’embrione. Oltre ai substrati della matrice extracellulare (ECM), le metalloproteinasi degradano anche alcune molecole cellulari di superficie ed altre proteine pericellulari. La loro attività proteolitica è controllata dagli inibitori endogeni (α-macroglobulina) e dagli inibitori tissutali delle metalloproteinasi (Tissue Inhibitors Metalloproteinases – TIMPs) (91). Le principali classi di MMP sono le Collagenasi, le gelatinasi e le Stromelisine. Le metalloproteinasi-2 e -9 (dette anche gelatinasi 2 e 9) dirigono la proteolisi peri-cellulare e inoltre stimolano l’angiogenesi: favorendo la migrazione delle cellule endoteliali e la formazione della struttura dei capillari grazie al rilascio di fattori di crescita angiogenici dalla matrice extracellulare. Inoltre sono provviste di azione opposta inibente la neoangiogenesi mediante fattori inibitori in un complesso gioco di equilibrio fondamentale nello sviluppo placentare come nello sviluppo dei processi neoplastici che includono molteplici pathways (31-33).
Ormone della crescita (GH) placentare – L’ormone della crescita è un ormone peptidico a catena singola strutturalmente correlato alla prolattina e alla somatomammotropina corionica umana (hCS). Fino alle prime 15-20 settimane di gravidanza, l’ormone della crescita ipofisario (GH) è la forma principale presente nella circolazione materna. Da 15-20 settimane a termine, il GH placentare sostituisce gradualmente il GH ipofisario, che alla fine diventa non rilevabile. Contrariamente alla secrezione del GH ipofisario che è di tipo pulsatile, il profilo giornaliero del rilascio di GH placentare non è pulsatile. Il sincitiocitotrofoblasto è il sito di produzione di GH placentare. Questo strato cellulare è il sito placentare del principale trasportatore di glucosio, Glut1, e risponde alle rapide variazioni dei livelli di glucosio nel sangue materno modificando la secrezione di GH placentare.
È noto che il tasso di secrezione di GH ipofisaria cambia rapidamente, a seconda del risultato netto di molteplici input stimolatori e inibitori. La regolazione del GH placentare è piuttosto diversa. Il tasso di sintesi di GH placentare, e quindi i livelli circolanti materni, aumenta con la crescita della placenta.
Placental Protein-5 (PP5)
Questa glicoproteina è prodotta dai sincitiocitotrofofoblasti. Viene rilevato a partire da 30 giorni dopo la fecondazione e aumenta costantemente fino al termine di gravidanza. La proteina 5 placentare ha attività anti-trombina e anti-plasmina e si ritiene che sia un inibitore naturale della coagulazione del sangue nel sito di impianto.
Any recommendations or hints? Cheers! dottvolpicelli
References:
- Sanderson JT. Placental and fetal steroidogenesis. Methods Mol Biol. 2009;550:127-36.
- Pepe GJ, Albrecht ED. Actions of placental and fetal adrenal steroid hormones in primate pregnancy. Endocr Rev. 1995 Oct; 16(5):608-48.
- Challi JRG, Matthews SG, Gibb W, Lye SJ: “Endocrine and paracrine regulation of birth at term and preterm”. Endocrin Rev 2000;21:514-550
- Mathialagan N , Rao AJ: (1986) Gonadotropin-releasing hormone (GnRH) stimulates both secretion and synthesis of human chorionic gonadotropin (hCG) by first trimester human placental minces in vitro Biochemistry International, 13 (5). pp. 757-765. ISSN 0158-5231
- T. M. SILER-KHODR and G. S. KHODR: Dose Response Analysis of GnRH Stimulation of hCG Release from Human Term Placenta Biol of Reprod 1981 vol. 25; 2: 353-358
- Thyrotropin-Releasing Hormone Activity in the Human Placenta J Clin Endocrinol Metab 48:483, 1979
- John E. Morley: “Extrahypothalamic Thyrotropin Releasing Hormone (TRH) — Its distribution and its functions”. Life Sciences Volume 25, Issue 18, 29 October 1979, Pages 1539–1550
- F. PETRAGLIA, P. E. SAWCHENKO, J. RIVIER & W. VALE: “Evidence for local stimulation of ACTH secretion by corticotropin-releasing factor in human placenta”. Nature 328, 717 – 719 (20 August 1987)
- Outi Saijonmaa, T. Laatikainen, T. Wahlström: “Corticotrophin-releasing factor in human placenta: Localization, concentration and release in vitro”. Placenta Volume 9, Issue 4, July–August 1988, Pages 373–385
- G Kovalevskaya et al: “Trophoblast origin of hCG isoforms: cytotrophoblasts are the primary source of choriocarcinoma-like hCG”. Molecular and Cellular Endocrinology Volume 194, Issues 1–2, 30 August 2002, Pages 147–155
- THIEDE, HENRY A. M.D., F.A.C.O.G.; CHOATE, JOHN W. M.D.Chorionic Gonadotropin Localization in the Human Placenta by Immunofluorescent Staining II. Demonstration of HCG in the Trophoblast and Amnion Epithelium of Immature and Mature Placentas. Obstetrics & Gynecology:October 1963 – Volume 22 – Issue 4 – ppg 433-443
- D W Morrish, H Marusyk, O Siy: “Demonstration of specific secretory granules for human chorionic gonadotropin in placenta. J Histochem Cytochem January 1987vol. 35 no. 1 93-101
- J F Strauss, F Martinez and M Kiriakidou: Placental steroid hormone synthesis: unique features and unanswered questions. Biology of ReproductionFebruary 1, 1996 vol. 54no. 2 303-311
- Charles E. Wood: “Estrogen/Hypothalamus-Pituitary-Adrenal Axis Interactions in the Fetus: the Interplay Between Placenta and Fetal Brain”. Reproductive Sciences February 2005vol. 12 no. 2 67-76
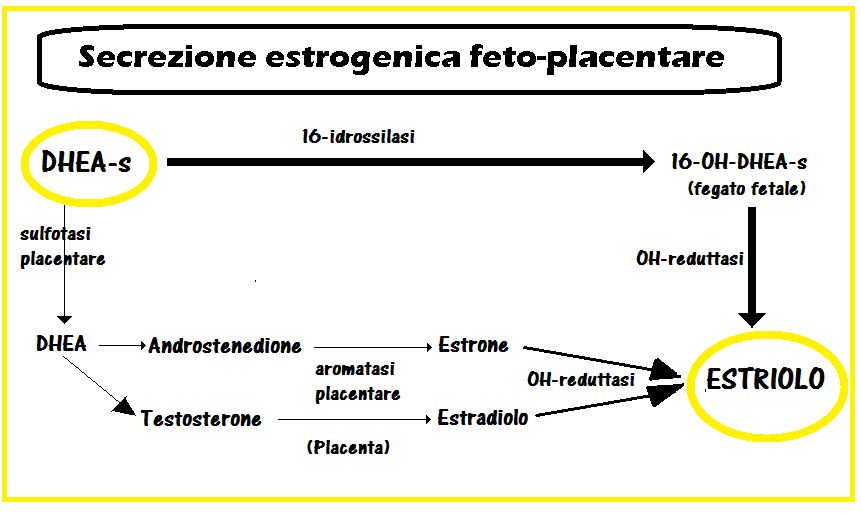
- DA Klausner, KJ Rya: “Estriol Secretion by the Human Term Placenta”. The Journal of Clinical Endocrinology & Metabolism, Volume 24, Issue 1
- PAUL A. KELLY, HAMISH A. ROBERTSON & HENRY G. FRIESEN Temporal pattern of placental lactogen and progesterone secretion in sheep Nature 248, 435 – 437 (29 March 1974);
- Verstegen JP, Onclin K, Silva LD, Wouters-Ballman P, Delahaut P, Ectors F Regulation of progesterone during pregnancy in the cat: studies on the roles of corpora lutea, placenta and prolactin secretion. Journal of Reproduction and Fertility. Supplement [1993, 47:165-173]
- David Barreraet al: Estradiol and progesterone synthesis in human placenta is stimulated by calcitriol The Journal of Steroid Biochemistry and Molecular Biology 2007;103;3-5:529-532
- Reis FM, Florio P, Cobellis L, et al: “Human placenta as a source of of neuroendocrine factors”. Biol Neonate 2001;79:150-156
- Sawetawan C, Carr BR, McGee E, Bird IM, Hong TL, Rainey WE. Inhibin and activin differentially regulate androgen production and 17 alpha-hydroxylase expression in human ovarian thecal-like tumor cells. J Endocrinol. 1996 Feb; 148(2):213-21.
- Giancotti FG, et al. (1999) Integrin signaling. Science. 285(5430): 1028-32.
- Schlaepfer DD, et al. (1994) Integrin-mediated signal transduction linked to Ras pathway by GRB2 binding to focal adhesion kinase. Nature. 372(6508): 786-91.
- Schlaepfer DD, et al. (1998) Integrin signalling and tyrosine phosphorylation: just the FAKs? Trends Cell Biol. 8(4): 151-7.
- Hiroaki Masuzak et al: “Nonadipose tissue production of leptin: Leptin as a novel placenta-derived hormone in humans”. Nature Medicine 3, 1029 – 1033 (1997)
- E. Sivan, et al: “Leptin in human pregnancy: The relationship with gestational hormones”. American Journal of Obstetrics and Gynecology Volume 179, Issue 5, November 1998, Pages 1128–1132
- Seppala M., Suikkari AM, Julkunen M: “Human endometrial proteins”. Reprod Nutr Devel 1998;6B:1649-1654.
- Dalton CF1, Laird SM, Estdale SE, Saravelos HG, Li TC. : “Endometrial protein PP14 and CA-125 in recurrent miscarriage patients; correlation with pregnancy outcome”. Hum Reprod. 1998 Nov;13(11):3197-202.
- Dalton CF, Laird SM, Serle E, Saravelos H, Warren MA, Li TC, Bolton AE. The measurement of CA 125 and placental protein 14 in uterine flushings in women with recurrent miscarriage; relation to endometrial morphology. Hum Reprod. 1995 Oct; 10(10):2680-4.
- Mackenna A, Li TC, Dalton C, Bolton A, Cooke I. Placental protein 14 levels in uterine flushing and plasma of women with unexplained infertility.Fertil Steril. 1993 Mar; 59(3):577-82.Endometrial factors in recurrent miscarriage.
- Li TC, Tuckerman EM, Laird SM. Endometrial factors in recurrent miscarriage.Hum Reprod Update. 2002 Jan-Feb; 8(1):43-52.
- Di Carlo A. The role of matrix-metalloproteinase-2 (MMP-2) and matrix-metalloproteinase-9 (MMP-9) in angiogenesis. The inducer and inhibitor role of gelatinase A (MMP-2) and gelatinase B (MMP-9) in the formation of new blood vessels. Prevent Res, published on line 18. Oct. 2012, P&R Public. 34. Available from: http://www.preventionandresearch.com/.
- Nagase H., Woessner J.F.Jr. “Matrix metalloproteinases”. The Journal of biological chemistry, 274 (31), 21491-21494, 1999.
- Sternlicht M.D., Werb Z. “How matrix metalloproteinases regulate cell behavior”. Annual Review of Cell and Developmental Biology, 17, 463-516, 2001.
- Huppertz, B., Weiss, G., Moser, G., 2014. Trophoblast invasion and oxygenation of the placenta: measurements versus presumptions. J. Reprod. Immunol. 101-102, 74–79.
- Lunghi, L., Ferretti, M.E., Medici, S., Biondi, C., Vesce, F., 2007. Control of human trophoblast function. Reprod. Biol. Endocrinol. 5,6
- Ji, L., Brkic, J., Liu, M., Fu, G., Peng, C., Wang, Y.L., 2013. Placental trophoblast cell differentiation: physiological regulation and pathological relevance to preeclampsia. Mol. Aspects Med. 34,981–1023
- Orendi, K., Kivity, V., Sammar, M., Grimpel, Y., Gonen, R., Meiri, H., Lubzens, E., Huppertz, B., 2011. Placental and trophoblastic in vitro models to study preventive and therapeutic agents for preeclampsia. Placenta 32 (Suppl.), S49–S54.
- Carter, A.M., 2007. Animal models of human placentation–a review. Placenta 28 (Suppl. A), S41–
- Malassine, A., Frendo, J.L., Evain-Brion, D., 2003. A comparison of
placental development and endocrine functions between the human and mouse model. Hum. Reprod. Update 9, 531–539. - Policastro, P.F., Daniels-McQueen, S., Carle, G., Boime, I., 1986. A map of the hCG beta-LH beta gene cluster. J. Biol. Chem. 261,5907–5916.
- Cole, L.A., 1997. Immunoassay of human chorionic gonadotropin, its free subunits, and metabolites. Clin. Chem. 43, 2233–2243.
- Cole, L.A., 2012. hCG, the wonder of today’s science. Reprod. Biol. Endocrinol. 10, 24.
- Handschuh, K., Guibourdenche, J., Tsatsaris, V., Guesnon, M., Laurendeau, I., Evain-Brion, D., Fournier, T., 2007. Human chorionic gonadotropin expression in human trophoblasts from early placenta: comparative study between villous and extravillous trophoblastic cells. Placenta 28, 175–184.
- Bonduelle, M.L., Dodd, R., Liebaers, I., Van Steirteghem, A., Williamson, R., Akhurst, R., 1988. Chorionic gonadotrophin-beta mRNA, a trophoblast marker, is expressed in human 8-cell embryos derived
from tripronucleate zygotes. Hum. Reprod. 3, 909–914. - Handschuh, K., Guibourdenche, J., Cocquebert, M., Tsatsaris, V., Vidaud, M., Evain-Brion, D., Fournier, T., 2009. Expression and regulation by PPARgamma of hCG alpha- and beta-subunits: comparison between villous and invasive extravillous trophoblastic cells.
Placenta 30, 1016–1022 - Choi, J., Smitz, J., 2014. Luteinizing hormone and human chorionic gonadotropin: origins of difference. Mol. Cell. Endocrinol. 383,
203–213 - Pidoux, G., Gerbaud, P., Tsatsaris, V., Marpeau, O., Ferreira, F., Meduri, G., Guibourdenche, J., Badet, J., Evain-Brion, D., Frendo, J.L., 2007. Biochemical characterization and modulation of LH/CG-receptor during human trophoblast differentiation. J. Cell. Physiol. 212, 26–35.
- Garner, P.R., Armstrong, D.T., 1977. The effect of human chorionic gonadotropin and estradiol-17beta on the maintenance of the human corpus luteum of early pregnancy. Am. J. Obstet. Gynecol.
128, 469–475 - Toth, P., Li, X., Rao, C.V., Lincoln, S.R., Sanfilippo, J.S., Spinnato, J.A., 2nd, Yussman, M.A., 1994. Expression of functional human chorionic gonadotropin/human luteinizing hormone receptor gene in human uterine arteries. J. Clin. Endocrinol. Metab. 79, 307–315.
- Zygmunt, M., Herr, F., Keller-Schoenwetter, S., Kunzi-Rapp, K., Munstedt, K., Rao, C.V., Lang, U., Preissner, K.T., 2002. Characterization of human chorionic gonadotropin as a novel angiogenic factor. J. Clin. Endocrinol. Metab. 87, 5290–5296.
- Islami, D., Bischof, P., Chardonnens, D., 2003. Modulation of placental vascular endothelial growth factor by leptin and hCG. Mol. Hum. Reprod. 9, 395–398.
- Berndt, S., Perrier d’Hauterive, S., Blacher, S., Pequeux, C., Lorquet, S., Munaut, C., Applanat, M., Herve, M.A., Lamande, N., Corvol, P., van den Brule, F., Frankenne, F., Poutanen, M., Huhtaniemi, I., Geenen, V., Noel, A., Foidart, J.M., 2006. Angiogenic activity of human chorionic gonadotropin through LH receptor activation on endothelial and epithelial cells of the endometrium. FASEB J. 20, 2630–2632
- Polec, A., Fedorcsak, P., Eskild, A., Tanbo, T.G., 2014. The interplay of human chorionic gonadotropin (hCG) with basic fibroblast growth factor and adipokines on angiogenesis in vitro. Placenta 35, 249–253.
- Schumacher, A., Brachwitz, N., Sohr, S., Engeland, K., Langwisch, S., Dolaptchieva, M., Alexander, T., Taran, A., Malfertheiner, S.F., Costa, S.D., Zimmermann, G., Nitschke, C., Volk, H.D., Alexander, H., Gunzer, M., Zenclussen, A.C., 2009. Human chorionic gonadotropin attracts regulatory T cells into the fetalmaternal interface during early human pregnancy. J. Immunol. 182, 5488–5497
- Kane, N., Kelly, R., Saunders, P.T., Critchley, H.O., 2009. Proliferation of uterine natural killer cells is induced by human chorionic gonadotropin and mediated via the mannose receptor. Endocrinology 150, 2882–2888.
- Koldehoff, M., Katzorke, T., Wisbrun, N.C., Propping, D., Wohlers, S., Bielfeld, P., Steckel, N.K., Beelen, D.W., Elmaagacli, A.H., 2011. Modulating impact of human chorionic gonadotropin hormone on the maturation and function of hematopoietic cells. J. Leukoc. Biol. 90, 1017–1026.
- Fluhr, H., Bischof-Islami, D., Krenzer, S., Licht, P., Bischof, P., Zygmunt,
M., 2008. Human chorionic gonadotropin stimulates matrix metalloproteinases-2 and -9 in cytotrophoblastic cells and decreases tissue inhibitor of metalloproteinases-1, -2, and -3 in decidualized endometrial stromal cells. Fertil. Steril. 90, 1390–1395. - Prast, J., Saleh, L., Husslein, H., Sonderegger, S., Helmer, H., Knofler,
M., 2008. Human chorionic gonadotropin stimulates trophoblast invasion through extracellularly regulated kinase and AKT signaling. Endocrinology 149, 979–987. - Tapia-Pizarro, A., Argandona, F., Palomino, W.A., Devoto, L., 2013. Human chorionic gonadotropin (hCG) modulation of TIMP1 secretion by human endometrial stromal cells facilitates extravillous trophoblast invasion in vitro. Hum. Reprod. 28, 2215–2227.





1 commento
Having red tjis I thought it was very informative. I appreciate yyou finding the time and energy too put this
artkcle together. I once again find mysel spending way too much time both reading and
psting comments. Buut sso what, itt wass still worthwhile!