Lo sviluppo embrionale nelle prime 8 settimane è detto embriogenesi ed è suddiviso in 4 fasi successive: segmentazione, fase di blastula, gastrula e organogenesi.
Al 14º giorno dopo la fecondazione la blastocisti è stata totalmente incorporata nello stroma dell’endometrio materno. Essa, dall’esterno all’interno, è costituita dal sinciziotrofoblasto, da cui si formano i villi coriali che penetrano nei sinusoidi delle arterie spirali. Internamente al sinciziotrofoblasto vi è il citotrofoblasto e sotto questo il mesoderma somatopleurico extraembrionale a cui l’embrione è attaccato per mezzo del peduncolo d’attacco, che successivamente diverrà il cordone ombelicale. L’embrione è ricoperto da uno strato di mesoderma splancnopleurico extraembrionale. Il disco embrionale è formato da due foglietti cellulari, uno superiore, detto epiblasto, che circonda la cavità amniotica e uno inferiore, l’ipoblasto, che circonda una cavità ad esso interna detta sacco vitellino secondario (1).
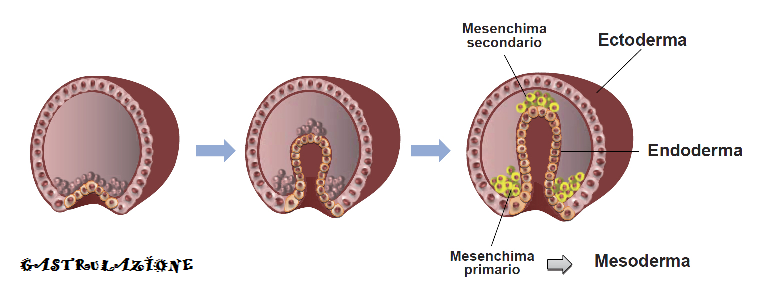
La gastrulazione (dal greco gaster, stomaco) è soprattutto movimentazione cellulare che avviene, dal 14-15° giorno, secondo varie modalità: invaginazione (o embolia), immigrazione, epibolia, e delaminazione (1-3).
In tal modo l’embrione cellule della blastocisti sono riposizionate da una semplice formazione a palla (blastocisti) in un organismo multistratificato in cui si riconoscono i piani strutturali definitivi dell’embrione. Le cellule che formeranno gli organi endodermici e mesodermici vengono portate all’interno, mentre le cellule ectodermiche restano disposte in superficie (4-5).
La gastrulazione inizia al 14-15º giorno dalla fecondazione con una piccola introflessione sulla superficie della blastula, un solco detto linea primitiva. In questa formazione si notano la fossetta primitiva, una depressione terminale della linea, sormontata da un rilievo detto nodo primitivo o di Hensen.
La linea primitiva si allunga e si approfondisce formando la gastrula a 2 strati cellulari; uno esterno o ectoderma ed uno interno o endoderma che si interpone fra epiblasto e ipoblasto. La cavità racchiusa fra i 2 strati si chiama archenteron e la sua apertura blastoporo che darà origine all’ano. Dall’endoderma origina il mesoderma che si interpone fra gli altri due foglietti embrionali; si forma così la gastrula a tre strati (6,7).
Organogenesi: Alla gastrulazione segue l’organogenesi, la formazione degli organi presenti solo come abbozzi nella gastrula. Dall’ectoderma originano l’epidermide e il tessuto nervoso, dal mesoderma originano scheletro, muscoli, reni, cuore, sangue e la maggior parte degli organi di riproduzione; dall’endoderma si formano il tubo digerente, il fegato, pancreas, tiroide e i polmoni.
Neurulazione: alla fine della gastrulazione, al 15° giorno circa dalla fecondazione, inizia la neurulazione che alcuni embriologi considerano una fase della gastrulazione. Sotto lo strato dorsale dell’ectoderma il mesoderma forma un cordone cellulare che prende il nome di notocorda la cui formazione si completa al 19° giorno. La notocorda costituisce un asse rigido attorno a cui si sviluppa l’embrione, partecipa allo sviluppo del mesoderma parassiale e definisce l’asse intorno a cui si sviluppano i corpi vertebrali. Infine, la notocorda induce il differenziamento dell’ectoderma in neuroectoderma (processo di neurulazione)
Sopra la notocorda alcune cellule dell’ectoderma migrano dalla periferia verso l’asse centrale, creando un ispessimento chiamato linea primitiva. All’estremità craniale di tale linea si forma una zona di  ispessimento chiamata nodo di Hensen. Successivamente le cellule della linea primitiva di approfondano formando un solco longitudinale sul dorso dell’embrione. Successivamente i bordi di questo solco, detti creste neurali, si avvicinano fino a saldarsi completamente dando origine al tubo neurale (26° giorno dalla fecondazione). La fusione inizia nella regione cervicale e procede in direzione cefalo-caudale. La mancata chiusura delle creste inferiori è causa di spina bifida, meningocele e mielomeningocele. La mancata chiusura delle pliche craniali può essere causa dell’anencefalia. All’epoca della chiusura del tubo neurale il CRL fetale misura 3 mm. Il tubo neurale darà origine alle tre vescicole cerebrali primitive: prosencefali, mesencefalo e romboencefalo. Le cellule poste all’apice delle creste neurali sono dette cellule delle creste neurali e daranno origine ai gangli nervosi sensoriali e alle cellule di Schwan (8).
ispessimento chiamata nodo di Hensen. Successivamente le cellule della linea primitiva di approfondano formando un solco longitudinale sul dorso dell’embrione. Successivamente i bordi di questo solco, detti creste neurali, si avvicinano fino a saldarsi completamente dando origine al tubo neurale (26° giorno dalla fecondazione). La fusione inizia nella regione cervicale e procede in direzione cefalo-caudale. La mancata chiusura delle creste inferiori è causa di spina bifida, meningocele e mielomeningocele. La mancata chiusura delle pliche craniali può essere causa dell’anencefalia. All’epoca della chiusura del tubo neurale il CRL fetale misura 3 mm. Il tubo neurale darà origine alle tre vescicole cerebrali primitive: prosencefali, mesencefalo e romboencefalo. Le cellule poste all’apice delle creste neurali sono dette cellule delle creste neurali e daranno origine ai gangli nervosi sensoriali e alle cellule di Schwan (8).
Le cellule che migrano attraverso la parte più craniale della linea primitiva formano il mesoderma parassiale, che darà luogo ai somiti che formeranno cartilagine, ossa, tendini, derma, muscoli, pars midollare del surrene, setto interatriale ed interventricolare. . Il mesoderma intermedio che migra dalla regione centrale della linea primitiva è all’origine del tratto urogenitale (9). Altre cellule migrano attraverso la parte caudale della linea primitiva e formano il mesoderma laterale, e il mesoderma extraembrionale (10-13).
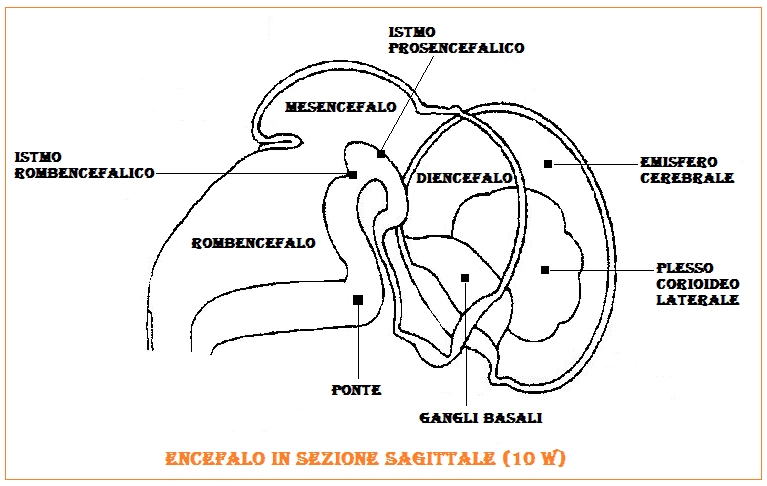
SNC: Alla 6ª settimana il tubo neurale si dilata dando origine a tre vescicole separate da due solchi: prosencefalo, mesencefalo e romboencefalo.
Nel corso della 7ª settimana di età gestazionale il tubo neurale si piega in avanti fino a che i 2/3 superiori formano un angolo di 70° circa con il terzo posteriore.
Durante la 5ª settimana di vita gestazionale il prosencefalo presenterà due protuberanze su entrambi i lati del prosencefalo, le vescicole ottiche (che daranno origine alla retina ed ai nervi ottici). Subito dopo compaiono due ulteriori protuberanze, più rostralmente e dorsalmente alle precedenti, le vescicole telencefaliche (i futuri emisferi cerebrali) le cui cavità diverranno i ventricoli laterali. La parte caudale delle vescicole telencefaliche darà origine al III° ventricolo, ippocampo, gangli della base, amigdala e al diencefalo.
Diencefalo: porzione del cervello che racchiude il 3° ventricolo e che è costituita dal talamo, dal  metatalamo con i corpi genicolati, dall’epitalamo con il corpo pineale (epifisi) e la regione abenulare, dal subtalamo con i corpo di Luys, la sostanza nigra di Sommering e il nucleo rosso, dall’ipotalamo con il tuber, il peduncolo ipofisario e la porzione nervosa dell’ipofisi (neuroipofisi o ipofisi posteriore).
metatalamo con i corpi genicolati, dall’epitalamo con il corpo pineale (epifisi) e la regione abenulare, dal subtalamo con i corpo di Luys, la sostanza nigra di Sommering e il nucleo rosso, dall’ipotalamo con il tuber, il peduncolo ipofisario e la porzione nervosa dell’ipofisi (neuroipofisi o ipofisi posteriore).
Nella parete laterale del III° ventricolo iniziano a svilupparsi tre rigonfiamenti che presto diverranno (in senso dorso-ventrale) l’epitalamo, il talamo e l’ipotalamo, separati dal solco epitalamico (dorsale) e dal solco ipotalamico (ventrale). Il talamo si sviluppa assai rapidamente sporgendo presto all’interno del III° ventricolo, che a questo livello sarà ridotto a un passaggio molto stretto, e fondendosi nel 70% dei casi con la metà controlaterale tramite l’adesione intertalamica (massa intermedia). L’ipotalamo origina da neuroblasti della zona intermedia delle pareti diencefaliche: alcuni di questi neuroblasti si distaccheranno in una fase più tardiva a formare un nucleo con attività preminentemente endocrina mentre altri neuroni formeranno una coppia di nuclei ventrali, i corpi mammillari. L’epitalamo origina dal tetto e dalla porzione dorsale delle pareti diencefaliche proliferando notevolmente nelle fasi iniziali e poi riducendo la propria massa ad un piccolo ammasso di neuroni. Un diverticolo originato invece dalla porzione caudale del tetto del diencefalo formerà un ammasso compatto di neuroni, la ghiandola epifisaria. L’ipofisi è una ghiandola di origine ectodermica e prende origine da un’espansione dell’ectoderma del tetto dello stomodeo, la tasca di Rathke che formerà l’adenoipofisi. Un’espansione proveniente dal neuroectoderma del diencefalo, il bottone neuroipofisario, formerà la neuroipofisi (16,17).
Telencefalo: è la porzione più estesa dell’encefalo ed insieme al diencefalo costituisce il cervello. Nelle fasi iniziali di sviluppo la vescicola telencefalica è composta da una porzione mediana e due diverticoli laterali, le vescicole cerebrali, cioè gli abbozzi degli emisferi cerebrali. Le vescicole  cerebrali, in questo stadio, sono in comunicazione aperta con la cavità del III° ventricolo attraverso i forami interventricolari. La porzione mediana (ricoperta da cellule ependimali) della parete degli emisferi cerebrali in via di formazione (fessura coroidea) – in continuazione diretta con il tetto del III ventricolo – si assottiglierà e formerà i plessi coroidei. Gli emisferi cerebrali subiscono una trasformazione importante proliferando notevolmente sino a coprire il diencefalo, il mesencefalo e l’intero tronco cerebrale; essi si uniscono lungo la linea mediana appiattendo le loro superfici mediali: lo strato di mesenchima che rimane inserito in questo spazio formerà la falce cerebrale che è una ripiegatura del foglietto della dura madre. Alla 6ª settimana comparirà il corpo striato come protuberanza bilaterale nel pavimento degli emisferi cerebrali: il processo di proliferazione del pavimento di ciascun emisfero
cerebrali, in questo stadio, sono in comunicazione aperta con la cavità del III° ventricolo attraverso i forami interventricolari. La porzione mediana (ricoperta da cellule ependimali) della parete degli emisferi cerebrali in via di formazione (fessura coroidea) – in continuazione diretta con il tetto del III ventricolo – si assottiglierà e formerà i plessi coroidei. Gli emisferi cerebrali subiscono una trasformazione importante proliferando notevolmente sino a coprire il diencefalo, il mesencefalo e l’intero tronco cerebrale; essi si uniscono lungo la linea mediana appiattendo le loro superfici mediali: lo strato di mesenchima che rimane inserito in questo spazio formerà la falce cerebrale che è una ripiegatura del foglietto della dura madre. Alla 6ª settimana comparirà il corpo striato come protuberanza bilaterale nel pavimento degli emisferi cerebrali: il processo di proliferazione del pavimento di ciascun emisfero  avviene in realtà ad una velocità assai inferiore a quella delle pareti corticali per la presenza del grosso agglomerato cellulare del corpo striato. Questa è la ragione per cui gli emisferi avranno una forma definitiva a “C”. Anche le cavità ventricolari risentiranno di tale forma a “C” modellandosi nella stessa maniera. L’estremità caudale di ciascun emisfero, inoltre, si ripiegherà ventralmente e rostralmente formando i lobi temporali. Seguendo passivamente tale manovra di ripiegamento i ventricoli laterali formeranno il corno temporale e la fessura coroidea con i
avviene in realtà ad una velocità assai inferiore a quella delle pareti corticali per la presenza del grosso agglomerato cellulare del corpo striato. Questa è la ragione per cui gli emisferi avranno una forma definitiva a “C”. Anche le cavità ventricolari risentiranno di tale forma a “C” modellandosi nella stessa maniera. L’estremità caudale di ciascun emisfero, inoltre, si ripiegherà ventralmente e rostralmente formando i lobi temporali. Seguendo passivamente tale manovra di ripiegamento i ventricoli laterali formeranno il corno temporale e la fessura coroidea con i  plessi coroidei del corno temporale. A mano a mano che la corteccia cerebrale si sviluppa le fibre corticospinali si ingrandiscono a formare la capsula interna e la capsula esterna che divideranno il corpo striato in nucleo caudato (che assumerà anch’esso forma a “C”) e nucleo lenticolare. Le pareti degli emisferi cerebrali in via di sviluppo sono composte nelle fasi iniziali dalla tre tipiche zone che caratterizzano il tubo neurale: zona ventricolare, intermedia e marginale. Successivamente, comparirà una quarta zona, la zona subventricolare. Le cellule della zona intermedia migrano verso la zona marginale dando origine agli strati della corteccia cerebrale. La sostanza grigia sarà quindi localizzata perifericamente e gli assoni originatisi da queste cellule attraverseranno la regione emisferica centrale formando la sostanza bianca.
plessi coroidei del corno temporale. A mano a mano che la corteccia cerebrale si sviluppa le fibre corticospinali si ingrandiscono a formare la capsula interna e la capsula esterna che divideranno il corpo striato in nucleo caudato (che assumerà anch’esso forma a “C”) e nucleo lenticolare. Le pareti degli emisferi cerebrali in via di sviluppo sono composte nelle fasi iniziali dalla tre tipiche zone che caratterizzano il tubo neurale: zona ventricolare, intermedia e marginale. Successivamente, comparirà una quarta zona, la zona subventricolare. Le cellule della zona intermedia migrano verso la zona marginale dando origine agli strati della corteccia cerebrale. La sostanza grigia sarà quindi localizzata perifericamente e gli assoni originatisi da queste cellule attraverseranno la regione emisferica centrale formando la sostanza bianca.
Il mesencefalo non va incontro ad ulteriori suddivisioni, costituisce la parte più breve del tronco encefalico essendo lungo appena 2 cm a completamento di crescita. Come tutto il tronco encefalico il m. è contenuto nella fossa cranica posteriore. Nel m. vengono convenzionalmente distinte due parti, i 2 peduncoli cerebrali, uno per lato, disposti lateralmente e il tetto del mesencefalo tra essi compreso. I peduncoli cerebrali sono ulteriormente divisi dalla substantia nigra in una parte anteriore detta piede e in una parte posteriore detta parte tegmentale. A questo livello avviene l’elaborazione delle informazioni visive. A dividere tra loro i peduncoli si trova la fossa interpeduncolare da cui si svilupperà l’acquedotto di Silvio all’interno del quale scorre il liquido cefalo-rachidiano.
Il romboencefalo si suddivide in metencefalo (cervelletto e ponte) e mielencefalo (bulbo e midollo spinale). Il c e r v e l l e t t o prende origine alla 5ª-6ª settimana da un ispessimento della porzione dorsale delle lamine alari. La flessura cervicale separa il metencefalo dal mielencefalo: questa flessura sarà poi rappresentata dalla radice del 1° nervo spinale localizzata grossolanamente nel futuro forame magno. La cavità liquorale sarà rappresentata dal IV° ventricolo e dal canale centrale della parte caudale del bulbo.
Al 18° giorno, le cellule del mesoderma più vicine al processo cefalico proliferano attivamente dando origine a ispessimenti paralleli (mesoderma parassiale). Nel mesoderma laterale, invece, si creano delle cavità che confluiscono separandolo in somatopleura (a contatto con l’ectoderma) e splancnopleura (ricopre l’endoderma). Il tratto di mesoderma che collega il parassiale al laterale si ispessisce a sua volta in due cordoni paralleli (mesoderma intermedio). Alla fine della terza settimana il mesoderma posto a fianco del tubo neurale si organizza in raggruppamenti chiamati somiti.
ORGANOGENESI CARDIACA: Il cuore comincia a battere e pompare sangue a circa 21-22 giorni dalla fecondazione (14) Mioblasti cardiaci e isole di angioblasti derivate dal mesenchima splancnopleurico su ciascun lato della piastra neurale, danno luogo alla regione cardiogena. Questa è una zona a forma di ferro di cavallo, vicino alla testa dell’embrione. Dal 19° giorno dalla fecondazione due filamenti tubiformi cominciano a formarsi in questa regione: i tubi endocardiaci. Questi due tubi crescono e dopo 21 giorni sono migrati l’uno verso l’altro e fusi in un unico tubo cardiaco primitivo, cuore tubolare composto dal solo endocardio. Successivamente altre cellule, prevalentemente contrattili, si associano al tubo cardiaco generando il miocardio, separato dall’endocardio dalla gelatina cardiaca. Un terzo gruppo di cellule ricopre il miocardio, l’epicardio.
Nello stesso tempo al 18° giorno di fecondazione con le cellule del mesoderma splancnopleurico che si differenziano in angioblasti e quindi in cellule endoteliali appiattite che si uniscono per formare i vasi sanguigni.
Il cuore tubolare forma rapidamente cinque regioni distinte. Dall’alto in basso, questi sono infundibolo,  bulbo cordis, ventricolo primitivo, atrio primitivo e il seno venoso. Inizialmente, tutto il sangue venoso scorre nel seno venoso, ed è spinto dal basso in alto attraverso il tronco arterioso. Quest’ultimo si dividerà per formare l’aorta e l’arteria polmonare. Il modellamento cardiaco inizia entro la fine della quarta settimana. La morte cellulare programmata (apoptosi) è coinvolto in questo processo, in corrispondenza delle superfici di giunzione consentondo la fusione. Durante i primi due mesi di sviluppo, il setto interatriale comincia a formarsi. Questo setto divide l’atrio primitivo in atrio dx e sn. Un secondo setto (secundum setto) comincia a formarsi a destra del setto primum. Questo lascia anche una piccola apertura, il forame ovale che è in continuum con la precedente apertura del secundum ostio. Il setto primum è ridotto a un piccolo lembo che funge da valvola della forame ovale e questo rimane fino alla sua chiusura alla nascita. Tra i ventricoli si sviluppa il setto interventricolare; alla 5a settimana i ventricoli risultano morfologicamente ben definiti e separati (15).
bulbo cordis, ventricolo primitivo, atrio primitivo e il seno venoso. Inizialmente, tutto il sangue venoso scorre nel seno venoso, ed è spinto dal basso in alto attraverso il tronco arterioso. Quest’ultimo si dividerà per formare l’aorta e l’arteria polmonare. Il modellamento cardiaco inizia entro la fine della quarta settimana. La morte cellulare programmata (apoptosi) è coinvolto in questo processo, in corrispondenza delle superfici di giunzione consentondo la fusione. Durante i primi due mesi di sviluppo, il setto interatriale comincia a formarsi. Questo setto divide l’atrio primitivo in atrio dx e sn. Un secondo setto (secundum setto) comincia a formarsi a destra del setto primum. Questo lascia anche una piccola apertura, il forame ovale che è in continuum con la precedente apertura del secundum ostio. Il setto primum è ridotto a un piccolo lembo che funge da valvola della forame ovale e questo rimane fino alla sua chiusura alla nascita. Tra i ventricoli si sviluppa il setto interventricolare; alla 5a settimana i ventricoli risultano morfologicamente ben definiti e separati (15).
Sangue: le cellule ematiche invece vengono prodotte alla 3a settimana, nelle isole ematiche (emangioma) che si trovano nel sacco vitellino (18). Recentemente è stata individuata una seconda sorgente di cellule staminali ematiche (HSCs, Hematopoietic Stem Cells) di derivazione sempre mesodermica, alla 4a settimana dalla fecondazione, nella splancnopleura paraortica dall’emangioblasto o mesoderma emogenico. Queste cellule migrano sulla parete ventrale dell’aorta e quindi colonizzano in esclusiva il sistema linfomieloide (fegato, milza e midollo spinale) (19,20). Studi ancora più recenti sembrano indicare come fonte emoangioblastica anche l’allantoide e la placenta (22,23).
La cellula ematica madre è detta emocitoblasto. Da essa derivano gli eritroblasti, i mieloblasti, i linfoblasti, monoblasti e megacarioblasti. Con l’accumulo di emoglobina e l’espulsione del nucleo gli eritroblasti si trasformano in reticolociti (così denominati perchè se trattati con blu cresile brillante precipitano sotto forma di sostanza granulosa e filamentosa: “reticolare”).e  quindi evolvono in eritrociti primitivi. Gli eritrociti primitivi possiedono emoglobina fetale dotata di maggiore affinità per O2. L’emoglobina adulta inizia ad essere prodotta dal 4° mese. Le cellule staminali emopoietiche del sacco vitellino possono generare anche granulociti, monociti. Dalla 5°-6° settimana inizia l’emopoiesi epatica (eritrociti definitivi, megacariociti, leucociti); i linfociti T cominciano a differenziarsi nel timo. Al 5° mese l’emopoiesi passa al midollo osseo (sede definitiva dell’emopoiesi) e si sviluppano gli organi linfoidi. Il midollo osseo inizia la produzione di linfociti B e precursori di linfociti T mentre il timo produce linfociti T maturi. Organi linfoidi secondari come le tonsille (originate dall’endoderma dell’intestino primitivo), la milza (originate dallo stroma delle cellule mesenchimali del mesogastrio dorsale), i linfonodi (cellule mesenchimali, lungo i vasi linfatici in formazione, per gemmazione dell’endotelio delle vene). Visibili tra l’8° e l’11° settimana le placche di Peyer (aggregazione di linfociti e cellule dendritiche al disotto della mucosa dell’intestino tenue).
quindi evolvono in eritrociti primitivi. Gli eritrociti primitivi possiedono emoglobina fetale dotata di maggiore affinità per O2. L’emoglobina adulta inizia ad essere prodotta dal 4° mese. Le cellule staminali emopoietiche del sacco vitellino possono generare anche granulociti, monociti. Dalla 5°-6° settimana inizia l’emopoiesi epatica (eritrociti definitivi, megacariociti, leucociti); i linfociti T cominciano a differenziarsi nel timo. Al 5° mese l’emopoiesi passa al midollo osseo (sede definitiva dell’emopoiesi) e si sviluppano gli organi linfoidi. Il midollo osseo inizia la produzione di linfociti B e precursori di linfociti T mentre il timo produce linfociti T maturi. Organi linfoidi secondari come le tonsille (originate dall’endoderma dell’intestino primitivo), la milza (originate dallo stroma delle cellule mesenchimali del mesogastrio dorsale), i linfonodi (cellule mesenchimali, lungo i vasi linfatici in formazione, per gemmazione dell’endotelio delle vene). Visibili tra l’8° e l’11° settimana le placche di Peyer (aggregazione di linfociti e cellule dendritiche al disotto della mucosa dell’intestino tenue).
Dalla placca precordale si formano la membrana buccofaringea, lo stomodeo, (dal greco stom, bocca e odaios, via) una regione tondeggiante  formata da ectoderma ed endoderma e precursore della cavità orale, e la membrana cloacale, suo corrispettivo al polo opposto (caudale). Lo stomodeo è il precursore della bocca e del lobo anteriore della ghiandola ipofisaria (adenoipofisi). che deriva esattamente dalla tasca di Rathke, una piega dello stomodeo mentre la neuroipofisi proviene dal pavimento del diencefalo.
formata da ectoderma ed endoderma e precursore della cavità orale, e la membrana cloacale, suo corrispettivo al polo opposto (caudale). Lo stomodeo è il precursore della bocca e del lobo anteriore della ghiandola ipofisaria (adenoipofisi). che deriva esattamente dalla tasca di Rathke, una piega dello stomodeo mentre la neuroipofisi proviene dal pavimento del diencefalo.
Quando la membrana cloacale si è formata, compare anche un diverticolo del sacco vitellino che penetra nel mesoderma splancnopleurico extraembrionale presso il peduncolo d’attacco, detto allantoide. L’allantoide (dal greco allantoeides che letteralmente significa “dalla forma di salsicciotto”), formerà, insieme ad altri componenti embrionali, il cordone ombelicale. Alla nascita, con la recisione del cordone ombelicale, la porzione di allantoide rimasta all’interno del corpo è destinata a trasformarsi in un legamento fibroso, l’uraco. Questo contribuirà a tenere saldamente connesso l’apice della vescica alla parete addominale ventrale formando il legamento ombelicale mediano, affiancato da altri due laterali.
Dal 17º giorno il mesoderma si espande in direzione cranio-caudale e trasversalmente, facendo perdere i contatti tra l’epiblasto e l’ipoblasto e venendo invece a contatto con il mesoderma splancnopleurico extraembrionale che li ricopre. Il mesoderma intraembrionale si dispone inoltre ai lati della placca precordale che si è formata dalle prime cellule migrate dietro la membrana buccofaringea.
Intestino: Nella quarta settimana l’ectoderma si estende sul resto del corpo embrionale, creando una piega cefalica e una piega caudale con l’effetto di deporre uno strato di amnios attorno all’intero embrione e di ripiegare i foglietti ruotando gli abbozzi. Le due pieghe danno origine all’intestino primitivo, il cui lume è formato dal sacco vitellino.
I movimenti delle pieghe creano altresì delle depressioni a forma di imbuto: una cefalica che termina con la membrana faringea (stomodeo); una caudale che termina con la membrana cloacale (proctodeo).
SVILUPPO DELLA FACCIA
Apparato faringeo E’ definito anche brachiale, genera organi della testa, del collo compresi il primo tratto dell’apparato digerente e respiratorio. E’ costituito da:
Anelli detti archi. Sono 5, numerati da I a VI perché il V regredisce immediatamente. composti ognuno da tutti i tre foglietti germinativi di cui:
Il foglietto ectodermico forma i solchi
Il foglietto endodermico forma le tasche
Le giunzioni dei solchi e delle tasche produrranno la formazione delle membrane branchiali
Archi faringei o branchiali Ogni arco è composto da un asse di mesoderma prevalentemente proveniente dalle creste neurali. A partire dal secondo mese le pieghe degli archi scompaiono
I arco : mandibolare
- Ossa della faccia (principalmente mandibola e mascella), per ossificazione diretta dal mesenchima
- Incudine e martello dalla cartilagine di Meckel o Muscoli masticatori
- la staffa per ossificazione endocondrale dalla cartilagine del Reichert
- Processo stiloideo
- Porzione superiore dell’osso ioide
- Grandi corna e corpo dell’osso ioide per ossificazione endocondrale
- Cartilagini della laringe
Solchi faringei In numero di 4 dall’ectoderma
I solco: condotto uditivo esterno, porzione esterna membrana timpano
II, III e IV: nessuna formazione. il II alla 6° sett forma il seno cervicale che si oblitera
Tasche faringee
I tasca: tuba o tromba di Eustachio (orecchio medio), membrana timpanica e cavità timpanica
II tasca: tonsilla palatina
III tasca: abbozzi timo, parotidi inferiori
IV tasca: parotidi superiori
VI tasca: corpo ultimo branchiale, le cellule migreranno a formare le cellule C della tiroide
Formazione della lingua
Verso la 4° sett si formano degli abbozzi sulla porzione posteriore degli archi faringei che costituiranno il rivestimento della lingua:
Tubercolo impari e due tubercoli laterali sul I arco faringeo, fondendosi formeranno gran parte del corpo della lingua
- Copula (regione mediana II arco) e eminenza ipobranchiale (III e IV arco) formeranno la radice della lingua.
- l’abbozzo endodermico della lingua si riempie di cellule provenienti dai somiti occipitali, mioblasti che origineranno la muscolatura scheletrica della lingua
- Formazione della tiroide
- Dalla 4° sett a livello dello stomodeo invaginazione di endoderma forma il foramen caecum, separa il I arco dal II
- All’interno del foramen caecum scende l’abbozzo tiroideo fino alla 7° sett
- La tiroide produce ormoni sin dal 3° mese di sviluppo
- Ghiandole salivari
- Parotidi: ectoderma
- Sottomandibolare: endodermica
- Sottolinguali: endoderma
Sviluppo della faccia
Cresta neurale: tessuti scheletrici e connettivali della faccia
La faccia si sviluppa intorno allo stomodeo
5 abbozzi si formano durante la 4° sett:
- Processo frontale (dal tetto stomodeo)
- Due processi mascellari (porzione laterale I arco)
- Due processi mandibolari (dal I arco faringeo)
- La parte superiore origina il setto nasale
- Quella inferiore il filtro del labbro superiore
- Quella intermedia i quattro incisivi superiori
- Quella interna il palato primitivo
Bibliografia:
- Forgács, G. & Newman, Stuart A. (2005). “Cleavage and blastula formation”. Biological physics of the developing embryo. Cambridge University Press. p. 27. ISBN 978-0-521-78337-8.
- Sadler, T.W.; Langman, Jan (2012) [1st. Pub. 2001]. “Chapter 3: Primera semana del desarrollo: de la ovulación a la implantación”. In Seigafuse, sonya. Langman, Embriología médica. Lippincott Williams & Wilkins, Wolters Kluwer. pp. 29–42.
- Carlson, Bruce M. (1999) [1t. Pub. 1997]. “Chapter 4: Formation of germ layers and initial derivatives”. Human Embryology & Developmental Biology. Mosby, Inc. pp. 62–68. ISBN 0-8151-1458-3.
- Keller R, Clark WH Jr, Griffin F, eds. 1991. Gastrulation. Movements, Patterns, and Molecules. New York/London: Plenum
- Keller R, Davidson LA. 2004. Cell movements of gastrulation. See Stern 2004b, pp. 291–304
- David-Emlyn Parfitt , Michael M. Shen: From blastocyst to gastrula: gene regulatory networks of embryonic stem cells and early mouse embryogenesis. DOI: 10.1098/rstb.2013.0542 Published 27 October 2014
- Lila Solnica-Krezel and Diane S. Sepich: “Gastrulation: Making and Shaping Germ Layers”. Annu. Rev. Cell Dev. Biol. 2012. 28:687–717
- Larsen, W J (2001). Human Embryology (3rd ed.). Elsevier. p. 87
- Brent AE, Schweitzer R, Tabin CJ (April 2003). “A somitic compartment of tendon progenitors”. Cell 113 (2): 235–48.
- Sadler, T.W.; Langman, Jan (2012) [1st. Pub. 2001]. “Chapter 3: Primera semana del desarrollo: de la ovulación a la implantación”. In Seigafuse, sonya. Langman, Embriología médica. Lippincott Williams & Wilkins, Wolters Kluwer. pp. 29–42
- Moore, Keith L.; Persaud, V.N. (2003) [1t. Pub. 1996]. “Chapter 3: Formation of the bilaminar embryonic disc: second week”. The Developing Human, Clinically Oriented Embryology. W B Saunders Co. pp. 47–51
- Larsen, William J.; Sherman, Lawrence S.; Potter, S. Steven; Scott, William J. (2001) [1t. Pub. 1998]. “Chapter 2: Bilaminar embryonic disc development and establishment of the uteroplacental circulation”. Human Embryology. Churchill Livingstone. pp. 37–45.
- Smith Agreda, Víctor; Ferrés Torres, Elvira; Montesinos Castro-Girona, Manuel (1992). “Chapter 5: Organización del desarrollo: Fase de germinación”. Manual de embriología y anatomía general. Universitat de València. pp. 72–85.
- Betts, J. Gordon (2013). Anatomy & physiology. pp. 787–846
- Larsen, W J (2001). Human Embryology (3rd ed.). Elsevier. pp. 170–190
- CA R L S O N B . M ., Human Embriology and Developmental Biology, Mosby, St. Louis, 1994
- MO O R E K . L ., PE R S A U D T . V . N ., The Developing Human 6ª ed., WB Saunders Company, Filadelfia, 1998
- Tavian M1, Péault B.: “Embryonic development of the human hematopoietic system”. Int J Dev Biol. 2005;49(2-3):243-50.
- Peault B1, Tavian M.: “Hematopoietic stem cell emergence in the human embryo and fetus”. Ann N Y Acad Sci. 2003 May;996:132-40.
-
Dieterlen-Lièvre F1, Godin I, Pardanaud L. Where do hematopoietic stem cells come from? Int Arch Allergy Immunol. 1997 Jan;112(1):3-8.
- Tavian M1, Zheng B, Oberlin E, Crisan M, Sun B, Huard J, Peault B.: “The vascular wall as a source of stem cells”. Ann N Y Acad Sci. 2005 Jun;1044:41-50.
-
Tavian M1, Robin C, Coulombel L, Péault B. The human embryo, but not its yolk sac, generates lympho-myeloid stem cells: mapping multipotent hematopoietic cell fate in intraembryonic mesoderm. Immunity. 2001 Sep;15(3):487-95.
- Bollerot K1, Pouget C, Jaffredo T.: “The embryonic origins of hematopoietic stem cells: a tale of hemangioblast and hemogenic endothelium”. APMIS. 2005 Nov-Dec;113(11-12):790-803.