Ultimo aggiornamento 2021-05-01 16:35:18
I MARKERS TUMORALI IN ONCOLOGIA GINECOLOGICA
Il termine marker o marcatore, si riferisce ad una qualsiasi molecola caratteristica di una malattia. In campo oncologico si fa riferimento a sostanze prodotte direttamente dal tumore come ormoni, enzimi o altre  proteine, tutti più o meno correlati alla crescita numerica delle cellule tumorali oppure sostanze prodotte dall’organismo in risposta al tumore, similmente alle proteine prodotte dall’organismo in risposta alla fase acuta dell’infiammazione
proteine, tutti più o meno correlati alla crescita numerica delle cellule tumorali oppure sostanze prodotte dall’organismo in risposta al tumore, similmente alle proteine prodotte dall’organismo in risposta alla fase acuta dell’infiammazione
Il termine marcatore tumorale (marker) è stato adoperato per la prima volta all’inizio degli anni ’60, epoca in cui vennero identificati l’α-feto-proteina (α-FP) e l’antigene carcino-embrionario (CEA).
Classificazione: I marcatori tumorali attualmente identificabili sono numerosi, la ricerca è in continua evoluzione, e da ciò è nata la necessità di una classificazione:
- Markers nucleari: oncogeni.
- Markers citoplasmatici metabolici e di differenzazione: enzimi, isoenzimi, ormoni eutopici ed ectopici, antigeni oncofetali, e prodotti rilasciati da cellule in moltiplicazioni, poliamine, mucinosi.
- Markers di membrana: glicoproteine, fibronectina, antigeni associati al tumore.
- Markers indotti dal tumore: proteine di fase acuta, ecc.
| Caratteristiche del marker ideale |
| – Massima sensibilità (tale da identificare anche un esiguo numero di cellule tumorali) |
| – Specificità, rispetto alla neoplasia o all’istotipo |
| – Metodica di determinazione semplice, economica e riproducibile |
| – Corrispondenza del valore determinato con l’estensione della malattia (numero di cellule tumorali) |
SENSIBILITA’ DEI MARKERS:
Il marker ideale dovrebbe permettere di monitorizzare la crescita delle cellule tumorali sin dalle fasi più precoci. Tuttavia, pur avendo markers con sensibilità molto elevata, al fine di poterne rilevare la concentrazione nei liquidi biologici occorre che le cellule neoplastiche raggiungano un numero sufficiente. Sfortunatamente le neoplasie sono per lo più costituite da cellule eterogenee e i livelli di produzione dei relativi markers non sempre sono correlati con il volume della massa tumorale. In conclusione sulla sensibilità dei markers, possiamo affermare che:
- Alcuni markers consentono di porre diagnosi di malattia
- Alcuni corroborano la diagnosi di malattia
- Tutti consentono una valutazione di efficacia della terapia
SPECIFICITA’ DEI MARKERS: Per ciò che concerne la specificità, è bene precisare che praticamente non esiste un marker correlabile in maniera univoca e diretta ad un solo tipo di neoplasia (tranne rari casi, come la ß-HCG nella malattia del trofoblasto). Pertanto l’utilizzazione dei markers va associata ad altre metodiche diagnostiche ed è ad esse complementare. In considerazione di ciò finora solo in qualche caso i markers sono stati impiegati nello screening diagnostico di talune neoplasie, mentre trovano logica applicazione nel monitoraggio dell’evoluzione della malattia neoplastica, anche in relazione agli interventi terapeutici. Poichè, come detto, non esiste una specificità assoluta, vengono di solito adoperati più marcatori e spesso la valutazione dell’andamento clinico di una neoplasia si avvale del quadro globale dei dosaggi di diversi markers.
Possibili cause di valori alterati: Valori lievemente alterati possono essere associati a infiammazioni spesso riconducibili a un organo specifico. Valori superiori alla media hanno generalmente il significato di terapia non efficace, mentre la ricomparsa di elevate concentrazioni del marcatore in esame in pazienti in fase di monitoraggio post terapeutico indica spesso la comparsa di metastasi o la ripresa della malattia.
I valori di riferimento sono semplicemente il risultato di rilevazioni statistiche. Il reale significato in termini di malattia o salute può essere stabilito solo dal medico curante che colloca i risultati dell’esame clinico nel quadro più generale dello stato del paziente. Inoltre, tali valori possono cambiare nei diversi laboratori essendo calcolati sulla popolazione locale. Si fa presente che alcune unità di misura tuttora di uso comune sono destinate a lasciare il posto al “Sistema Internazionale di Unità” (SI); pertanto i risultati espressi differentemente vanno convertiti.
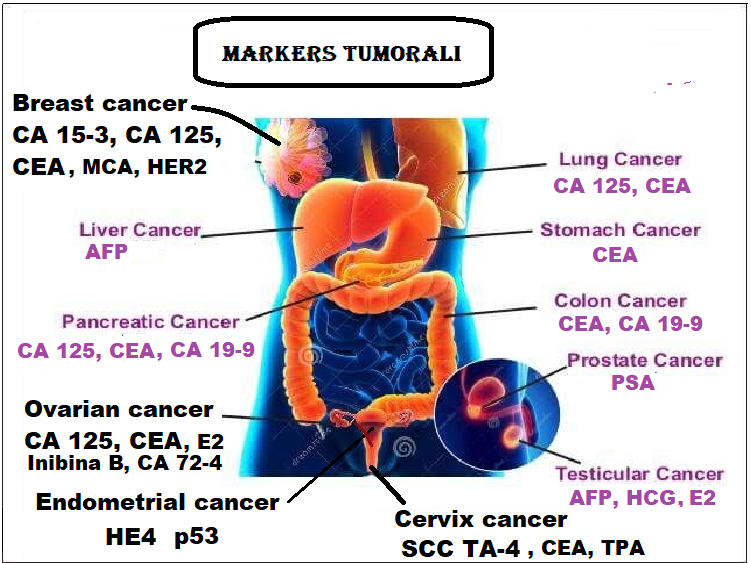
PRINCIPALI MARKERS GINECOLOGICI
Alcuni tipi istologici di neoplasie ginecologiche possono essere più agevolmente diagnosticati attraverso il dosaggio di specifici markers:
- 17-ß-estradiolo – l’elevata concentrazione sierica di 17-ß-estradiolo potrebbe essere dovuta a condizioni fisiologiche come la gravidanza oppure patologiche di natura genetica (sindrome di Klinefelter) oppure ancora neoplastiche (tumori secernenti estrogeni localizzati a livello della corteccia delle ghiandole surrenali, ovaia, testicoli).
- CA 125 – è specifico per i tumori ovarici e assume grande importanza nel monitoraggio per valutare la risposta alla terapia e nella valutazione precoce di ripresa della malattia. Marcatore mucinico, il CA 125 è un antigene (glicoproteina) espresso principalmente dal carcinoma ovarico di tipo sieroso dell’epitelio celomatico, riconosciuto dall’anticorpo monoclonale OC 125. In questa patologia dimostra una sensibilità del 75% dei casi, con specificità per le neoplasie ovariche molto elevata. Il CA 125 aumenta anche nel 50% dei casi di carcinoma tubarico, nel 5% dei casi di carcinoma endometriale e della cervice, nel 15% dei casi di carcinoma vulvare. E’ ormai comunemente accettata l’utilizzazione del CA 125 rispetto al CEA nel monitoraggio della neoplasia ovarica, anche se in presenza di malattia minima residua i falsi negativi sono oltre il 60%. Tassi superiori al range di normalità sono state riscontrate nell’1% dei soggetti sani, in donne gravide e nel 6% delle p/ti con patologia benigna; in particolare, in p/ti con cirrosi, epatite o patologia imalattia infiammatoria cronica del peritoneo o della pelvi,
 adenomiosi i valori possono risultare superiori anche a 20 volte la norma. E’ stato dimostrato che il tasso di CA 125 determinato in corso di chemioterapia, mesi dopo l’intervento chirurgico rifletteva l’efficacia del trattamento e costituiva il migliore fattore prognostico. A differenza del CA-125, il marcatore HE4 presenta un’elevata specificità, poiché i suoi livelli non aumentano in presenza di cisti o masse ovariche benigne (1-6).
adenomiosi i valori possono risultare superiori anche a 20 volte la norma. E’ stato dimostrato che il tasso di CA 125 determinato in corso di chemioterapia, mesi dopo l’intervento chirurgico rifletteva l’efficacia del trattamento e costituiva il migliore fattore prognostico. A differenza del CA-125, il marcatore HE4 presenta un’elevata specificità, poiché i suoi livelli non aumentano in presenza di cisti o masse ovariche benigne (1-6). 
- SCC-TA-4: detto anche TA-4, l’antigene SCC (Antigene Associato al Carcinoma Squamoso) è stato ottenuto tramite immunizzazione di animali con proteine di carcinoma originatosi dalla cervice uterina. Presente in concentrazioni di pochi nanogrammi, sia dell’uomo che della donna, esso si riscontra in maggiore concentrazione nelle lesioni ipercheratosiche e nelle displasie degli epiteli di rivestimento. Aumenta, in realtà, in presenza di altre neoplasie ginecologiche, anche se non a partenza dagli epiteli di rivestimento. La sensibilità è decrescente dal carcinoma della cervice al carcinoma vulvare, dal carcinoma ovarico a quello endometriale. Anche per questo marker l’impiego ideale è rappresentato dal monitoraggio delle p/ti, sia in terapia che nel follow-up; qualche autore ha cercato di dimostrare una correlazione fra il SCC e la prognosi.
- Gene per la proteina P16 e L1 sono nuovissimi marcatori tumorali che permettono di approfondire la diagnosi di ca. cervicale quando l’HPV (Papilloma virus), agente causale del 99% di tali tumori, risulta positivo all’esame del Pap-test. La proteina P16 è un oncosoppressore funzionando come CDKI (inibitore della chinasi dipendente dalla ciclina) con conseguente arresto delle mitosi cellulari. L1 è una molecola di adesione neuronale. Il gene che codifica L1 si trova vicino al telomero del braccio lungo del cromosoma X in Xq28. I geni per queste proteine si ritrovano mutati o down-regolati o con delezioni in vari fenomeni tumorali fra cui il melanoma erditario, il ca. cervicale e il ca. epatico e, nella donna, si possono si ricercare direttamente sullo striscio del Pap-test (7-22).
- CA 15-3: E’ legato alle neoplasie della mammella, soprattutto in stadi avanzati o in fase
 metastatica, tuttavia livelli superiori alla norma si rinvengono anche in tumori ovarici, gastrointestinali, prostatici. E’un antigene circolante espresso dalle cellule del tumore mammario, definito da 2 anticorpi monoclonali: 115D8 e DF. Il primo identifica un antigene glicoproteico presente nella porzione apicale delle cellule epiteliali denominato MAM-6, l’epitopo del DF è localizzato sui bordi delle cellule mammarie maligne e nel latte umano. Anch’esso è una glicoproteina, del peso molecolare di circa 400 KD ed è una struttura eterogenea sotto controllo genico multiallelico. I valori normali di CA 15-3 risultano compresi tra 0 e 32,4 U/ml. Concentrazioni normali di CA 15-3 non assicurano che la persona non abbia un tumore mammario localizzato o metastatico.Il CA 15-3 può essere moderatamente elevato anche nelle persone sane o affette da altri tipi di cancro (ad esempio: tumori maligni a carico di colon, polmone, pancreas, ovaio o prostata).
metastatica, tuttavia livelli superiori alla norma si rinvengono anche in tumori ovarici, gastrointestinali, prostatici. E’un antigene circolante espresso dalle cellule del tumore mammario, definito da 2 anticorpi monoclonali: 115D8 e DF. Il primo identifica un antigene glicoproteico presente nella porzione apicale delle cellule epiteliali denominato MAM-6, l’epitopo del DF è localizzato sui bordi delle cellule mammarie maligne e nel latte umano. Anch’esso è una glicoproteina, del peso molecolare di circa 400 KD ed è una struttura eterogenea sotto controllo genico multiallelico. I valori normali di CA 15-3 risultano compresi tra 0 e 32,4 U/ml. Concentrazioni normali di CA 15-3 non assicurano che la persona non abbia un tumore mammario localizzato o metastatico.Il CA 15-3 può essere moderatamente elevato anche nelle persone sane o affette da altri tipi di cancro (ad esempio: tumori maligni a carico di colon, polmone, pancreas, ovaio o prostata).
Un incremento dell’antigene tumorale 15-3 può essere riscontrato anche in vari altri tipi di patologie come:- Cirrosi;
- Epatite
- Alcune patologie benigne della mammella.
Alti livelli di questo marcatore possono essere presenti anche in patologie di tipo reumatico.
- HER-2 se risulta in over expression sembra, almeno per quanto concerne il carcinoma mammario, essere correlato ad una prognosi peggiore.
- gene suppressor p5, sito sul cromosoma 17p la cui over expression o il cui mutamento è stato dimostrato in circa il 0-50% delle neoplasie ovariche.
- MCA: L’antigene mucinoso associato al cancro (MCA) è un antigene glicoproteico di elevato peso molecolare (50 KD), risulta dosabile nel sangue di p/ti affette da carcinoma mammario metastatico. Esistono anche nei confronti di questo antigene i falsi positivi: 4% di p/ti sane e 10% di donne con patologia mammaria non tumorale. Inoltre, patologie epatiche (cirrosi) ed insufficienza renale rappresentano delle condizioni di frequente falsa positività; anche in caso di neoplasie ovariche si riscontra, in circolo, l’MCA (40%). Pur non essendo stata ancora dimostrata un’identità immunologica, l’MCA presenta analogie con il CA 15- e la sua determinazione è da ritenere indispensabile nel monitoraggio delle p/ti con carcinoma mammario.
- ß-2-microglobulina: è un marcatore aspecifico e risulta positivo del 0-60% di tutte le neoplasie. Nei confronti del cancro mammario, la sensibilità è maggiore, così come in caso di linfomi, tumori broncogeni ed epatomi. Essendo eliminato per via renale, anche le nefropatie e le patologie infiammatorie croniche possono produrre un notevole numero di falsi positivi.
- PS-2: Molecola polipetidica correlata alla situazione recettoriale estrogenica del carcinoma mammario, ne identificherebbe la funzionalità; dunque anche questo marker potrebbe essere utilizzato per l’orientamento prognostico e terapeutico.
- CA 72-4: L’antigene carboidratico CA 72-4 è una glicoproteina tumore associata, mucinosa; il suo peso molecolare, di circa 400.000 D, è definito mediante due anticorpi monoclonali: CC 49 e B 72-4. Questo marker è caratterizzato dall’elevata specificità, ne è stata dimostrata la presenza, con titoli elevati, nel carcinoma ovarico, nell’epatocarcinoma e nei tumori polmonari non a piccole cellule. In presenza di carcinoma mucinoso ovarico, la ricerca del CA 72-4 si affianca obbligatoriamente alla titolazione del CA 125 il monitoraggio delle p/ti.
- CA 19-9: Antigene associato per lo più a cancro gastro-intestinale e perciò denominato anche Antigene del Cancro Gastro-Intestinale (GICA), ma è presente anche nel carcinoma del colon-retto (in tal caso può essere impiegato insieme o in alternativa al CEA). Può segnalare infiammazioni croniche di pancreas, fegato e intestino..In ginecologia è stato correlato al cancro dell’ovaio, soprattutto nelle sue varianti mucinose Ma non è utilizzabile nella pratica clinica a causa della sua scarsa specificità.
- E 1.2 – Anticorpo monoclonale versus il mammary serum antigen (MSA), è stato comparato al CA 15-3. E’ ritenuto utile seguirne le oscillazioni nel monitoraggio delle neoplasie mammarie, per la elevata sensibilità ed anche specificità.
- IL 6: E’ un fattore sia di crescita che di differenzazione e sembra svolgere un ruolo nello sviluppo e nella progressione del carcinoma ovarico.
-
HE4 (Human Epididymis Protein 4): Identificato per la prima volta a livello dell’epitelio dell’epididimo distale e descritto come un inibitore proteasico coinvolto nella maturazione spermatica, L’HE4 è iperespresso nel 93% dei carcinomi sierosi dell’ovaio e nel 100% dei carcinomi endometrioidi, oltre che nel 50% dei carcinomi ovarici a cellule chiare. I suoi livelli aumentano anche in corso di malattie benigne, come:
- Endometriosi;
- Fibromi uterini;
- Policistosi ovarica;
- Malattia infiammatoria pelvica;
- Gravidanza.
A differenza del CA-125, il marcatore HE4 presenta un’elevata specificità, poiché i suoi livelli non aumentano in presenza di cisti o masse ovariche benigne; possono tuttavia salire in presenza di altre neoplasie (come il cancro del pancreas, mammella e nei tumori delle cellule di transizione). Inoltre la sensibilità dell’HE4 è considerata superiore a quella del CA-125 anche negli stadi precoci della malattia. I valori normali sierici di HE4 sono 0-150 picomoli/L.
-
CEA (antigene carcinoembrionale): Nell’adulto la concentrazione di questo marcatore è <2,5 ng/ml. È per lo più associato a tumori del tratto intestinale, soprattutto a quelli del colon-retto, mammella e ovaio assumendo il significato di controllo della malattia a intervento effettuato (efficacia della terapia, eventuale ripresa).Viene impiegato anche per il monitoraggio dei tumori polmonari. In passato è stato usato per i tumori della mammella. Livelli moderatamente elevati di CEA si osservano anche in malattie non tumorali come colite ulcerosa, poliposi del colon, cirrosi, epatiti e spesso nei forti fumatori. Il CEA oltre ad essere il marker più dosato, è ormai indice di riferimento per lo studio di altri marcatori. Si tratta di un antigene oncofetale (glicoproteina) con un peso molecolare di 200.000 D. La molecola del CEA è costituita per un terzo da una catena polipeptidica, il maggior determinante antigenico, mentre la parte residua è di natura carboidratica e varia in base all’istotipo tumorale da 1:1 a 1:5. Questo marker viene sintetizzato dalle cellule epiteliali colonnari del tubo digerente, passando in un secondo tempo nel lume intestinale. La concentrazione normale plasmatica del CEA varia da 0 a 2,5 – 3 ng/ml.
| Patologie correlate con incremento di CEA |
|
Ø un processo colestatico, indipendentemente dalla sua etiologia |
| Ø enfisema polmonare |
| Ø ipertrofia prostatica, |
| Ø patologie dell’apparato digerente, |
TPA (antigene polipeptidico tissutale)
E’ associato a tumore dello stomaco, del polmone, del colon, del retto e del pancreas. È considerato un indice di attiva proliferazione neoplastica, ma si rinviene anche in processi infiammatori acuti e cronici, nella cirrosi epatica e nell’epatite.
Il TPA, costituito da 4 gruppi proteici (A1, B1, B2, C), è presente in concentrazioni molto elevate nel tessuto placentare; la sua subunità B1 è stata evidenziata nel feto con maggiore concentrazione a livello di fegato, polmone, intestino, reni. Anche per questo marker patologie non neoplastiche possono determinarne un’innalzamento dei valori: infezioni (batteriche o virali), epatiti, malattie autoimmuni, quali il lupus, l’artrite reumatoide.
Come già detto, poichè è presente nel tessuto placentare ovviamente il TPA risulta elevato in corso di gravidanza. L’antigene polipeptidico tissutale, dosabile sia nel sangue che nelle urine, ha una buona sensibilità, mentre, così come il CEA, non è assolutamente specifico.
Catepsina D: Proteasi lisosomiale (endopeptidasi che prende parte ai processi di digestione e autolisi dei tessuti) identificata in differenti tessuti normali e patologici (in vitro), è coinvolta nei processi di invasione e metastatizzazione tumorale; in vivo, recentissime osservazioni cliniche sembrano correlare elevati livelli di tale enzima, nel citosol, con la prognosi del carcinoma mammario.
CA 19-5: Antigene circolante tumore associato, sembra essere particolarmente utile nel monitoraggio dei tumori gastro-enterici, poichè sembra più sensibile del CA 19-9.
FATTORI DI CRESCITA
TGF-alpha e beta (trasforming growth factor-alpha e beta): stimolano la crescita neoplastica; al contrario l’EGF (epidermal growth factor) ed altri fattori ad esso correlati inibiscono la crescita di molte cellule epiteliali. Anche ad altri fattori di crescita, dei monociti/macrofagi (M-CSF) o dei fibroblasti viene riconosciuta un’azione mitogena. L’attività di questi fattori di crescita è mediata da recettori specifici.
I recettori per altri fattori di crescita trovati sulle cellule di carcinoma ovarico sono prodotti del gene c-erbB-2, a questi si lega anche il IL1 (Insuline Like Growth Factor 1).
IL 6: E’ un fattore sia di crescita che di differenzazione e sembra svolgere un ruolo nello sviluppo e nella progressione del carcinoma ovarico.
La determinazione dei marcatori tumorali è soggetta ad errori sia preanalitici che analitici, sistematici o causali. Pertanto è necessaria un’adeguata standardizzazione del campionamento ed un’informazione completa sulle condizioni della p/te al momento del prelievo (stato di malattia, terapia in corso o recente, iperbilirubinemia, iperlipemia, ecc.). In generale i cut-off di normalità dei valori soglia in soggetti sani corrispondono a 95° percentili, ma il valore assoluto della soglia ha di solito scarso significato, mentre la probabilità di rischio di malattia ovviamente aumenta con il valore di concentrazione del marcatore.
E’ importante la valutazione seriata del marcatore che consente di esprimere un giudizio sulla base delle variazioni del valore delle concentrazioni del marcatore e quindi di effettuare il monitoraggio della malattia neoplastica (risposta al trattamento e diagnosi di ripresa della malattia durante il follow-up). I marcatori non dovrebbero essere adoperati per lo screening di massa, poichè nessun marker tumorale ha le caratteristiche di efficienza diagnostica tale da poter essere utilizzato per una popolazione asintomatica. Fanno eccezione particolari gruppi a rischio: neoplasia prostatica e PSA (Antigene specifico prostatico), carcinoma midollare della tiroide e calcitonina.
In questi casi i marcatori hanno specificità tissutale ed il potere predittivo del marker viene innalzato aumentandone il valore soglia.
Una volta diagnosticata la malattia i markers servono innanzitutto per disporre di un valore di base prima di iniziare qualsiasi intervento terapeutico; Inoltre per ottenere informazioni indirette circa l’estensione della malattia neoplastica; per meglio definire l’istotipo (per esempio nel caso di metastasi con neo-plasia primitiva sconosciuta); per desumere indicazioni prognostiche.
Nella malattia avanzata il marker serve soltanto per valutare dinamicamente la risposta alla malattia.
Nel caso di sospetto di malattia residua dopo intervento chirurgico radicale, conoscendo i tempi di dimezzamento di alcuni markers, ad esempio la AFP e HCG (per i tumopri germinali), e dell’elevata specificità di altri (PSA per il carcinoma prostatico), la persistenza di valori misurabili à da considerare indice attendibile di malattia residua.
Valori elevati di markers con limitata specificità, dopo intervento chirurgico radicale, permettono d’altronde di ipotizzare una prognosi sfavorevole.
Nelle pazienti in trattamento con farmaci antiblastici si assiste generalmente ad un progressivo e costante decremento dei valori basali. Nel primo o primi cicli di polichemioterapia antiblastica è però possibile che si verifichino brusche impennate dei valori di concentrazione dei markers, dovute in tal caso a citolisi da necrosi cellulare. Questi picchi hanno in realtà durata limitata. Al contrario incremento di concentrazione dei markers in successivi cicli di terapia depone per una ripresa della proliferazione neoplastica.
|
Ematochimica valida per lo studio delle neoplasie |
|
| Fosfatasi alcalina | VES |
| Latticodeidrogenasi | Gamma-Glutamiltransferasi |
| GTO/GTP | Albumina sierica |
| Proteine M | Ferritina acida e basica |
| Attivatori del Plasminogeno | Proteine della gravidanza |
| Componente secretrice di monoglob. A | |
| Proteine placentari | |
| Amilasi | Fosfatasi alcalina placent. |
| Linfociti T8 e T9 | Calcitonina |
Conclusione: la conclusione è semplice: il dosaggio dei marcatori non deve essere fatto in ambito diagnostico, se non come orientamento a largo raggio e sempre associata ad indagini specifiche come USG, TAC, RMN, ISC, LPS. I marcatori possono essere utili semmai per verificare l’efficacia delle terapie intraprese e monitorare l’evoluzione della malattia, ma mai come come presidio diagnostico unico.
Bibliografia:
- Van Calster, Discrimination between benign and malignant adnexal masses by specialist ultrasound examination versus serum CA 125. J Natl Cancer Inst, 2007
- Timmerman: Inclusion of CA 125 does not improve mathematical models developed to distiguish between benign and malignant adnexal tumors J Clin Oncol, 2007
- Valentin, Adding a single CA 125 measurement to US performed by an experienced examiner doesnot improve preoperative discrimination between benign and malignant adnexal masses UOG , 2009
- Einhorn N, Knapp RC, Bast RC, Zurawski VR Jr. CA 125 assay used in conjunction with CA 15-3 and TAG-72 assays for discrimination between malignant and non-malignant diseases of the ovary. Acta Oncol 1989;28:655-7.
- Niloff JM, Bast RC Jr, Schaetzl E, Knapp RC. Predictive value of CA 125 antigen levels at second-look procedures in ovarian cancer. AM J OBSTET GYNECOL 1985;151:981-6.
- Lehtovirta P, apter D, Stenman U-H. Livelli sierici di CA 125 durante il ciclo mestruale. Br J Ostet gynecol 97:930-933, 1990.

