L’elettrochemioterapia (ECT) è un trattamento locoregionale per la cura dei tumori, indicato soprattutto le lesioni epiteliali malpighiani ad alta cheratinizzazione, carcinoma squamocellulare della testa e del collo, basalioma, melanoma, sarcoma di Kaposi e metastasi cutanee di carcinomi. Nella maggior parte dei casi, l’ECT viene effettuata in Day-Hospital.
L’ECT combina una bassa dose di un farmaco chemioterapico con brevi impulsi elettrici ad elevata frequenza applicati direttamente sul tessuto tumorale. Gli elettrodi utilizzati sono di 3 tipi: a forma di lamelle (per tumori superficiali di piccole dimensioni), aghi lineari (per noduli sottocutanei di piccole dimensioni) o aghi esagonali (in caso di noduli superficiali >1 cm).
Gli impulsi elettrici (8 impulsi con ampiezza di 1.000-1300 V/cm e frequenza di 1-5.000 Hz per ogni coppia di aghi, della durata di 100 μs) determinano la formazione di pori (elettroporazione) nella membrana delle cellule tumorali con lo scopo di agevolano la penetrazione intracellulare di farmaci citotossici (bleomicina o cisplatino) che altrimenti avrebbero difficoltà a penetrarvi.
L’elettrochemioterapia con infusione di Bleomicina per endovena prevede l’elettroporazione 8-30 minuti dopo la somministrazione della bleomicina; lasso di tempo in cui è massima la concentrazione del farmaco nel sangue. Se la bleomicina è iniettata direttamente nel nodulo carcinomatoso l’elettroporazione sarà effettuata nei 10 minuti successivi. 
(a) dopo l’iniezione il farmaco circonda la cellula tumorale; (b) all’erogazione degli impulsi elettrici si formano dei pori sulla membrana cellulare che agevolano l’entrata del farmaco; (c) la membrana cellulare si ricompatta intrappolando il farmaco all’interno della cellula; (d) il farmaco causa danni irreversibili alle cellule tumorali che muoiono.
La Bleomicina (Bleoprim® fl 15 mg, Bleomicina TEVA fl 10 ml 15.000 UI) ha trovato nuova applicazione in medicina con la scoperta dell’elettroporazione e della sua applicazione clinica; infatti, la capacità di essere poco permeante, ma al contempo altamente citotossica, ha portato questo antibiotico ad essere rivalutato nell’utilizzo come chemioterapico.
Vantaggi ECT – ottenuti dall’utilizzo di questo farmaco in ECT sono:
– aumento della citotossicità intrinseca di circa 300 volte [19];
– miglioramento nella capacità delle molecole di Bleomicina di oltrepassare la membrana plasmatica delle cellule tumorali elettroporate. La formazione dei pori nella membrana plasmatica permette infatti una libera diffusione del farmaco nella cellula;
– vantaggio di sottoporre i pazienti a meno sedute di terapia per garantire l’efficacia della cura (in molti casi è sufficiente una solavseduta di ECT per raggiungere la completa regressione del tumore);
– scomparsa quasi totale della tossicità del farmaco a livello sistemico e una consistente riduzione degli effetti collaterali cutanei.
Tutti questi vantaggi sono dovuti all’effetto dell’elettroporazione sulle cellule tumorali. Questo fenomeno infatti permette il passaggio delle molecole all’interno della cellula grazie alla formazione di pori sulla membrana con conseguente aumento della citotossicità. Inoltre, mediante l’induzione dell’effetto di vasocostrizione, impedisce al farmaco di essere disperso per via sistemica.
Svantaggi ECT – Tuttavia, l’utilizzo della Bleomicina in ECT rispetto a quello in chemioterapia classica ha anche degli svantaggi:
– Manifestazioni cutanee nel sito di applicazione degli elettrodi, dovute oltre che al farmaco anche agli impulsi elettrici. La patologia che si osserva con maggiore frequenza è la dermatite flagellata il cui meccanismo patogenetico è in parte ancora sconosciuto, spesso associata a pigmentazione ungueale (melanonichia). La dermatite flagella può evolvere in eruzioni cutanee tossiche
– Possibilità di intervento solo su alcuni tipi di tumore;
– Nel caso di trattamenti ripetuti, possibilità di incorrere in un accumulo eccessivo di farmaco nel paziente con conseguente reazione dell’organismo alla tossicità;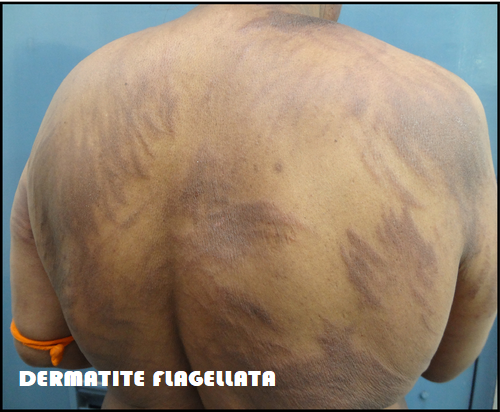
– Esclusione dalla terapia ECT dei pazienti portatori di pacemaker a causa della pericolosità del campo elettrico applicato soprattutto per le lesioni .situate a livello del torace.
— Particolare cautela nei pazienti con insufficienza respiratoria e renale (clearance della creatinina <50 mL/min), soprattutto se di età >70 anni.
Posologia: la Bleomicina è somministrata per endovena alla dose di 15.000 UI/m² mentre per via intratumorale si utilizzano 250-1.000 UI/cm3 . L’unità internazionale UI è l’unità di misura più utilizzata ed indica la quantità di sostanza necessaria a produrre un determinato effetto riconosciuto a livello internazionale. Le UI sono state introdotte per unificare i valori di unità U a livello mondiale. Il valore in mg si riferisce all’attività in mg e non al peso del principio attivo del farmaco (Bleomicina solfato). Nel caso della Bleomicina, 1 mg di sostanza secca equivale a 1500-2000 UI. Si noti che la conversione è strettamente legata all’attività del principio attivo e quindi non uniformabile anche ad altre sostanze
**********************************************************
L’elettrochemioterapia con Cisplatino (Cisplatino Pfizer® fl 10 ml 10 mg, 50 ml 50 mg 100 ml 100 mg, Cisplatino Teva® fl ev 100 ml 100 mg, Citoplatino®, Platamine®, Platinex®, Pronto Platamine®) può essere somministrata, come per la bleomicina, in due diversi modi:
– Per via endovenosa: 0,5-2 mg/cm3 del tumore
– Per via intratumorale.
L’infusione endovenosa del farmaco viene utilizzata raramente in ECT, in
quanto prevede un dosaggio simile a quello usato in chemioterapia classica, con una differenza non sostanziale di citotossicità con effetti collaterali maggiori rispetto alla somministrazione intratumorale.
La somministrazione per via intratumorale, invece, è più comune nel trattamento con elettrochemioterapia e necessita di dosi differenti in base alle dimensioni del tumore da trattare (0,5 mg/cm³). L’applicazione del treno di impulsi elettrici per elettroporare le cellule e favorire l’ingresso del farmaco inizia circa 10 minuti dopo l’infusione di Cisplatino seguendo una procedura uguale a quella dell’ECT con Bleomicina.
Anche nel caso di elettrochemioterapia con somministrazione di Cisplatino, si riscontra l’effetto di vasocostrizione temporanea dovuta all’applicazione degli impulsi elettrici.
Effetti collaterali negativi: mielodepressione (leucopenia, trombocitopenia, anemia), disturbi gastrointestinali (anoressia, nausea, vomito e diarrea), compromissione dell’udito, alterazioni renali (insufficienza renale, nefrotossicità, iperuricemia) e febbre.
********************************************
Differenze e analogie del trattamento di ECT con Bleomicina o con Cisplatino
La bleomicina ha assunto un ruolo da protagonista in questo tipo di trattamento. In particolare, la preferenza di utilizzo della Bleomicina
rispetto al Cisplatino è dovuta a:
– Elevata efficacia della Bleomicina sia se somministrata per via endovenosa sia intratumorale, mentre il Cisplatino somministrato per
via endovenosa non ha ottenuto risultati soddisfacenti;
– Dimostrato aumento della citotossicità intrinseca maggiore per la Bleomicina che per il Cisplatino;
– Favorevole profilo di tossicità del farmaco sulle patologie trattabili con ECT;
– Maggiore efficacia rispetto al Cisplatino nell’utilizzo in pazienti che presentano un numero elevato di noduli cancerosi.
La scelta di utilizzare l’elettrochemioterapia con Cisplatino, anche se lievemente meno efficace di quella con Bleomicina, risulta essere conveniente come alternativa nei trattamenti ripetuti. La ripetizione di più trattamenti di ECT con somministrazione di Bleomicina potrebbe causare, infatti, un accumulo eccessivo di farmaco nel paziente, che potrebbe a sua volta comportare la manifestazione di effetti collaterali sistemici dose-dipendenti.
Via di somministrazione – La scelta della via di somministrazione del farmaco avviene valutando prima di tutto il numero e la dimensione dei noduli da trattare:
– Numero di noduli <5 e diametro <2cm: utilizzo di Bleomicina o di Cisplatino con iniezione intralesionale;
– Numero di noduli <5 e diametro >2cm: trattamento con Bleomicina somministrata per endovena;
– Numero di noduli >5: infusione di Bleomicina per via endovenosa.
References:
- J. C. Weaver e Y. A. Chizmadzhev, «Theory of electroporation: A review», Bioelectrochemistry and Bioenergetics, vol. 41, n°. 2, pagg. 135-160, Dic 1996.
- L. M. Mir, «Therapeutic perspectives of in vivo cell electropermeabilization», Bioelectrochemistry (Amsterdam, Netherlands), vol.53, n°. 1, pagg. 1-10, Gen 2001
- G. Sersa, D. Miklavcic, M. Cemazar, Z. Rudolf, G. Pucihar, e M. Snoj, «Electrochemotherapy in treatment of tumours», European Journal of
Surgical Oncology (EJSO), vol. 34, n°. 2, pagg. 232-240, Feb 2008. - M. L.M., «Bases and rationale of the electrochemotherapy». European Journal of Cancer Supplements, vol. 4, n°. 11, pagg. 38-44, Nov 2006.
- Breton M., Mir LM., «Microsecond and Nanosecond Electric Pulses
in Cancer Treatments», BEMS, 2011. - L. M. Mir et al., «Standard operating procedures of the electrochemotherapy: Instructions for the use of bleomycin or cisplatin
administered either systemically or locally and electric pulses delivered by the CliniporatorTM by means of invasive or non-invasive electrodes», European Journal of Cancer Supplements, vol. 4, n°. 11, pagg. 14-25, Nov 2006. - L. G. Campana et al., «Bleomycin-based electrochemotherapy: clinical outcome from a single institution’s experience with 52 patients», Annals
of Surgical Oncology, vol. 16, n°. 1, pagg. 191-199, Gen 2009. - M. Marty et al., «Electrochemotherapy – An easy, highly effective and safe treatment of cutaneous and subcutaneous metastases: Results of
ESOPE (European Standard Operating Procedures of Electrochemotherapy) study», European Journal of Cancer Supplements, vol. 4, n°. 11, pagg. 3-13, Nov 2006. - A. Gothelf, L. M. Mir, e J. Gehl, «Electrochemotherapy: results of cancer treatment using enhanced delivery of bleomycin by electroporation». Cancer Treatment Reviews, vol. 29, n°. 5, pagg. 371-387, Ott 2003.
- S. Gregor, «The state-of-the-art of electrochemotherapy before the ESOPE study; advantages and clinical uses», European Journal of Cancer Supplements, vol. 4, n°. 11, pagg. 52-59, Nov 2006.
- J. Gehl e P. F. Geertsen, «Efficient palliation of haemorrhaging malignant melanoma skin metastases by electrochemotherapy», Melanoma Research, vol. 10, n°. 6, pagg. 585-589, Dic 2000.
- M. P. Rols, J. M. Bachaud, P. Giraud, C. Chevreau, H. Roché, e J. Teissié, «Electrochemotherapy of cutaneous metastases in malignant
melanoma», Melanoma Research, vol. 10, n°. 5, pagg. 468-474, Ott 2000 - C. Fumanti et al., «Elettrochemioterapia (ECT) nei tumori testa e
collo: un’alternativa ai trattamenti convenzionali nelle forme avanzate», Bollettino della Società Medico Chirurgica di Pavia, vol. 124, n°. 2, pagg. 245-248, Mag 2011.




