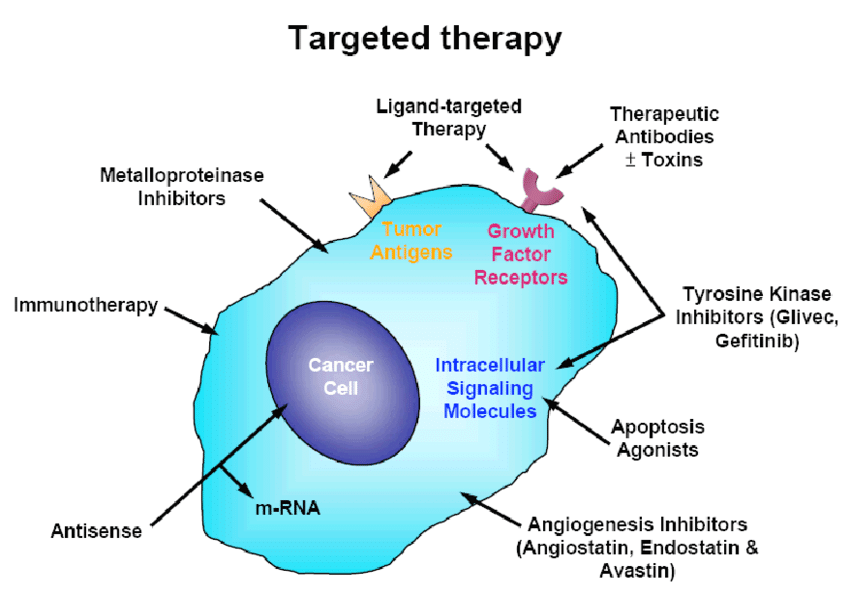
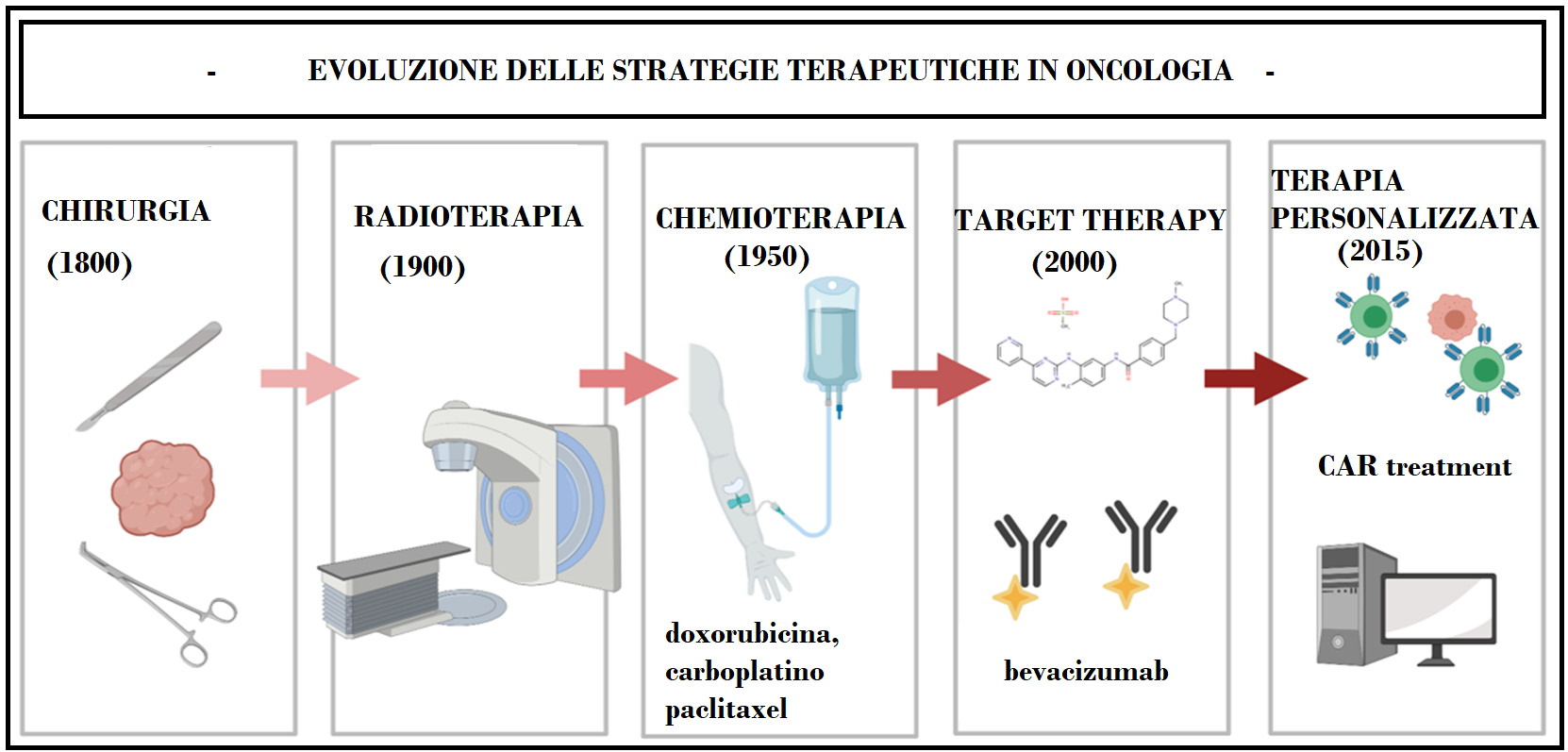
La target therapy è una delle più recenti applicazioni terapeutiche in oncologia risalendo al 2000 circa il suo inizio con la sintesi dell’imatinib nel 1998. A differenza dell’approccio della chemioterapia classica, che agisce su meccanismi aspecifici legati a caratteristiche proprie di tutte le cellule a rapida proliferazione, comprese quelle normali, la terapia mirata interviene sui meccanismi oncogeni propri delle cellule neoplastiche (1-3).
 La terapia biologica tende a identificare e colpire in modo selettivo le alterazioni biomolecolari a carico delle cellule tumorali differenziandosi in inibitori enzimatici, attivatori immunologici, antiangiogenetici, etc. (4-6)).
La terapia biologica tende a identificare e colpire in modo selettivo le alterazioni biomolecolari a carico delle cellule tumorali differenziandosi in inibitori enzimatici, attivatori immunologici, antiangiogenetici, etc. (4-6)).
FARMACI TARGET
A) Piccole molecole: molecole con un p. m. <900 Daltons, riescono a legarsi a specifiche proteine intracellulari, quasi sempre protein-chinasi. Le piccole molecole interferiscono con l’azione di tali enzimi e quindi  interrompono i processi biochimici che, durante la cancerogenesi, sono alterati, inducendo la morte cellulare.
interrompono i processi biochimici che, durante la cancerogenesi, sono alterati, inducendo la morte cellulare.
Inoltre i farmaci a piccole cellule, come il bortezomib (Velcade®), possono legarsi ai proteosomi, a chinasi ciclina-dipendenti (CDK) e agli inibitori della poli ADP- ribosio polimerasi (PARP) al fine di attivare i checkpoints del ciclo cellulare, favorire l’apoptosi e la riparazione del DNA (1,2). Il bortezomib, in monoterapia o in associazione con doxorubicina liposomiale pegilata o desametasone, è utilizzato soprattutto per la terapia di linfoma e mieloma multiplo.
Gli inibitori enzimatici di piccole molecole sono interessanti per la loro specificità, facilità di produzione, prevedibilità e facilità di somministrazione.
B) Anticorpi monoclonali (mABs): Anticorpi sintetizzati in laboratorio e “disegnati” per legare in maniera selettiva un singolo
bersaglio. Essendo molecole ad alto peso molecolare, i loro bersagli si trovano, nella maggior parte dei casi, sulla membrana delle cellule tumorali.
- Il Trastuzumab (Herceptin®) e Cetuximab si legano al recettore del fattore di crescita dell’epidermide (EGFR) impedendo la replicazione delle cellule cancerose.
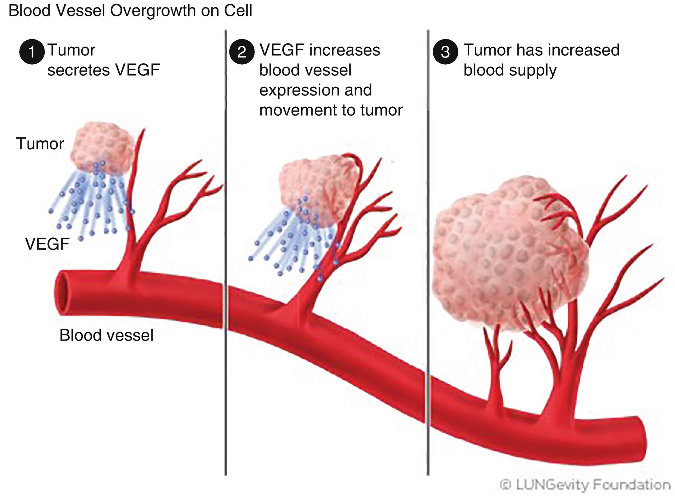
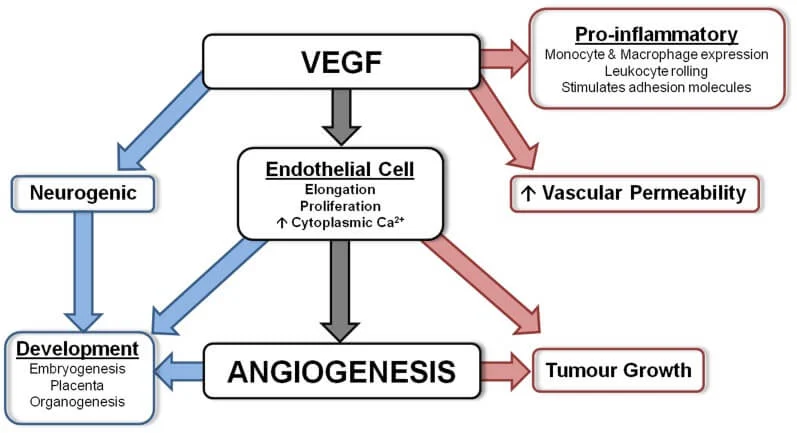
- Bevacizumab (Avastin® 25 mg/ml fl ev): utilizzato in associazione e con successo in molti schemi di chemioterapia. Il bevacizumab si lega in modo selettivo a una proteina chiamata “fattore di crescita per l’endotelio vascolare umano” (Vascular Endothelial Growth Factor, VEGF), che è presente sul rivestimento dei vasi sanguigni e linfatici dell’organismo e ne impedisce l’azione. In tal modo viene bloccata la neoangiogenesi tipica ed essenziale per la crescita delle masse neoplastiche.
Principali effetti collaterali degli anticorpi monoclonali:
- mielodepressione
- nausea, vomito, diarrea
L’utilizzo di bevacizumab è indicato per il trattamento di:
- Carcinoma avanzato del colon-retto, di solito, in associazione a fluoropirimidine, come – ad esempio – il 5-fluorouracile;
- Carcinoma avanzato della mammella, in genere, in associazione a paclitaxel e capecitabina;
- Carcinoma polmonare non a piccole cellule avanzato, di solito, in associazione a una chemioterapia a base di derivati del platino;
- Carcinoma avanzato del rene, generalmente, in associazione a interferone;
- Carcinoma ovarico epiteliale, carcinoma delle tube di falloppio e carcinoma peritoneale primario in fase avanzata, generalmente, in associazione a carboplatino e paclitaxel;
- Carcinoma della cervice persistente, ricorrente o metastatico, di solito, in associazione a paclitaxel e cisplatino.
********************************************
I checkpoint immunitari sono regolatori di processi chiave del sistema immunitario. Queste molecole rappresentano i modulatori delle vie di segnalazione responsabili della tolleranza immunologica, un concetto che previene la distruzione di cellule “self” da parte del sistema immunitario (9-51).
E) CAR T, acromimo di Car-T cells, Chimeric Antigens Receptor Cells-T – Nel campo delle terapie mirate, CAR T ha forse ricevuto la maggiore attenzione negli ultimi tempi. CAR T implica l’isolamento delle cellule T killer dal sangue di un paziente mediante leucaferesi rimettendo in circolo i restanti elementi ematici. Le cellule T estratte sono congelate ed inviate al laboratorio dove sono sottoposte ad un trattamento di ingegneria genetica. Utilizzando un virus inattivato (vettore virale), viene aggiunto al DNA dei linfociti T un gene ricombinante che permette di esprimere sulla superficie dei linfociti T una proteina, nota come Recettore dell’Antigene Chimerico (CAR) che riconosce un antigene specifico del cancro. Quindi i linfociti T modificati vengono moltiplicati, congelati e di nuovo inviate in reparto per la loro reintegrazione nel paziente. 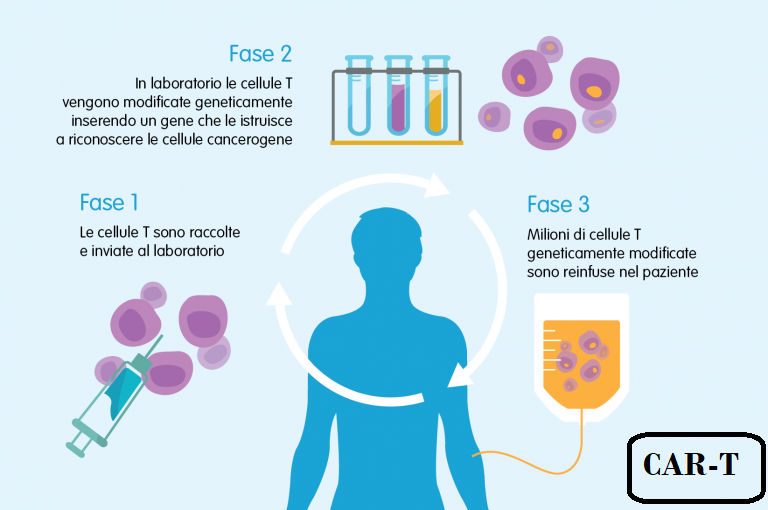
Chemioterapia pre-trattamento linfodepletiva con ciclofosfamide e fludarabina): prima dell’infusione, il paziente è sottoposto a una chemioterapia di preparazione con l’obiettivo di ridurre il numero dei linfociti circolanti; ciò permette ai linfociti T modificati di espandersi e attivarsi nell’organismo.
Le terapie CAR-T rappresentano la prima forma di terapia genica approvata per il trattamento della leucemia linfoblastica B e di alcune forme aggressive di linfoma non-Hodgkin. Le terapie CART che hanno ottenuto l’Autorizzazione all’Immissione in Commercio (AIC) nell’Unione Europea sono:
• Kymriah® (tisagenlecleucel), autorizzato il 22 agosto 2018
• Yescarta® (axicabtagene ciloleucel), autorizzato il 23 agosto 2018
e sono indicate per il trattamento di:
pazienti pediatrici e giovani adulti fino a 25 anni di età affetti da leucemia linfoblastica acuta a cellule B che non abbiano mai risposto alla chemioterapia, o che siano in recidiva dopo trapianto di cellule staminali emopoietiche allogeniche o dopo almeno 2 linee di chemioterapia (Kymriah);
pazienti con linfoma diffuso a grandi cellule B o DLBCL (Kymriah e Yescarta) / linfoma primitivo del mediastino a cellule B o PMBCL (Yescarta) già sottoposti ad almeno 2 linee di terapia sistemica.
Le CAR-T rappresentano per queste malattie linfoproliferative un’ulteriore opzione terapeutica, e sono state studiate in pazienti nei quali le precedenti strategie standard (chemioterapia e trapianto di cellule staminali emopoietiche) non si sono dimostrate efficaci.
Attualmente, i pazienti pediatrici con leucemia linfoblastica acuta a cellule B (B-ALL) trattati in prima linea con protocolli polichemioterapici hanno probabilità di guarigione anche superiori
all’85% e circa il 60-70% dei pazienti con linfoma non Hodgkin di tipo DLBCL o PMBCL può ottenere un controllo di malattia a lungo termine (o la guarigione) con gli attuali protocolli immunochemioterapici di prima linea, seguiti o meno da radioterapia. La terapia standard di
seconda linea è in entrambi i casi basata sulla possibilità di accesso al trapianto di cellule staminali emopoietiche (da un donatore compatibile nel caso della leucemia, dallo stesso paziente nel caso
dei linfomi) in seguito a risposta ad una chemioterapia di salvataggio.
Per questo motivo, le terapie CAR-T sono indicate per pazienti che non abbiano mai risposto alla chemioterapia o che siano in recidiva dopo trapianto di cellule staminali emopoietiche o dopo almeno 2 linee di chemioterapia (sono quindi terapie “di terza linea”). A causa delle reazioni avverse – anche gravi – che possono verificarsi con la terapia con CAR-T. Fra gli effetti collaterali negativi ricordiamo:
- sindrome da rilascio di citochine (CRS): la CRS è caratterizzata dalla possibile comparsa di febbre, ipotensione arteriosa, tachicardia, ipossia ed è dovuta all’intensa risposta infiammatoria che si sviluppa in seguito all’attivazione delle cellule CAR-T nell’organismo con rilascio di citochine infiammatorie. È stata osservata in una percentuale variabile tra il 58% e il 93% dei pazienti e, nella maggior parte dei casi, si manifesta entro 7-14 giorni dalla somministrazione della terapia. Il 12-47% dei pazienti ha presentato una CRS grave, che in alcuni casi ha richiesto il ricovero in terapia intensiva, e in rari casi è risultata fatale. In caso di CRS grave sono somministrati farmaci specifici per ridurre i livelli di sostanze infiammatorie in circolo (tocilizumab, cortisonici, idrossiclorochina);
- Altro problema è elevatissimo costo della terapia ($475.000 il trattamento della Novartis, $373.000 quello della Gilead) che ne limita tantissimo l’applicazione clinica su larga scala. In Italia è stato raggiunto l’accordo per la rimborsabilità di tisagenlecleucel da parte del Servizio Sanitario Nazionale (SSN) per entrambe le indicazioni autorizzate, e quindi sia per il trattamento di pazienti pediatrici e giovani adulti fino a 25 anni di età affetti da leucemia linfoblastica acuta a cellule B che non abbiano mai risposto alla chemioterapia, o che siano in recidiva dopo trapianto di cellule staminali emopoietiche allogeniche o dopo almeno 2 linee di chemioterapia, sia per i pazienti con linfoma diffuso a grandi cellule B o DLBCL già sottoposti ad almeno 2 linee di terapia sistemica.
- riduzione dei linfociti B e degli anticorpi (ipogammaglobulinemia): l’utilizzo delle terapie CAR-T comporta, insieme alle cellule tumorali, anche la distruzione dei linfociti B (cellule del sistema immunitario responsabili della produzione di anticorpi), con riduzione del livello di anticorpi nel sangue riscontrabile nel 14-47% dei pazienti trattati. In alcuni casi, per raggiungere una concentrazione normale di anticorpi e ridurre il rischio infettivo, è stato necessario sottoporre i pazienti a infusioni periodiche di immunoglobuline umane (anticorpi);
- reazioni avverse neurologiche: le più comuni osservate sono grave alterazione dello stato di coscienza (encefalopatia), tremore, incapacità di esprimersi o di comprendere informazioni scritte o verbali (afasia), delirio. Nella maggior parte dei casi si presentano entro le 8 settimane successive alla somministrazione della terapia CAR-T, in una percentuale variabile tra il 21% e il 65% dei pazienti. La durata media di queste alterazioni è stata di 14 giorni, con scomparsa completa dei sintomi nel 98% dei pazienti. Il 13-31% dei pazienti ha presentato reazioni avverse neurologiche gravi, potenzialmente letali.
La terapia CAR T di ultima generazione è particolarmente eccitante perché bypassa la necessità di una corretta presentazione dell’antigene MHC all’interno delle cellule tumorali, che è spesso difettosa nelle cellule tumorali a causa della mutazione.
- F) Vaccini: stimolano una risposta immuno-mediata nei confronti del tumore a seguito del loro legame con antigeni tumorali. Si dividono in paziente-specifici (ricavati dalle cellule tumorali del paziente) e non paziente-specifici (inducono una risposta immunitaria generale contro il tumore).
G) Terapia genica: si propone di introdurre materiale genetico (DNA o RNA) nelle cellule cancerose per indurne l’apoptosi o per inibirne la moltiplicazione. Ciò si mette in pratica ripristinando i geni onco-soppressori, introducendo siRNA o oligonucleotidi antisenso per stimolare la risposta immunitaria e inibendo i processi angiogenetici associati alla crescita tumorale. Tutto ciò è possibile attraverso tecniche di “gene-editing” tra cui la più recente ed efficace è la “Clustered Regularly Interspaced Palindromic Repeats” (CRISPR) o “CRISPR associated nucleased 9 (CRISPR-Cas9)”.
L’avvento della terapia mirata ha portato un notevole successo clinico e una significativa riduzione degli effetti collaterali nel trattamento di diversi tipi di tumore tra cui carcinoma mammario, ca. del colon-retto, ca. polmonare e ca. ovarico e alcune forme di leucemia.
La medicina personalizzata: l’utilizzo di “Big Data” (la combinazione di genetica del paziente, epigenetica, trascrittomica, proteomica, RNA-seq, ecc.), Terapia genica o screening farmacologico ad alto rendimento utilizzando biopsie del cancro specifiche del paziente, le cliniche possono prevedere, sviluppare e prescrivere regimi di trattamento “su misura” a livello individuale. Questo tipo di medicina personalizzata necessita di una messa a punto e di una maggiore convalida dell’efficacia, ma è estremamente promettente. Una migliore identificazione dei percorsi e dei marcatori specifici del cancro, lo sviluppo semplificato di inibitori di piccole molecole, un’efficace analisi dei dati dei pazienti e metodi di screening rapidi ad alto rendimento si dimostreranno tutti progressi preziosi nella marcia verso il trattamento del cancro specifico per il paziente.
References:
- Lee YT, et al. Molecular targeted therapy: Treating cancer with specificity. Eur J Pharmacol 2018 –Review.
- Kwak EL, Clark JW, Chabner B, Targeted agents: the rules of combination, in Clin Cancer Res, 13(18 Pt 1), American Association for Cancer Research, 15 sept 2007, pp. 5232-5237,
- Cognetti F, Felici A, Le nuove terapie mirate (PDF), Ministero della Salute, 2007.
- Hoelder S, Clarke PA, Workman P, Discovery of small molecule cancer drugs: successes, challenges and opportunities, in Mol Oncol, vol. 6, n. 2, Elsevier, aprile 2012, pp. 155-176,
- Oldham RK, Dillman RO, Monoclonal antibodies in cancer therapy: 25 years of progress, in J Clin Oncol, vol. 26, n. 11, American Society of Clinical Oncology, 10 aprile 2008, pp. 1774-1777,
- Wong AL, Lee SC, Mechanisms of Resistance to Trastuzumab and Novel Therapeutic Strategies in HER2-Positive Breast Cancer, in Int J Breast Cancer, vol. 2012, Hindawi Publishing Corporation, 2012, p. 415170,
- Saridaki Z, Georgoulias V, Souglakos J, Mechanisms of resistance to anti-EGFR monoclonal antibody treatment in metastatic colorectal cancer, in World J Gastroenterol, vol. 16, n. 10, Baishideng Publishing Group, 14 marzo 2013, pp. 1177-1187,
- Hurrell T, Outhoff K, Human epidermal growth factor receptor 2-positive breast cancer: which cytotoxic agent best complements trastuzumab’s efficacy in vitro?, in Onco Targets Ther, vol. 6, Dove Medical Press, 17 giugno 2013, pp. 693-701,