L’immunoterapia oncologica ormai dispone di numerosi presidi: citochine esogene, vaccini terapeutici, cellule effettrici tumore-specifiche. Più recentemente sono comparsi i modulatori dei checkpoint immunitari e agonisti della costimolazione dei recettori per superare i meccanismi immunosoppressivi indotti dalla neoplasia. Tutto ciò nella strategia terapeutica globale che vede da un lato la capacità del sistema immunitario di distruggere le cellule neoplastiche o corpi estranei riconosciuti come “non self” e dall’altro lato la capacità delle cellule cancerose di resistere o eludere il “controllo” del sistema immunitario.
Clinicamente è accertato che le persone con sistema immunitario compromesso sono destinate a sviluppare con maggior frequenza le malattie neoplastiche.
L’obiettivo dell’immunoterapia anti-cancro è quello di potenziare o ripristinare la capacità del sistema immunitario di rilevare e distruggere le cellule tumorali e “non self” superando i meccanismi con cui i tumori eludono e sopprimono la risposta immunitaria.

I checkpoint immunitari sono regolatori di processi chiave del sistema immunitario. Queste molecole rappresentano i modulatori delle vie di segnalazione responsabili della tolleranza immunologica che previene la distruzione di cellule “self” da parte del sistema immunitario. Essi sono responsabili del riconoscimento degli antigeni presentati dal complesso maggiore di istocompatibilità (MHC).
Un numero crescente di prove dimostra che un meccanismo primario attraverso il quale i tumori sfuggono al sistema immunitario è l’ingaggio ed alterazione di checkpoint immunitari.
La terapia del checkpoint ha rivoluzionato il trattamento del cancro, mettendo il corpo del paziente in condizione di combattere il tumore con le sue proprie armi.
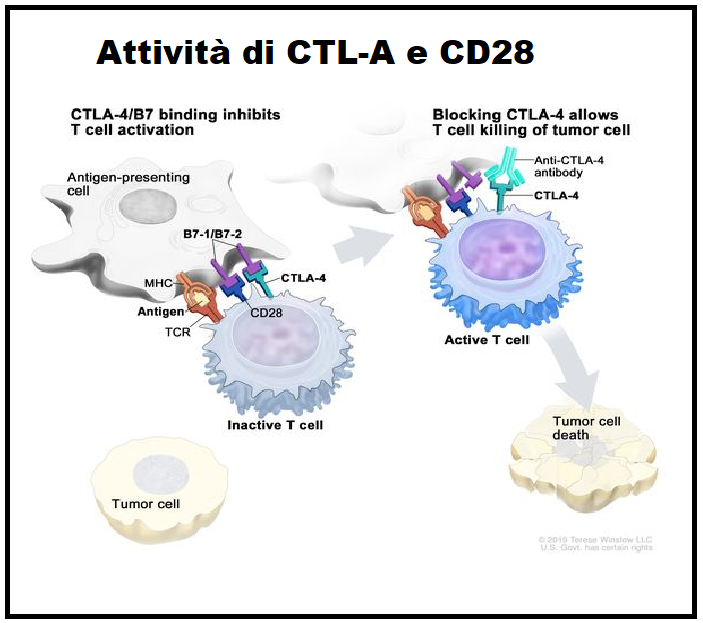
CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4) o CD152 – Il primo recettore checkpoint che è stato studiato e testato con successo come bersaglio di immunoterapia è CTLA-4, conosciuta anche come CD152, proteina appartenente alla superfamiglia delle Ig espressa sui linfociti T CD4+ e CD8+ attivati. La funzione primaria del CTLA- 4 è attivata in seguito al legame con i ligandi B7-1 e B7-2 presenti sulle cellule di presentazione (APCs) ed è quella di down-regolare l’estensione dell’attivazione dei linfociti T citotossici immaturi presenti ancora nei linfonodi contrastando il segnale co-stimolatorio erogato da CD28. Il gene responsabile della codifica del CTLA-4 si trova sul cromosoma 2 in esseri umani.
CD28 – è una glicoproteina dimerica transmembrana anch’essa facente parte della superfamiglia delle immunoglobuline. Questa molecola è espressa su quasi tutti i linfociti T CD4+ umani e su circa la metà dei linfociti T CD8+. La sua funzione consiste nello stimolare la crescita e proliferazione dei linfociti T citotossici e viene attivata dal legame con i due ligandi specifici CD80 e CD86 (detti anche B7-1 e B7-2) presenti sulle cellule di presentazione (APCs) costitute da linfociti B, cellule dendritiche e macrofagi.
PD-1 – “Programmed Death 1 (PD-1)” o “Morte programmata 1”: è un recettore co-inibitore nella famiglia CD28/ TL-4 e funziona come un regolatore negativo del sistema immunitario. L’interazione tra il PD1 e i suoi ligandi PD-L1 e PD-L2, sopprime la risposta immunitaria contro gli antigeni del proprio corpo “self cells” chiamata autoimmunità. Rispetto al CTLA-4 agisce più tardi, e inibisce i linfociti-T iperattivi in ogni parte del corpo. Tumori molto aggressivi come il melanoma esprimono PD-L1 sulla loro superficie e in questo modo riescono adingannare il nostro sistema immunitario disattivando i linfociti-T. Di recente sono stati sviluppati nuovi trattamenti antitumorali che riescono a riaccendere la risposta immunitaria contro queste cellule cancerose bloccando le interazioni tra PD-1 e PD-L1, e così ripristinando la funzione dei linfociti-T. (36-38).
A) CHECKPOINT IMMUNITARI STIMOLATORI
A1) Checkpoint immunitari stimolatori della famiglia TNF-R:
- CD27 – Questa molecola è vitale per la generazione delle cellule T della memoria; supporta l’espansione antigene-dipendente delle cellule T naïve. CD27 è inoltre un marcatore delle cellule B della memoria. L’attività di CD27 è governata dalla disponibilità temporanea del suo ligando, CD70, presente sui linfociti e sulle cellule dendritiche. La co-stimolazione di CD27 sopprime la funzione effettrice dei linfociti Th17. Attualmente è in fase di formulazione la molecola CDX-1127, un agonista che funge da anticorpo monoclonale anti-CD27, efficace al momento in modelli animali.
- CD40 – Questa molecola, presente su una varietà di cellule del sistema immunitario (incluse le cellule presentanti l’antigene) riconosce il suo ligando CD40L, conosciuto altrimenti come CD154 ed è temporaneamente espressa sulla superficie dei linfociti T CD4+ T attivati, come il suo ligando. La via di segnalazione mediata da CD40 permette alle cellule dendritiche di maturare e dunque di scatenare a valle l’attivazione e la differenziazione dei linfociti T. Attualmente è stato formulato un anticorpo monoclonale anti-CD40, adesso posseduto da una società svizzera.
- OX40 – Questa molecola, anche denominata CD134, ha come ligando OX40L/CD252. Come CD27, OX40 promuove l’espansione dei linfociti T effettori e della memoria; ad ogni modo, è anche conosciuto come inibitore della differenziazione e della funzione dei linfociti T regolatori (ad esempio inibendo la loro produzione di citochine) OX40 è temporaneamente espresso in seguito all’acquisizione del TCR (Recettore dei linfociti T) ed è qui che risiede il suo valore come bersaglio terapeutico: può essere up-regolato nella maggior parte dei linfociti T presenti in lesioni infiammatorie recentemente attivati (da antigeni). Si è dimostrato che gli anticorpi monoclonali anti-OX40 hanno un’utilità clinica in tumori allo stadio avanzato Attualmente sono in fase di elaborazione tre farmaci che interagiscono con OX40: MEDI0562 un agonista umano per OX40; MEDI6469, un agonista murino per OX4; MEDI6383, un agonista di OX40
- GITR – “Glucocorticoid-Induced TNFR family Related gene”, “gene correlato alla famiglia del TNFR indotto dai glucocorticoidi”; stimola l’espansione dei linfociti T, inclusi i Treg. Il ligando di GITR è espresso principalmente sulle cellule dendritiche (cellule presentanti l’antigene). Gli anticorpi anti-GITR sembrano promuovere una risposta anti-tumorale attraverso la perdita della stabilità cellulare del lignaggio dei Treg
A2) Checkpoint immunitari stimolatori della superfamiglia ICOS – “Inducible T-cell costimulator”, “Costimolatore inducibile dei linfociti T”, detta anche CD278, è espressa dai linfociti T attivati. Il suo ligando è ICOSL, espresso principalmente sui linfociti B e sulle cellule dendritiche. Questa molecola sembra essere importante nella funzione effettrice dei linfociti T.
A3) Checkpoint immunitari stimolatori della superfamiglia B7-CD28 – CD28 è stato il bersaglio del “superantagonista” TGN1412 che causava diverse reazioni infiammatorie nei primi studi clinici effettuati a Londra, Marzo 2006.
A4) Altri Checkpoint immunitari stimolatori –
- CD137 – Detta anche 4-1BB; quando interagisce col suo ligando, stimola la proliferazione dei linfociti T. La via di segnalazione mediata da CD137 inibisce la morte cellulare programmata dei linfociti T, in particolar modo i linfociti T CD8+ T. Al 2018 è disponibile un farmaco (lipocalina) bi-specifica per CD137 e HER2.
- CD122 – Questa molecola rappresenta la sub-unità beta del recettore dell’IL2 (Interleuchina 2); questo recettore aumenta i tassi di proliferazione dei linfociti T CD8+. Attualmente è in fase di sperimentazione una citochina stimolatoria basata sulla struttura di CD122, detta NKTR-214. Attualmente lo studio è in Fase 1 e i risultati sono stati annunciati nel 2016, Novembre.
B) CHECKPOINT IMMUNITARI INIBITORI: I checkpoint inibitori sono anticorpi che si legano a CTLA-4 e bloccano il suo segnale immunosoppressivo. Di conseguenza, le cellule T attivate, incluse quelle attivate dagli antigeni tumorali, possono continuare a proliferare, produrre citochine ed esercitare le loro funzioni effettrici citotossiche nel microambiente tumorale.
- A2AR – “Adenosine A2A receptor”, “Recettore A2A dell’adenosina”; è un checkpoint immunitario considerato molteplici volte nella onco-immunologia a causa della presenza di adenosina nel microambiente immunitario. L’adenosina si lega ad A2AR e ciò scatena un meccanismo a retroazione negativa (feedback negativo) che sopprime la risposta immunitaria. Il microambiente tumorale, difatti, possiede concentrazioni relativamente alte di adenosina.
- B7-H3 – detto anche CD276, venne originariamente definito come “molecola co-stimolatoria” della risposta immunitaria; al giorno d’oggi è invece definito come “co-inibitore” della risposta immunitaria. Al 2018 è in fase di sperimentazione un anticorpo monoclonale (detto MGA271) che possiede un frammento Fc ottimizzato per il legame con B7-H3. I recettori di B7-H3 non sono stati ancora identificati.
- B7-H4 – detto anche VTCN1, è espresso da cellule tumorali e dai macrofagi associati al tumore; gioca un ruolo nella fase di “tumour escape”.
- BTLA – “B and T Lymphocyte Attenuator” (Attenuatore dei linfociti B e T), detta anche CD272; ha come ligando HVEM (Herpesvirus Entry Mediator). L’espressione di BTLA sulla superficie dei linfociti CD8+ umani è gradualmente down-regolata dal fenotipo naive fino a quello pienamente differenziato (effettore); diversi linfociti T CD8+ umani tumore-specifico esprimono livelli alti di BTLA.
- CTLA-4 – “Cytotoxic T-Lymphocyte-Associated protein 4” (Proteina 4 associata ai linfociti T citotossici); denominata anche CD152; è il bersaglio del farmaco Ipilimumab (Yervoy®), approvato dalla FDA nel marzo 2011 per la cura del melanoma. L’espressione di CTLA-4 sui linfociti T(reg) modula i tassi di proliferazione dei linfociti T. Di conseguenza, le cellule T attivate, incluse quelle attivate dagli antigeni tumorali, possono continuare a proliferare, produrre citochine ed esercitare l’azione citotossica nel microambiente tumorale.
- IDO – “Indoleamine 2,3-dioxygenase”; un enzima coinvolto nel catabolismo del triptofano che possiede anche proprietà da checkpoint immunitario inibitore. Analogo a IDO c’è TDO (tryptophan 2,3-dioxygenase), un enzima che sopprime le cellule T e NK, genere e attiva i T(regs) e le cellule mieloderivate inibitrici della risposta immunitaria. Promuove inoltre l’angiogenesi tumorale Attualmente sono in fase di elaborazione dei farmaci che inibiscono le vie di segnalazione mediate da IDO
- KIR – “Killer-cell Immunoglobulin-like Receptor”, è un recettore per le molecole del MHC di Classe I” presente sulle cellule Natural Killer. Attualmente è in fase di sperimentazione un anticorpo monoclonale (Lirilumab) anti-KIR.
- LAG3 – “Lymphocyte Activation Gene-3” o “Gene-3 per l’attivazione dei linfociti”; sopprime una risposta immunitaria interagendo sia con i linfociti T Regolatori (T-Regs) che interagendo direttamente con i linfociti T CD8+ Attualmente è in fase di sperimentazione (Fase I) un anticorpo monoclonale anti-LAG3, denominato BMS-986016.
- PD-1 inibitori (anticorpi monoclonali)– “Programmed Death 1 (PD-1)” o “Morte programmata 1”; è un recettore che possiede due ligandi: PD-L1 e PD-L2. L’interazione tra il PD1 e i suoi ligandi espressi dalle cellule tumorali, blocca la proliferazione delle cellule T, il rilascio delle citochine e la citotossicità. Gli inibitori del checkpoint PD-1 migliorano la risposta immunitaria contro le cellule tumorali. La Food and Drug Administration (FDA) statunitense ha approvato di 2 anticorpi monoclonali inibitori del PD-1: pembrolizumab (Keytruda®) per la terapia del melanoma e Nivolumab (Opdivo®) per carcinoma polmonare non a piccole cellule (NSCLC), approvato in Italia anche per carcinoma del rene e linfoma. Naturalmente questi trattamenti espongono il paziente al rischio di reazioni autoimmuni e il bilanciamento della terapia deve essere attentamente controllato.
- TIM-3 – “T-cell Immunoglobulin domain and Mucin domain 3”, ovvero “Dominio immunoglobulinico delle cellule T e Dominio Mucina 3”, espressa sui linfociti T CD4+ umani attivati. Essa regola la secrezione delle citochine secrete da Th1 e Th17 TIM-3 agisce da regolatore negativo della funzione dei linfociti Th1/Tc1, scatenando la morte cellulare mediante interazione con il suo ligando, la galectina-9.
- VISTA – “V-domain Ig suppressor of T cell activation”, ovvero “Immunoglobulina con dominio V, inibitore dell’attivazione delle cellule T”. La sua presenza viene rilevata sulle cellule emopoietiche e pertanto anche sui leucociti che infiltrano il tumore. L’inibizione (“blockade”) di vista potrebbe rivelarsi una strategia efficace per un ampio spettro di tumori solidi.
References:
- Hendriks J, Gravestein LA, Tesselaar K, van Lier RA, Schumacher TN e Borst J., CD27 is required for generation and long-term maintenance of T cell immunity, in Nat Immunol, vol. 1, n. 5, 1º novembre 2000, pp. 433–40,
- Agematsu K, Memory B cells and CD27, in Histology and Histopathology, vol. 15, n. 2, 1º aprile 2000, pp. 573–6,
- Borst J, Hendriks J, Xiao Y, CD27 and CD70 in T cell and B cell activation, in Curr Opin Immunol, vol. 17, n. 3, 1º giugno 2005, pp. 275–81,
- Coquet JM, Middendorp S, van der Horst G, Kind J, Veraar EA, Xiao Y, Jacobs H, Borst J, The CD27 and CD70 costimulatory pathway inhibits effector function of T helper 17 cells and attenuates associated autoimmunity, in Immunity, vol. 38, n. 1, 24 gennaio 2013, pp. 53–65,
- Abbas A.K., Lichtman A.H., Pober J.S. (Trad. ita a cura di Amadori A., Zanovello P.) Immunologia cellulare e molecolare, Ed. Piccin, 2002; ISBN 88-299-1622-6
- Pier G.B., Lyczak J.B., Wetzler L.M. (Trad. ita a cura di Rossi A.) Immunologia, Infezione e Immunità, Ed. Piccin, 2006
- CDX-1127 – Monoclonal Antibody Targeting CD27, Celldex Therapeutics.
- He LZ, Prostak N, Thomas LJ, Vitale L, Weidlick J, Crocker A, Pilsmaker CD, Round SM, Tutt A, Glennie MJ, Marsh H, Keler T, Agonist anti-human CD27 monoclonal antibody induces T cell activation and tumor immunity in human CD27-transgenic mice, in J Immunol, vol. 191, n. 8, 15 ottobre 2013, pp. 4174–83,
- O’Sullivan B, Thomas R, CD40 and dendritic cell function, in Crit Rev Immunol, vol. 23, n. 1, 1º gennaio 2003, pp. 83–107,
- Angela Zimm, Cancer ‘Miracle’ Patients Studied Anew for Disease Clues, in Bloomberg, 12 aprile 2014.
- Michael Croft, Takanori So e Wei Duan, The significance of OX40 and OX40L to T-cell biology and immune disease, in Immunological Reviews, vol. 229, n. 1, maggio 2009, pp. 173–191,
- Andrew D. Weinberg, Nicholas P. Morris e Magdalena Kovacsovics-Bankowski, Science gone translational: the OX40 agonist story, in Immunological Reviews, vol. 244, n. 1, novembre 2011, pp. 218–231,
- Brendan D. Curti, Magdalena Kovacsovics-Bankowski e Nicholas Morris, OX40 is a potent immune-stimulating target in late-stage cancer patients, in Cancer Research, vol. 73, n. 24, 15 dicembre 2013, pp. 7189–7198,
- Simona Ronchetti, Ornella Zollo e Stefano Bruscoli, GITR, a member of the TNF receptor superfamily, is costimulatory to mouse T lymphocyte subpopulations, in European Journal of Immunology, vol. 34, n. 3, marzo 2004, pp. 613–622,
- Giuseppe Nocentini, Simona Ronchetti e Salvatore Cuzzocrea, GITR/GITRL: more than an effector T cell co-stimulatory system, in European Journal of Immunology, vol. 37, n. 5, maggio 2007, pp. 1165–1169,
- David A. Schaer, Sadna Budhu e Cailian Liu, GITR pathway activation abrogates tumor immune suppression through loss of regulatory T cell lineage stability, in Cancer Immunology Research, vol. 1, n. 5, novembre 2013, pp. 320–331,
- Yvonne Burmeister, Timo Lischke e Anja C. Dahler, ICOS controls the pool size of effector-memory and regulatory T cells, in Journal of Immunology (Baltimore, Md.: 1950), vol. 180, n. 2, 15 gennaio 2008, pp. 774–782.
- Eastwood D, Findlay L, Poole S, Bird C, Wadhwa M, Moore M, Burns C, Thorpe R, Stebbings R, Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells, in Br J Pharmacol, vol. 161, n. 3, 1º ottobre 2010, pp. 512–526,
- Onur Boyman e Jonathan Sprent, The role of interleukin-2 during homeostasis and activation of the immune system, in Nature Reviews. Immunology, vol. 12, n. 3, 17 febbraio 2012, pp. 180–190,
- Robert D. Leone, Ying-Chun Lo e Jonathan D. Powell, A2aR antagonists: Next generation checkpoint blockade for cancer immunotherapy, in Computational and Structural Biotechnology Journal, vol. 13, 2015, pp. 265–272,
- A. I. Chapoval, J. Ni e J. S. Lau, B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production, in Nature Immunology, vol. 2, n. 3, marzo 2001, pp. 269–274,
- Judith Leitner, Christoph Klauser e Winfried F. Pickl, B7-H3 is a potent inhibitor of human T-cell activation: No evidence for B7-H3 and TREML2 interaction, in European Journal of Immunology, vol. 39, n. 7, luglio 2009, pp. 1754–1764,
- Yixiang Mao, Wei Li e Kai Chen, B7-H1 and B7-H3 are independent predictors of poor prognosis in patients with non-small cell lung cancer, in Oncotarget, vol. 6, n. 5, 20 febbraio 2015, pp. 3452–3461,
- Denarda Dangaj, Evripidis Lanitis e Aizhi Zhao, Novel recombinant human b7-h4 antibodies overcome tumoral immune escape to potentiate T-cell antitumor responses, in Cancer Research, vol. 73, n. 15, 1º agosto 2013, pp. 4820–4829,
- Laurent Derré, Jean-Paul Rivals e Camilla Jandus, BTLA mediates inhibition of human tumor-specific CD8+ T cells that can be partially reversed by vaccination, in The Journal of Clinical Investigation, vol. 120, n. 1, gennaio 2010, pp. 157–167,
- Paula Kolar, Karin Knieke e J. Kolja E. Hegel, CTLA-4 (CD152) controls homeostasis and suppressive capacity of regulatory T cells in mice, in Arthritis and Rheumatism, vol. 60, n. 1, gennaio 2009, pp. 123–132,
- Nicholas L Syn, Michele W L Teng, Tony S K Mok e Ross A Soo, De-novo and acquired resistance to immune checkpoint targeting, in The Lancet Oncology, vol. 18, n. 12, pp. e731–e741,
- George C. Prendergast, Courtney Smith e Sunil Thomas, Indoleamine 2,3-dioxygenase pathways of pathogenic inflammation and immune escape in cancer, in Cancer immunology, immunotherapy: CII, vol. 63, n. 7, luglio 2014, pp. 721–735,
- Grosso JF, Kelleher CC, Harris TJ, Maris CH, Hipkiss EL, De Marzo A, Anders R, Netto G, Getnet D, Bruno TC, Goldberg MV, Pardoll DM, Drake CG, LAG-3 regulates CD8+ T cell accumulation and effector function in murine self- and tumor-tolerance systems, in J Clin Invest, vol. 117, n. 11, 1º novembre 2007, pp. 3383–92,
- Philips GK, Atkins M, Therapeutic uses of anti-PD-1 and anti-PD-L1 antibodies, in Int Immunol, vol. 27, n. 1, 1º gennaio 2015, pp. 39–46,
- Hastings WD, Anderson DE, Kassam N, Koguchi K, Greenfield EA, Kent SC, Zheng XX, Strom TB, Hafler DA, Kuchroo VK, TIM-3 is expressed on activated human CD4+ T cells and regulates Th1 and Th17 cytokines, in Eur J Immunol, vol. 39, n. 9, 1º settembre 2009, pp. 2492–501,
- Zhu C, Anderson AC, Kuchroo VK, TIM-3 and its regulatory role in immune responses, in Curr Top Microbiol Immunol, vol. 350, 11 agosto 2010, pp. 1–15,
- ^ Wang L, Rubinstein R, Lines JL, Wasiuk A, Ahonen C, Guo Y, Lu LF, Gondek D, Wang Y, Fava RA, Fiser A, Almo S, Noelle RJ, VISTA, a novel mouse Ig superfamily ligand that negatively regulates T cell responses, in J Exp Med, vol. 208, n. 3, 14 marzo 2011, pp. 577–92,
- Lines JL, Pantazi E, Mak J, Sempere LF, Wang L, O’Connell S, Ceeraz S, Suriawinata AA, Yan S, Ernstoff MS, Noelle R, VISTA is an immune checkpoint molecule for human T cells, in Cancer Res, vol. 74, n. 7, 1º aprile 2014, pp. 1924–32,
- Drew M. Pardoll, The blockade of immune checkpoints in cancer immunotherapy, in Nature Reviews Cancer, vol. 12, n. 4, 22 marzo 2012, pp. 252–264,
- Porichis F, Kaufmann DE (2012) Ruolo del PD-1 nella patogenesi dell’HIV e come bersaglio per la terapia. Curr HIV / AIDS Rep 9 (1): 81–90.