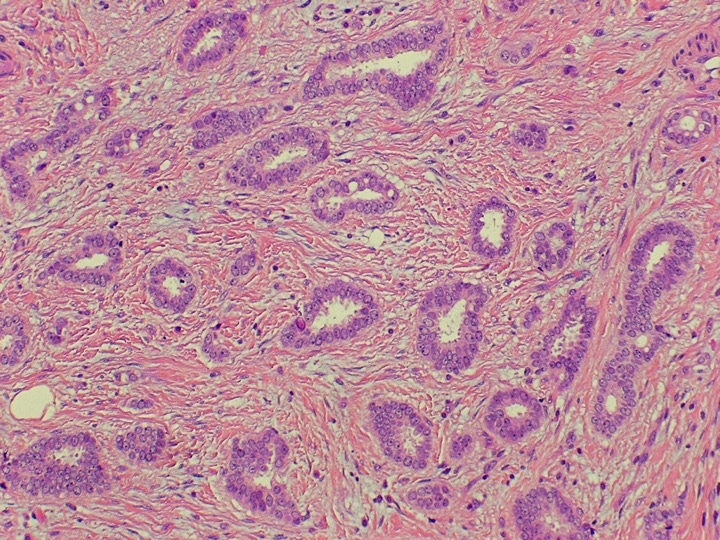
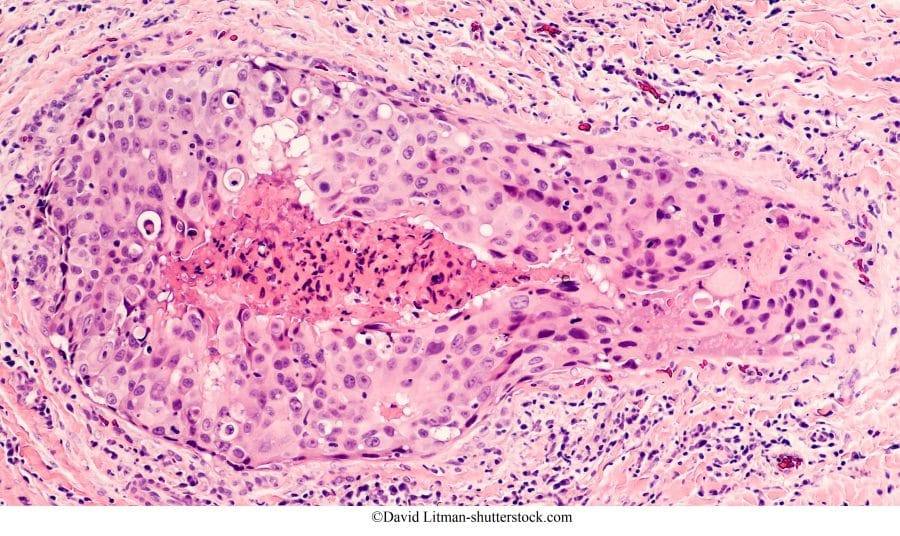
Il DCIS è una forma iniziale di tumore al seno (detto anche precanceroso, pre-invasivo) intraduttale: le cellule tumorali si sviluppano all’interno dei dotti, “in situ”, senza oltrepassare la membrana basale che resta intatta; non si estendono al di fuori del dotto o del lobulo nel tessuto circostante o in altre parti del corpo (1-5).
FREQUENZA: rappresentano il 20% di tutte le neoplasie mammarie.
DIAGNOSI –
Sintomatologia: Nella maggior parte dei casi non ci sono sintomi. In alcuni casi la paziente può notare un nodulo, una secrezione dal capezzolo, o, più raramente, un arrossamento dell’areola e/o del capezzolo caratteristici della m. di Paget.
 Mammografia: non essendoci di solito sintomi, nella maggior parte dei casi il DCIS viene scoperto solo in occasione di una mammografia. Questa è la ragione per cui il DCIS è diagnosticato più spesso da quando sono iniziati i programmi di screening mammario: rappresenta infatti circa il 20% di tutte le diagnosi nei programmi di screening ed è passato da meno del 5% fino ad una quota del 15-30% di tutti i carcinomi.
Mammografia: non essendoci di solito sintomi, nella maggior parte dei casi il DCIS viene scoperto solo in occasione di una mammografia. Questa è la ragione per cui il DCIS è diagnosticato più spesso da quando sono iniziati i programmi di screening mammario: rappresenta infatti circa il 20% di tutte le diagnosi nei programmi di screening ed è passato da meno del 5% fino ad una quota del 15-30% di tutti i carcinomi.
Può esserci un DCIS quando nella mammografia sono presenti microcalcificazioni che appaiono come piccole ed irregolari aree iperriflettenti.possono osservarsi (5-18).
USG: l’esame è eseguito con sonda lineare da 12 MHz con la paziente in decubito laterale se le lesioni sono laterali o molto posteriori. Tutte le lesioni sono state riprese in piani ortogonali (tipicamente radiali e antiradiali). L’imaging nel piano radiale consente la valutazione delle anomalie  duttali, mentre l’imaging nel piano antiradiale aiuta l’analisi dei margini. Nel 90% dei casi si evidenzia una singola area nodulare del diametro di 2 cm circa ( range 1-11 cm) ipoecogenica rispetto al tessuto adiposo circostante, a bordi netti e ipercogenici (fibrosi periduttale). La valutazione Color-Doppler è utile per rilevare la vascolarizzazione anomala perifocale (20-26).
duttali, mentre l’imaging nel piano antiradiale aiuta l’analisi dei margini. Nel 90% dei casi si evidenzia una singola area nodulare del diametro di 2 cm circa ( range 1-11 cm) ipoecogenica rispetto al tessuto adiposo circostante, a bordi netti e ipercogenici (fibrosi periduttale). La valutazione Color-Doppler è utile per rilevare la vascolarizzazione anomala perifocale (20-26).
Nel 45% dei casi di DCIS possono osservarsi piccole aree iperecogene lamellari, del diametro di medio di 0.5 cm, che corrispondono a microcalcificazioni a carico dei prolungamenti citoplasmatici delle cellule duttali che sporgono nel lume. Le microcalcificazioni possono anche rappresentare l’unico reperto ecografico (o mammografico) del DCIS. La risoluzione USG per le calcificazioni, dell’ordine di 200-500 μm, è inferiore alla risoluzione 50-100-μm della mammografia (27-31).
La posizione delle lesioni è specificata dalla posizione sul quadrante di un orologio e dalla distanza dal capezzolo.
L’elastografia, che indica la rigidità del tessuto misurando tensione del tessuto o spostamento con eccitazione meccanica, può essere utilizzata nella valutazione USG del DCIS non calcificato. Tuttavia, data la sovrapposizione dei valori di elasticità per le lesioni benigne e maligne, l’elastografia deve essere utilizzata solo in combinazione con USG B-mode. L’aggiunta dell’elastografia all’analisi delle caratteristiche in modalità B può aumentare la specificità degli US (31-34).
La biopsia ecoguidata con ago centrale è eseguita con un ago da 12 o 14 gauge con un dispositivo per biopsia a molla, o, più raramente, con un dispositivo per biopsia con vuoto da 12 gauge (24-34).
RMN: In alcuni casi è utile eseguire una risonanza magnetica che riesce a identificare noduli anche molto piccoli: identifica il tumore primario nel 70-86% dei casi di cancro mammario occulto. La RMN inoltre permette di meglio definire noduli e dilatazioni duttali e relative estensioni permettendo così di programmare in modo ottimale il trattamento successivo.
Non sostituisce la mammografia come indagine di screening per la diagnosi di ca. mammario perchè gravato da un elevato tasso di falsi positivi identificando come lesioni neoplastiche formazioni che non lo sono; inoltre non riconosce le microcalcificazioni con l’esattezza della mammografia (35-43). La RMN mammaria come metodica di screening in aggiunta alla mammografia e alla visita senologica è dunque indicata soltanto per donne con aumentato rischio di tumore al seno o con caratteristiche anatomiche che rendono poco efficaci i tradizionali strumenti diagnostici. In particolare viene consigliata alle donne con:
- mutazione dei geni Brca 1 e Brca 2;
- rischio aumentato di ca. mammario, calcolato con appositi modelli predittivi che tengono conto di numerosi fattori (età, esposizione alle radiazioni prima dei 15 anni, storia ormonale, stili di vita, etc.);
- storia personale di carcinoma duttale in situ, lobulare in situ, iperplasia duttale atipica, iperplasia lobulare atipica;
- carcinoma lobulare invasivo, che è difficile da valutare sulla mammografia.
- mammelle particolarmente dense.
BIOPSIA: per arrivare a una diagnosi definitiva è comunque necessaria una biopsia. In base alla situazione sono possibili diversi tipi di biopsia (ampiamente descritti altrove):
- In caso di un nodulo si esegue un esame citologico e istologico con tecniche bioptiche varie
- In caso di secrezione dal capezzolo si esegue un esame citologico
- In caso di micro-calcificazioni o sospetta lesione o lesioni piccole, non pal pabili o alterazioni dell’architettura mammaria (distorsioni parenchimali), si si ricorre ad un sistema elaborato nel 1995 e chiamato Mammotome capace di eseguire una biopsia VABB (Vacuum Assisted Breast Biopsy). L’esame si effettua ambulatorialmente, previa anestesia locale e piccola incisione della cute, mediante introduzione di un ago di calibro 11G o 14G. Il sistema è costituito da un tavolo radiologico dedicato (tavolo di Fischer) e da un sistema di puntamento radiologico dell’ago, assistito da un computer per la localizzazione della lesione da esaminare. Questo permette di avere una maggiore precisione nell’operazione di inserimento dell’ago, perché è il sistema computerizzato con misurazioni precise (biopsia stereotassica) a valutare profondità e posizione dell’ago. Grazie all’effetto aspirativo il tessuto viene attratto verso la finestra contenuta nella parte distale dell’ago e grazie alla rotazione a 360° il tessuto viene tagliato e trascinato nella camera di prelievo posta all’estremità dell’ago.I rischi associati alla procedura includono sanguinamenti eccessivi, dolore, comparsa di ecchimosi o tumefazione che si possono ridurre con impacchi freddi dopo l’intervento (44-61).
CLASSIFICAZIONE DCIS
Le cellule tumorali vengono classificate, al microscopio, in base al loro grado di differenza dalle normali cellule mammarie e alla loro velocità di crescita (62-66).
In questo modo il DCIS viene diviso in grado basso (Grado 1 o DCIS1), intermedio (Grado 2 o DCIS2) o alto (Grado 3 o DCIS3).
DCIS1 – Questa è la neoplasia intraduttale ben differenziato.
- le cellule mantengono una certa direzione di crescita, sono perpendicolari all’asse maggiore del tubulo (o della membrana basale).
- Le cellule hanno un aspetto colonnare, sporgono nel lume, ma non perdono la polarità.
- le cellule tubulari proliferano fino a formare dei ponti e delle micropapille che si fondono fra loro e il lume del tubulo sembra bucherellato (cribriforme).
- Gli spazi all’interno di questi fori possono contenere delle proteine e dei cristalli di idrossiapatite. Sono relativamente circolari, hanno dei contorni regolari e le cellule che delimitano i fori si dispongono perpendicolarmente, quindi la forma diventa simile a un ponte romano. Questa disposizione delle cellule rispetto al foro permette di diagnosticare il carcinoma intraduttale in situ ben differenziato anche nelle situazioni più difficili.
Neoplasia intraepiteliale duttale di grado 2 (DCIS1)
È il carcinoma duttale in situ moderatamente differenziato con le seguenti caratteristiche:
- Le atipie cellulari e nucleari sono maggiori rispetto a DCIS1,
- L’ordine di crescita delle cellule è alterato,
- La polarizzazione (disposizione) cellulare è parziale,
- Aumentano le mitosi (divisione cellulare),
- Può comparire al centro un’area di necrosi.
- Sono frequenti le microcalcificazioni senza una forma definita o laminari nell’area centrale.
- Il dotto si riempie completamente di cellule.
Neoplasia intraduttale in situ di grado 3
È il carcinoma duttale in situ scarsamente differenziato con le seguenti caratteristiche:
- Le atipie cellulari molto più marcate,
- Le cellule hanno quasi del tutto perduto la loro polarità (disposizione),
- I nuclei appaiono più grandi, in grado di modificare la forma, molto irregolari e all’interno si possono vedere dei nucleoli grandi.
- Nella parte centrale del dotto compare un’area di necrosi comedonica a causa dell’apporto insufficiente di ossigeno alle cellule epiteliali del dotto che proliferano velocemente.
Su queste cellule si formano delle calcificazioni distrofiche grossolane e amorfe.
Il DCIS viene anche diviso in due tipi in base alla modalità di crescita all’interno del dotto:
- “comedonico” quando è composto da grandi cellule di forma irregolare, con elevata proliferazione e necrosi della parte centrale del dotto.
- “non-comedonico”, detto anche cribriforme/micropapillare, composto da cellule più piccole, di forma regolare, privo di necrosi.
Evoluzione: se il DCIS non viene curato le cellule cancerose nell’1% dei casi, possono diffondersi al di fuori del dotto nel tessuto circostante o in altre parti del corpo e diventare un carcinoma duttale invasivo.
L’esame istologico di un DCIS deve comprendere, come per i tumori invasivi:
- l’esame dei recettori ormonali a cui si legano estrogeni e progesterone che stimolano le cellule tumorali a crescere
- il recettore per HER2
- l’indice di proliferazione Ki67 o MIB1
Queste informazioni possono aiutare a scegliere la terapia più appropriata.
TERAPIA
Lo scopo del trattamento è asportare chirurgicamente in modo completo il DCIS per evitare che si riformi o possa diventare un tumore duttale invasivo se non viene curato. In ogni caso, a volte da un DCIS non si sviluppa in carcinoma invasivo o la crescita è così lenta da non rappresentare un problema per tutto il resto della vita. Questo è particolarmente importante nelle persone anziane. È impossibile attualmente prevedere nella singola paziente quale sarà il comportamento futuro: il tipo di DCIS (comedonico), il grado (Grado 3) e le dimensioni possono essere d’aiuto ma non c’è modo di stabilire con certezza in quali casi il DCIS potrebbe diventare un carcinoma duttale invasivo se non curato. Per questa ragione viene di solito raccomandato un trattamento, che a volte potrebbe non essere necessario.
Chirurgia
La chirurgia è il primo trattamento del DCIS; quasi sempre è sufficiente un intervento conservativo come tumorectomia o quadrantectomia seguito da radioterapia.
Si attorno asporta il tessuto mammario neoplastico compreso un margine di tessuto sano di almeno 2 cm attorno alla parte interessata dal DCIS. In alcuni casi può essere consigliata una mastectomia.
La scelta tra i diversi tipi di intervento dipende da molti fattori come le dimensioni e la sede del DCIS e le dimensioni della mammella. Una mastectomia è di solito raccomandata se non è stato possibile ottenere un margine di tessuto sao adeguato dopo un intervento conservativo (67-70).
Bisogna localizzare la sede occupata dal DCIS prima di un intervento chirurgico conservativo per identificare esattamente la zona da rimuovere. Sotto guida ecografica o Rx viene inserito un filo radiopaco nell’area da asportare. La procedura viene effettuata, in anestesia locale, il giorno prima o il giorno stesso dell’intervento, e dura circa 30 minuti.
Se viene proposta una mastectomia, di solito l’intervento di ricostruzione può essere eseguito nella stessa seduta della mastectomia oppure in un secondo tempo (60-71).
Linfadenectomia ascellare: nel DCIS le cellule tumorali non si estendono al di fuori del dotto nel tessuto circostante o in altre parti del corpo. Per questa ragione abitualmente non è necessario rimuovere ed esaminare i linfonodi ascellari, come invece è richiesto in caso di carcinoma invasivo. Invece in caso di mastectomia è utile esaminare il linfonodo sentinella.
In alcuni casi di DCIS, il patologo identifica all’esame istologico anche delle aree di tumore duttale invasivo. In questo caso il trattamento successivo sarà diverso e potrà essere necessario esaminare il linfonodo sentinella. Questa è la ragione per cui in caso di mastectomia è utile procedere direttamente all’analisi del linfonodo sentinella; dopo una mastectomia infatti tecnicamente non è più possibile eseguire una biopsia del linfonodo sentinella (71-87).
Dolore post-chirurgico
il 33% delle pazienti riporta dolore in generale, e il 12% riporta dolore da moderato a severo nell’area interessata dall’intervento;
– circa un terzo delle pazienti riporta disturbi sensoriali come formicolio (32%), intorpidimento (37%) e prurito doloroso (30%);
– il 20% riporta ansia, il 6% depressione e l’11% distress.
Il dolore non deve mai essere accettato come una sequela inevitabile della chirurgia, e anche i sintomi sensoriali richiedono un approccio terapeutico adeguato.
Ulteriori trattamenti
Dopo l’intervento possono essere indicati ulteriori terapie di prevenzione (dette terapie adiuvanti o precauzionali) come la radioterapia, la terapia endocrina e la chemioterapia.
Radioterapia
La radioterapia è di solito raccomandata dopo un intervento conservativo per ridurre il rischio che il DCIS si riformi nella stessa mammella. Sono in corso studi clinici per valutare la dose adeguata di radioterapia in questo tipo di tumore. La radioterapia non è utile dopo una mastectomia (88-94).
Terapia endocrina
I benefici della terapia endocrina nel DCIS sono molto meno consistenti che nel carcinoma duttale invasivo.
- Tamoxifene (Nolvadex® cpr 10, 20 mg): è al momento attuale l’unica terapia endocrina precauzionale approvata dalla FDA nel 2000 e che ha dimostrato di essere efficace nel DCIS. Il tamoxifene blocca i recettori ormonali a cui si legano gli estrogeni che esercitano un’azione mitogena e proliferativa. Viene prescritto sia alle pazienti in premenopausa che a quelle in menopausa. Il trattamento prevede la somministrazione di 20-40 mg/die di TMX per almeno 5 anni. Recenti evidenze hanno dimostrato come il tamoxifene possa ridurre i livelli ematici di colesterolo totale, ed in particolare delle LDL, preservando al contempo il mantenimento della densità minerale ossea, risultando così protettivo nei confronti di patologie cardiovascolari e osteoporotiche. (95-98).
- Anastrazolo (Anastrazolo Sandoz® cpr 1 mg): rappresenta una valida opzione per le donne in post-menopausa con DCIS ER-positive. La scelta tra questo farmaco e il tamoxifene probabilmente dipenderà soprattutto dalla presenza di precedenti patologie (come osteoporosi e trombosi venosa) dalla tollerabilità del TMX piuttosto che dalla differenza in termini di efficacia (99).
Se nel DCIS non sono stati trovati i recettori ormonali, la terapia endocrina non viene consigliata perché non porterebbe alcun beneficio, anzi esporrebbe la paziente ad un’aumentata incidenza di neoplasie mammarie. - Inibitori dell’aromatasi (letrozolo, Femara® cpr): sono in corso studi clinici per meglio valutare l’efficacia degli inibitori dell’aromatasi nel DCIS. Al momento attuale gli inibitori dell’aromatasi si sono dimostrati efficaci e sono prescritti solo in caso di carcinoma invasivo della mammella. Il rationale del trattamento con AI consiste nel fatto che, contrariamente a quanto avviene nelle donne in età fertile, nelle quali la maggior parte degli estrogeni è prodotta dalle ovaie, nelle donne in menopausa, in seguito alla cessazione dell’attività ovarica, la sintesi degli estrogeni è legata all’attività dell’aromatasi che converte l’androstenedione di origine surrenalica in estrone. Pertanto bloccando l’azione di questo enzima è possibile ridurre drasticamente i livelli di estrone con conseguente beneficio nel trattamento dei tumori correlati alla concentrazione plasmatica estrogenica (100-126).
- terapia biologica mirata: nel DCIS può essere presente sulla superficie delle cellule tumorali il recettore HER2 (o Cerb-B2) che stimola la mitosi delle cellule tumorali. In caso di HER-2 negativo, la prognosi è favorevole. La positività di solito è registrata come “3+” o “+++” mentre la negatività è registrato come “0”, “negativo” oppure “+” o “++”. Nelle forme non invasive di tumore mammario come il DCIS al momento non vi è alcun dato che suggerisca un beneficio con una terapia biologica mirata (terapia a bersaglio) con Trastzumab. Il trastuzumab, comunemente noto con il nome commerciale di Herceptin® fl ev 600 mg/5 ml, è una sostanza che appartiene alla classe di farmaci antitumorali che prendono il nome di anticorpi monoclonali. Il trastuzumab è indicato per il trattamento di pazienti adulti con carcinoma mammario metastatico (MBC) HER2 positivo; è indicato nel trattamento di pazienti adulti con carcinoma mammario in fase iniziale (EBC) HER2 positivo. Gli anticorpi monoclonali sono sostanze sintetiche, prodotte in laboratorio, in grado di distruggere alcuni tipi di
 cellule tumorali limitando al minimo il danno per le cellule sane. La loro funzione è quella di riconoscere determinate proteine (recettori) presenti sulla superficie di alcune cellule tumorali. Quando l’anticorpo monoclonale riconosce la presenza del recettore sulla superficie della cellula tumorale, vi si aggancia. In questo modo stimola il sistema immunitario dell’organismo ad aggredire le cellule neoplastiche e può anche indurre queste ultime ad autodistruggersi, oppure blocca il recettore impedendogli di legarsi a una proteina diversa che stimola la crescita delle cellule neoplastiche. In particolare, il trastuzumab agisce interferendo con una delle modalità di crescita e divisione delle cellule del carcinoma mammario. Allo stato attuale sembra che solo uno su cinque (20%) casi di tumore della mammella sia sensibile a questo farmaco.Il fattore di crescita umano dell’epidermide è una proteina prodotta naturalmente dal corpo umano, che in alcuni casi si attacca al recettore HER2 (o CerbB2) sulla superficie delle cellule neoplastiche. Questo legame stimola la moltiplicazione delle cellule neoplastiche. Il trastuzumab blocca tale azione per competizione recettoriale, si attacca alla proteina HER2, impedendo in tal modo al VEGF legarsi al recettore. Il Trastuzumab si somministra per infusioni endovenose settimanali. Se il trattamento è in combinazione con paclitaxel, questo viene somministrato secondo il protocollo standard, di solito settimanale (127-181).
cellule tumorali limitando al minimo il danno per le cellule sane. La loro funzione è quella di riconoscere determinate proteine (recettori) presenti sulla superficie di alcune cellule tumorali. Quando l’anticorpo monoclonale riconosce la presenza del recettore sulla superficie della cellula tumorale, vi si aggancia. In questo modo stimola il sistema immunitario dell’organismo ad aggredire le cellule neoplastiche e può anche indurre queste ultime ad autodistruggersi, oppure blocca il recettore impedendogli di legarsi a una proteina diversa che stimola la crescita delle cellule neoplastiche. In particolare, il trastuzumab agisce interferendo con una delle modalità di crescita e divisione delle cellule del carcinoma mammario. Allo stato attuale sembra che solo uno su cinque (20%) casi di tumore della mammella sia sensibile a questo farmaco.Il fattore di crescita umano dell’epidermide è una proteina prodotta naturalmente dal corpo umano, che in alcuni casi si attacca al recettore HER2 (o CerbB2) sulla superficie delle cellule neoplastiche. Questo legame stimola la moltiplicazione delle cellule neoplastiche. Il trastuzumab blocca tale azione per competizione recettoriale, si attacca alla proteina HER2, impedendo in tal modo al VEGF legarsi al recettore. Il Trastuzumab si somministra per infusioni endovenose settimanali. Se il trattamento è in combinazione con paclitaxel, questo viene somministrato secondo il protocollo standard, di solito settimanale (127-181).
- terapia biologica mirata: nel DCIS può essere presente sulla superficie delle cellule tumorali il recettore HER2 (o Cerb-B2) che stimola la mitosi delle cellule tumorali. In caso di HER-2 negativo, la prognosi è favorevole. La positività di solito è registrata come “3+” o “+++” mentre la negatività è registrato come “0”, “negativo” oppure “+” o “++”. Nelle forme non invasive di tumore mammario come il DCIS al momento non vi è alcun dato che suggerisca un beneficio con una terapia biologica mirata (terapia a bersaglio) con Trastzumab. Il trastuzumab, comunemente noto con il nome commerciale di Herceptin® fl ev 600 mg/5 ml, è una sostanza che appartiene alla classe di farmaci antitumorali che prendono il nome di anticorpi monoclonali. Il trastuzumab è indicato per il trattamento di pazienti adulti con carcinoma mammario metastatico (MBC) HER2 positivo; è indicato nel trattamento di pazienti adulti con carcinoma mammario in fase iniziale (EBC) HER2 positivo. Gli anticorpi monoclonali sono sostanze sintetiche, prodotte in laboratorio, in grado di distruggere alcuni tipi di
Dieta, life style e prevenzione: il World Cancer Research Fund consiglia di evitare il fumo, alcool, sovrappeso e obesità, svolgere attività fisica aerobica per almeno 30 minuti al giorno ma possibilmente tutti i giorni senza interruzioni, limitare il consumo di carni rosse ed insaccati, limitare bevande gasate e zuccherate, dieta ricca di legumi e verdure.
Bibliografia:
- The Lancet Oncology 2015. doi: 10.1016/S1470-2045(15)00446-5 http://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(15)00446-5/abstract
- Patchesfsky A S, Schwartz G F, Finkelstein S D et al. Heterogeneity of intraductal carcinoma of the breast. Cancer 1989; 63: 731–741.
- Sibbering D M, Blamey R W. Nottingham experience. In: Silverstein M J, ed. Ductal Carcinoma In Situ of the Breast. Baltimore: Williams and Wilkins, 1997; 271–284.
- Lennington W J, Jensen R A, Dalton L W et al. Ductal carcinoma in situ of the breast. Heterogeneity of individual lesions. Cancer 1994; 73: 118–124.
- Silverstein M J. Intraductal breast carcinoma: two decades of progress? Am J Clin Oncol 1991; 14: 534–537.
- Holland R, Faverly D R G. Local distribution of ductal carcinoma in situ of the breast: whole organ studies. In: Silverstein M J, ed. Ductal Carcinoma In Situ of the Breast, 2nd Edition. Philadelphia: Lippincott, Williams and Wilkins, 2002; 240–248.
- Silverstein M J, Lagios M D. Ductal carcinoma in situ: factors predicting recurrence and how they can be used in treatment planning. Oncology 1997; 11(3): 393–410.
- Fisher E R, Constantino J, Fisher B et al. Pathologic finding from the National Surgical Adjuvant Breast and Bowel Project (NSABP) protocol B-17: intraductal carcinoma (ductal carcinoma in situ). Cancer 1995; 75: 1310–1319.
- Poller D, Silverstein M J, Galea M et al. Ductal carcinoma in situ of the breast: a proposal for a new simplified histologic classification association between cellular proliferation and c-erbB-2 protein expression. Modern Pathol 1994; 7: 257–262.
- Bellamy C, McDonald C, Salter D et al. Noninvasive ductal carcinoma of the breast: the relevance of histologic categorization. Hum Pathol 1993; 24: 16–23.
- Lagios M D. Ductal carcinoma in situ: controversies in diagnosis, biology, and treatment. Breast J 1995; 1: 68–78.
- Ottesen G L, Graversen H P, Blichert-Toft M et al. Ductal carcinoma in situ of the female breast. Short term results of a prospective nationwide study. Am J Surg Pathol 1992; 16: 1183–1196.
- Zafrani B, Leroyer A, Fourquet A et al. Mammographically detected ductal carcinoma in situ of the breast analyzed with a new classification. A study of 127 cases: correlation with estrogen and progesterone receptors, p53 and c-erb-2 proteins, and proliferation activity. Semin Diagn Pathol 1994; 11(3): 208–213.
- Silverstein M J, Lagios M D, Craig P H et al. A prognostic index for ductal carcinoma in situ. Cancer 1996; 77: 2267–2274.
- Silverstein M, Lagios M, Craig P et al. The Van Nuys Prognostic Index for ductal carcinoma in situ. Breast J 1996; 2: 38–40.
- Silverstein M J. The University of Southern California/Van Nuys Prognostic Index. In: Silverstein M J, ed. Ductal Carcinoma In Situ of the Breast, 2nd Edition. Philadelphia: Williams and Wilkins, 2002; 459–473.
- Galea M, Blamey R, Elston C et al. The Nottingham Prognostic Index in primary breast cancer. Breast Cancer Res Treat 1992; 22: 207–219.
- Holland R, Hendriks J H C L, Verbeek A L M et al. Extent, distribution and mammographic/histologic correlations of breast ductal carcinoma in situ. Lancet 1990; 335: 519–522.
- Rizzatto G, Chersevani R, Abbona M, Lombardo VL, Macorig D. High-resolution sonography of breast carcinoma. Eur J Radiol1997;24(1):11–19.
- Hashimoto BE, Kramer DJ, Picozzi VJ. High detection rate of breast ductal carcinoma in situ calcifications on mammographically directed high-resolution sonography. J Ultrasound Med 2001;20(5): 501–508.
- Stavros AT. US of ductal carcinoma in situ. In: , Silverstein MJ, ed. Ductal carcinoma in situ of the breast. 2nd ed. Philadelphia, Pa: Lippincott, Williams & Wilkins, 2002; 128–169.
- Regner DM, Hesley GK, Hangiandreou NJ, et al.. Breast lesions: evaluation with US strain imaging—clinical experience of multiple observers. Radiology 2006;238(2):425–437.
- Tanter M, Bercoff J, Athanasiou A, et al.. Quantitative assessment of breast lesion viscoelasticity: initial clinical results using supersonic shear imaging. Ultrasound Med Biol 2008;34(9):1373–1386.
- Itoh A, Ueno E, Tohno E, et al.. Breast disease: clinical application of US elastography for diagnosis. Radiology 2006;239(2):341–350.
- Berg WA, Cosgrove DO, Doré CJ, et al.. Shear-wave elastography improves the specificity of breast US: the BE1 multinational study of 939 masses. Radiology 2012;262(2):435–449.
- be H, Schmidt RA, Shah RN, et al.. MR-directed (“second-look”) ultrasound examination for breast lesions detected initially on MRI: MR and sonographic findings. AJR Am J Roentgenol 2010;194(2):370–377
- Soo MS, Baker JA, Rosen EL. Sonographic detection and sonographically guided biopsy of breast microcalcifications. AJR Am J Roentgenol 2003;180(4):941–948.
- Soo MS, Baker JA, Rosen EL, Vo TT. Sonographically guided biopsy of suspicious microcalcifications of the breast: a pilot study. AJR Am J Roentgenol 2002;178(4):1007–1015.
- Moon WK, Im JG, Koh YH, Noh DY, Park IA. US of mammographically detected clustered microcalcifications. Radiology2000;217(3):849–854
- Park JS, Park YM, Kim EK, et al.. Sonographic findings of high-grade and non-high-grade ductal carcinoma in situ of the breast. J Ultrasound Med 2010; 29(12):1687–1697
- Moon WK, Myung JS, Lee YJ, Park IA, Noh DY, Im JG. US of ductal carcinoma in situ. RadioGraphics 2002;22(2):269–280; discussion 280–281.
- Silverstein MJ, Poller DN, Waisman JR, et al.. Prognostic classification of breast ductal carcinoma-in-situ. Lancet1995;345(8958):1154–1157
- Cho KR, Seo BK, Kim CH, et al.. Non-calcified ductal carcinoma in situ: ultrasound and mammographic findings correlated with histological findings. Yonsei Med J 2008;49(1):103–110.
- Izumori A, Takebe K, Sato A. Ultrasound findings and histological features of ductal carcinoma in situ detected by ultrasound examination alone. Breast Cancer 2010;17(2):136–141
- Faverly D R G, Burgers L, Bult P et al. Three dimensional imaging of mammary ductal carcinoma in situ; clinical implications. Semin Diagn Pathol 1994; 11: 193–198.
- Evans A. The diagnosis and management of pre-invasive breast disease: radiological diagnosis. Breast Cancer Res 2003; 5:250-3.
- Schwartz GF, Feig SA, Patchefsky A. Significance and staging
of nonpalpable carcinomas of breast. Surg Gyneol Obstet
1988; 166: 6-10. - Liu PF, Debatin JF, Caduff RF et al (1998) Improved diagnostic accuracy in dynamic contrast enhanced MRI of the breast by combined quantitative and qualitative analysis. Br J Radiol 71:501–509
- Sinha S, Lucas-Quesada FA, Debruhl ND et al (1997) Multifeature analysis of Gd-enhanced MR images of breast lesions. J Magn Reson Imaging 7:1016–1026
- Sardanelli F, Giuseppetti GM, Canavese G et al (2008) Indications for breast magnetic resonance imaging. Consensus Document “Attualità in Senologia”, Florence 2007. Radiol Med 113:1085–1095
- Bluemke DA, Gatsonis CA, Chen MH et al (2004) Magnetic resonance imaging of the breast prior to biopsy. JAMA 292:2735–2742
- Siegmann KC, Mueller-Schimpfle M, Schick F et al (2002) MRI imaging-detected breast lesion: histopathologic correlation of lesion characteristics and signal intensity data. AJR Am J Roentgenol 178:1403–1409
- Fisher B, Dignam J, Wolmark N et al. Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol 1998; 16: 441–452.
- Varas X, Leborgne F, Leborgne JH. Nonpalpable, probably benign lesions: role of follow-up mammography. Radiology 1992;184:409–414.
- Stavros AT, Thickman D, Rapp CL, Dennis MA, Parker SH, Sisney GA. Solid breast nodules: use of sonography to distinguish between benign and malignant lesions. Radiology 1995;196:123–134.
- Stavros AT. Ultrasound of solid breast nodules: distinguishing benign from malignant. In: Stavros AT, editor. Breast Ultrasound. Philadelphia: Lippincott Williams & Wilkins; 2004. pp. 445-525.
- Liberman L, Feng TL, Dershaw DD, Morris EA, Abramson AF. US-guided core breast biopsy: use and cost-effectiveness. Radiology 1998;208:717–723.
- Smith DN, Rosenfield Darling ML, Meyer JE, Denison CM, Rose DI, Lester S, et al. The utility of ultrasonographically guided large-core needle biopsy: results from 500 consecutive breast biopsies. J Ultrasound Med 2001;20:43–49.
- Chaiwun B, Settakorn J, Ya-In C, Wisedmongkol W, Rangdaeng S, Thorner P. Effectiveness of fine-needle aspiration cytology of breast: analysis of 2,375 cases from northern Thailand. Diagn Cytopathol 2002;26:201–205.
- Parker SH, Klaus AJ, McWey PJ, Schilling KJ, Cupples TE, Duchesne N, et al. Sonographically guided directional vacuum-assisted breast biopsy using a handheld device. AJR Am J Roentgenol 2001;177:405–408.
- Burbank F. Stereotactic breast biopsy: comparison of 14- and 11-gauge Mammotome probe performance and complication rates. Am Surg 1997;63:988–995.
- Jackman RJ, Marzoni FA Jr, Rosenberg J. False-negative diagnoses at stereotactic vacuum-assisted needle breast biopsy: long-term follow-up of 1,280 lesions and review of the literature. AJR Am J Roentgenol 2009;192:341–351.
- Jackman RJ, Birdwell RL, Ikeda DM. Atypical ductal hyperplasia: can some lesions be defined as probably benign after stereotactic 11-gauge vacuum-assisted biopsy, eliminating the recommendation for surgical excision? Radiology 2002;224:548–554.
- Brown TA, Wall JW, Christensen ED, Smith DV, Holt CA, Carter PL, et al. Atypical hyperplasia in the era of stereotactic core needle biopsy. J Surg Oncol 1998;67:168–173.
- Baez E, Huber A, Vetter M, Hackelöer BJ. Minimal invasive complete excision of benign breast tumors using a three-dimensional ultrasound-guided mammotome vacuum device. Ultrasound Obstet Gynecol 2003;21:267–272.
- Park HL, Kwak JY, Lee SH, Kim JY, Kim KI, Kim WW, et al. Excision of benign breast disease by ultrasound-guided vacuum assisted biopsy device (Mammotome). J Korean Surg Soc 2005;68:96–101.
- Park HL, Kwak JY, Lee SH, Jung HK, Kim JY, Shim JY, et al. Excision of benign breast tumor by an ultrasound-guided hand held Mammotome biopsy device. J Breast Cancer 2005;8(3):92–98.
- agaya N, Nakagawa A, Ishikawa Y, Oyama T, Kubota K. Experience with ultrasonographically guided vacuum-assisted resection of benign breast tumors. Clin Radiol 2008;63:396–400.
- Fine RE, Israel PZ, Walker LC, Corgan KR, Greenwald LV, Berenson JE, et al. A prospective study of the removal rate of imaged breast lesions by an 11-gauge vacuum-assisted biopsy probe system. Am J Surg 2001;182:335–340.
- Govindarajulu S, Narreddy S, Shere MH, Ibrahim NB, Sahu AK, Cawthorn SJ. Preoperative mammotome biopsy of ducts beneath the nipple areola complex. Eur J Surg Oncol 2006;32:410–412.
- Hackman RJ, Burbank F, Parker SH, Evans WP 3rd, Lechner MC, Richardson TR, et al. Atypical ductal hyperplasia diagnosed at stereotactic breast biopsy: improved reliability with 14-gauge, directional, vacuum-assisted biopsy. Radiology 1997;204:485–488.
- Fisher E R, Dingnam J, Tan-Chiu E et al. Pathologic findings from the National Surgical Adjuvant Breast Project (NSABP) eight year update of protocol B-17: intraductal carcinoma. Cancer 1999; 86: 429–438.
- Silverstein M J. The Van Nuys Breast Center-The first free-standing multidisciplinary breast center. Surg Oncol Clin North Am 2000; 9(2): 159–175.
- Silverstein M J, Poller D N, Waisman J R et al. Prognostic classification of breast duct carcinoma in situ. Lancet 1995; 345: 1154–1157.
- Lagios M D, Westdahl P R, Margolin F R et al. Duct carcinoma in situ: relationship of extent of noninvasive disease to the frequency of occult invasion, multicentricity, lymph node metastases, and short-term treatment failures. Cancer 1982; 50: 1309–1314.
- Bijker N, Peterse J L, Duchateau L et al. Risk factors for recurrence and metastasis after breast conserving therapy for ductal carcinoma in situ: analysis of European Organization for Research and Treatment of Cancer Trial 10853. J Clin Oncol 2001; 19: 2263–2271.
- Schwartz G. The role of exicision and surveillance alone in subclinical DCIS of the breast. Oncology 1994; 8(2): 21–26.
- Vicini F A, Kestin L L, Goldstein N S et al. Impact of young age on outcome in patients with ductal carcinoma-in-situ treated with breast conserving therapy. J Clin Oncol 2000; 18: 296–306.
- Lagios M D, Margolin F R, Westdahl P R et al. Mammographically detected duct carcinoma in situ. Frequency of local recurrence following tylectomy and prognostic effect of nuclear grade on local recurrence. Cancer 1989; 63: 618–624.
- Intra M, Veronesi P, Mazzarol G, Galimberti V, Luini A, Sacchini V, Trifiro G, Gentilini O, Pruneri G, Naninato P, Torres F, Paganelli G, Viale G, Veronesi U. Axillary sentinel lymph node biopsy in patients with pure ductal carcinoma in situ of the breast. Arch Surg 2003;138:309-13leicher RJ, Giuliano AE The selective use of sentinel node biopsy in ductal carcinoma in situ. Arch Surg 2003;138:489
- Julien J P, Bijker N, Fentiman I et al. Radiotherapy in breast conserving treatment for ductal carcinoma in situ: first results of EORTC randomized phase III trial 10853. Lancet 2000; 355: 528–533.
- Solin L, Yeh I, Kurtz J et al. Ductal carcinoma in situ (intraductal carcinoma) of the breast treated with breast conserving surgery and definitive irradiation. Correlation of pathologic parameters with outcome of treatment. Cancer 1993; 71: 2532–2542.
- Recht A. Side effects of radiation therapy. In: Silverstein M J, ed. Ductal Carcinoma In Situ of the Breast. Baltimore: Williams and Wilkins, 1997; 347–352.
- Silverstein M J, Barth A, Poller D N et al. Ten-year results comparing mastectomy to excision and radiation therapy for ductal carcinoma in situ of the breast. Eur J Cancer 1995; 31: 1425–1427.
- George W D, Houghton J, Cuzick J et al. Radiotherapy and tamoxifen following complete local excision (CLE) in the management of ductal carcinoma in situ (DCIS): preliminary results from the UK DCIS trial. Proc Am Soc Clin Oncol 2000; 19: 70a(abst).
- Fisher B, Dignam J, Wolmark N. Tamoxifen in the treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomized controlled trial. Lancet 1999; 353: 1993–2000.
- Szelei-Stevens K A, Kuske R, Yantos V A et al. The influence of young age and positive family history of breast cancer on the prognosis of ductal carcinoma in situ treated with excision with or without radiation therapy or mastectomy. Int J Radiat Oncol Biol Phys 2000; 48: 943–949.
- Silverstein M J, Gierson E D, Colburn W J et al. Can intraductal breast carcinoma be excised completely by local excision? Cancer 1994; 73: 2985–2989.
- Goldstein N S, Vicini F A, Kerstin L L et al. Differences in the pathologic features of ductal carcinoma in situ of the breast based on patient age. Cancer 2000; 88: 2552–2560.
- Solin L J, Fourquet A, Vicini F A et al. Mammographically directed ductal carcinoma in situ of the breast treated with breast conserving surgery and definitive breast irradiation: long-term outcome and prognostic significance of patient age and margin status. Int J Radiat Oncol Biol Phys 2001; 50: 991–1002.
- Silverstein M J, Lagios M D, Martino S et al. Outcome after local recurrence in patients with ductal carcinoma in situ of the breast. J Clin Oncol 1998; 16: 1367–1373.
- Ashikari R, Hadju S I, Robbins G F. Intraductal carcinoma of the breast. Cancer 1971; 28: 1182–1187.
- Fentiman I S, Fagg N, Mills R R et al. In situ ductal carcinoma of the breast: implications of disease pattern and treatment. Eur J Surg Oncol 1986; 12: 261–266.
- Bradley S J, Weaver D W, Bouwman D L. Alternative in the surgical management of in situ breast cancer. Am Surg 1990; 56: 428–432.
- Lagios M D. Duct carcinoma in situ: pathology and treatment. Surg Clin North Am 1990; 70: 853–871.
- Schwartz G F, Finkel G C, Garcia J C et al. Subclinical ductal carcinoma in situ of the breast. Treatment by local excision and surveillance alone. Cancer 1992; 70: 2468–2474.
- Solin L J, Recht A, Fourquet A et al. Ten-year results of breast-conserving surgery and definitive irradiation for intraductal carcinoma of the breast. Cancer 1991; 68: 2337–2344.
- McCormick B, Rosen P P, Kinne D et al. Duct carcinoma in situ of the breast: an analysis of local control after conservation surgery and radiotherapy. Int J Radiat Oncol Biol Phys 1991; 21: 289–292.
- Bornstein B A, Recht A, Connolly J L et al. Results of treating ductal carcinoma in situ of the breast with conservative surgery and radiation therapy. Cancer 1991; 67: 7–13.
- Schnitt S J, Harris J R, Smith B L. Developing a prognostic index for ductal carcinoma in situ of the breast: are we there yet? Cancer 1996; 77: 2189–2192.
- Lagios M D, Silverstein M J. Duct carcinoma in situ: the success of breast conservation therapy: a shared experience of two single institution non randomized prospective studies. Surg Oncol Clin North Am 1997; 6(2): 385–392.
- Fisher B, Constantino J, Redmond C et al. Lumpectomy compared with lumpectomy and radiation therapy for the treatment of intraductal breast cancer. N Engl J Med 1993; 328: 1581–1586.
- Solin L J, Kurtz J, Fourquet A et al. Fifteen year results of breast conserving surgery and definitive breast irradiation for the treatment of ductal carcinoma in situ of the breast. J Clin Oncol 1996; 14: 754–763.
- Fisher B, Land S, Mamounas E et al. Prevention of invasive breast cancer in women with ductal carcinoma in situ: an update of the National Surgical Adjuvant Breast Project experience. Semin Oncol 2001; 28: 400–418.
- Fisher B et al: Tamoxifen in treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial. Lancet 1999;353:1993–2000.
- Allred DC et al: Adjuvant tamoxifen reduces subsequent breast cancer in women with estrogen receptor-positive ductal carcinoma in situ: A study based on NSABP protocol B-24. J Clin Oncol 2012;30:1268–1273.
- Freedman AN et al: Benefit/risk assessment for breast cancer chemoprevention with raloxifene or tamoxifen for women age 50 years or older. J Clin Oncol 2011;29:2327–2333.
- Staley H, McCallum I, Bruce J: Postoperative tamoxifen for ductal carcinoma in situ: Cochrane systematic review and meta-analysis. Breast 2014;23:546–551.
- Anastrozole versus tamoxifen for the prevention of locoregional and contralateral breast cancer in postmenopausal women with locally excised ductal carcinoma in situ (IBIS-II DCIS): a double-blind, randomised controlled trial.
Forbes JF, Sestak I, Howell A, Bonanni B, Bundred N, Levy C, von Minckwitz G, Eiermann W, Neven P, Stierer M, Holcombe C, Coleman RE, Jones L, Ellis I, Cuzick J; IBIS-II investigators.
Lancet. 2015 Dec 11. pii: S0140-6736(15)01129-0. doi: 10.1016/S0140-6736(15)01129-0. - American Society of Clinical Oncology Clinical Practice Guideline: Update on Adjuvant Endocrine Therapy for Women With Hormone Receptor–Positive Breast Cancer. J Clin Oncol 2010; 28: 3784-96.
- Colleoni M et al. J Clin Oncol 2011; 20; 29: 1117-24.
- National Comprehensive Cancer Network (NCCN). Breast cancer. Version 2.2011. www.nccn.org (accesso del 9.09.2011).
- Linee Guida AIOM: Neoplasia della mammella 2010. www.aiom.it/(accesso del 19.09.2011).
- ESMO 2011.Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. http://annonc.oxfordjournals.org/content/22/suppl_6/vi12.full.pdf+html (accesso
- del 19.09.2011).
- NICE 2009. Early and locally advanced breast cancer: diagnosis and treatment.www.nice.org/ (accesso del 19.09.2011).
- Gnant M. St. Gallen 2011: summary of the consensud discussion. Breast Care 2011; 6: 136-41.
- The ATAC (Arimidex, Tamoxifen Alone or in Combination) Trialists’ Group. Lancet 2002; 359; 2131-39.
- The Breast International Group (BIG) 1-98 Collaborative Group. N Engl J Med 2005; 353: 2747-57.
- Ring A et al. Cancer Res 2010; 70: 403s– 404s.
- Crivellari D et al. J Clin Oncol 2008; 26: 1972-9.
- Dowsett et al. J Clin Oncol 2010; 28: 509-18.
- Remorgida V, Abbamonte HL, Ragni N, Fulcheri E, Ferrero S. Letrozole and norethisterone acetate in rectovaginal endometriosis. Fertil Steril 2007;88:724-6.
- Indole 3 Carbinol – the safer, natural Tamoxifen? www.canceractive.com/cancer-active-page-link.aspx?n=1417.
- Martínez-Campa C et al, Melatonin inhibits aromatase promoter expression by regulating cyclooxygenases expression and activity in breast cancer cells. Br J Cancer. 2009 Nov 3;101(9):1613-9.
- Reich O, Regauer S., Tempfer C, Schneeberger C, Huber: Polymorphism 1558 C > T in the aromatase gene (CYP19A1) in low-grade endometrial stromal sarcoma. J.Eur J Gynaecol Oncol. 2011;32(6):626-7.
- Izabella Czajka-Oraniec, Wojciech Zgliczynski, Alina Kurylowicz, Michal Mikula and Jerzy Ostrowski: “Association between gynecomastia and aromatase (CYP19) polymorphisms”. European Journal of Endocrinology (2008) 158 721–727
- Michael N Okobia et al: “Simple tandem repeat (TTTA) n polymorphism in CYP19 (aromatase) gene and breast cancer risk in Nigerian women”. J Carcinog 2006,5:12
- Balthazart J, Foidart A. Brain aromatase and the control of male sexual behavior. J Steroid Biochem Mol Biol. 1993 Mar; 44(4-6):521-40.
- Baillien M, Balthazart J. A direct dopaminergic control of aromatase activity in the quail preoptic area. J Steroid Biochem Mol Biol. 1997 Sep-Oct; 63(1-3):99-113.
- Balthazart J, Baillien M, Ball GF. Interactions between aromatase (estrogen synthase) and dopamine in the control of male sexual behavior in quail. Comp Biochem Physiol B Biochem Mol Biol. 2002 May;132(1):37-55.
- Cornil CA et al. Rapid decreases in preoptic aromatase activity and brain monoamine concentrations after engaging in male sexual behavior. Endocrinology. 2005 Sep; 146(9):3809-20.
- Absil P et al. Distribution of DARPP-32 immunoreactive structures in the quail brain: anatomical relationship with dopamine and aromatase. J Chem Neuroanat. 2001 Jan;21(1):23-39.
- Schlinger BA, Callard GV. Aromatization mediates aggressive behavior in quail. Gen Comp Endocrinol. 1990 Jul; 79(1):39-53.
- Lonning PE. Int.. J. Gynecol. Cancer. 2006; 16 (Suppl. 2):. 518
- Jelovac D, L Macedo, Goloubeva OG, Handratta V, Brodie AM. Cancer Res.. 2005; 65 : 5439.
- De Sanctis MC et al: Trastuzumab and Hypofractionated Whole Breast Radiotherapy: A Victorious Combination? Clinical Breast Cancer Volume 18, Issue 3, June 2018, Pages e363-e371
- Maria do Rosário Couto, Daniela Pinto, Júlio Oliveira, Alice Monteiro, Deolinda Pereira, Rui Medeiros, Helena Rodrigues The predictive and monitoring value of serum HER2/NEU in breast cancer under trastuzumab therapy. Acta Med Potog 2011;1,24
- Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A et al (2001) Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. New Engl J Med. 344(11):783–792CrossRefPubMedGoogle Scholar
- Fried G, Regev T, Moskovitz M (2013) Trastuzumab-related cardiac events in the treatment of early breast cancer. Breast Cancer Res Treat 142(1):1–7CrossRefPubMedGoogle Scholar
- Montserrat M, Leveque D, Barthelemy P, Bergerat JP (2012) Duration of adjuvant trastuzumab treatment in routine practice. Anticancer Res 32(10):4585–4588PubMedGoogle Scholar
- Murray LJ, Ramakrishnan S, O’Toole L, Manifold IH, Purohit OP, Coleman RE (2010) Adjuvant trastuzumab in routine clinical practice and the impact of cardiac monitoring guidelines on treatment delivery. Breast. 19(5):339–344CrossRefPubMedGoogle Scholar
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I et al (2005) Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 353(16):1659–1672CrossRefPubMedGoogle Scholar
- Piotrowski G, Gawor R, Stasiak A, Gawor Z, Potemski P, Banach M (2012) Cardiac complications associated with trastuzumab in the setting of adjuvant chemotherapy for breast cancer overexpressing human epidermal growth factor receptor type 2—a prospective study. Arch Med Sci. 8(2):227–235CrossRefPubMedPubMedCentralGoogle Scholar
- Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE Jr, Davidson NE et al (2005) Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 353(16):1673–1684CrossRefPubMedGoogle Scholar
- Spielmann M, Roche H, Delozier T, Canon JL, Romieu G, Bourgeois H et al (2009) Trastuzumab for patients with axillary-node-positive breast cancer: results of the FNCLCC-PACS 04 trial. J Clin Oncol 27(36):6129–6134CrossRefPubMedGoogle Scholar
- Tarantini L, Cioffi G, Gori S, Tuccia F, Boccardi L, Bovelli D et al (2012) Trastuzumab adjuvant chemotherapy and cardiotoxicity in real-world women with breast cancer. J Card Fail. 18(2):113–119CrossRefPubMedGoogle Scholar
- Webster RM, Abraham J, Palaniappan N, Caley A, Jasani B, Barrett-Lee P (2012) Exploring the use and impact of adjuvant trastuzumab for HER2-positive breast cancer patients in a large UK cancer network. Do the results of international clinical trials translate into a similar benefit for patients in South East Wales? Br J Cancer 106(1):32–38CrossRefPubMedGoogle Scholar
- Wang SY, Long JB, Hurria A, Owusu C, Steingart RM, Gross CP et al (2014) Cardiovascular events, early discontinuation of trastuzumab, and their impact on survival. Breast Cancer Res Treat 146(2):411–419CrossRefPubMedGoogle Scholar
- Plana JC, Galderisi M, Barac A, Ewer MS, Ky B, Scherrer-Crosbie M et al (2014) Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 15(10):1063–1093CrossRefPubMedPubMedCentralGoogle Scholar
- Plana JC, Galderisi M, Barac A, Ewer MS, Ky B, Scherrer-Crosbie M et al (2014) Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 27(9):911–939CrossRefPubMedGoogle Scholar
- Crone SA, Zhao YY, Fan L, Gu Y, Minamisawa S, Liu Y et al (2002) ErbB2 is essential in the prevention of dilated cardiomyopathy. Nat Med 8(5):459–465CrossRefPubMedGoogle Scholar
- Negro A, Brar BK, Lee KF (2004) Essential roles of Her2/erbB2 in cardiac development and function. Recent Prog Horm Res 59:1–12CrossRefPubMedGoogle Scholar
- ElZarrad MK, Mukhopadhyay P, Mohan N, Hao E, Dokmanovic M, Hirsch DS et al (2013) Trastuzumab alters the expression of genes essential for cardiac function and induces ultrastructural changes of cardiomyocytes in mice. PLoS ONE (11):e79543CrossRefPubMedPubMedCentralGoogle Scholar
- Liu L, Zhu J, Glass PS, Brink PR, Rampil IJ, Rebecchi MJ (2009) Age-associated changes in cardiac gene expression after preconditioning. Anesthesiology 111(5):1052–1064CrossRefPubMedGoogle Scholar
- Reischauer S, Arnaout R, Ramadass R, Stainier D (2014) Actin binding GFP allows 4D in vivo imaging of myofilament dynamics in the zebrafish heart and the identification of Erbb2 signaling as a remodeling factor of myofibril architecture. Circ Res 115(10):845–856CrossRefPubMedPubMedCentralGoogle Scholar
- Reischauer S, Levesque MP, Nusslein-Volhard C, Sonawane M (2009) Lgl2 executes its function as a tumor suppressor by regulating ErbB signaling in the zebrafish epidermis. PLoS Genet 5(11):e1000720CrossRefPubMedPubMedCentralGoogle Scholar
- Aggarwal P, Turner A, Matter A, Kattman SJ, Stoddard A, Lorier R et al (2014) RNA expression profiling of human iPSC-derived cardiomyocytes in a cardiac hypertrophy model. PLoS ONE 9(9):e108051CrossRefPubMedPubMedCentralGoogle Scholar
- Heidecker B, Lamirault G, Kasper EK, Wittstein IS, Champion HC, Breton E et al (2010) The gene expression profile of patients with new-onset heart failure reveals important gender-specific differences. Eur Heart J 31(10):1188–1196CrossRefPubMedGoogle Scholar
- Kittleson MM, Hare JM (2005) Molecular signature analysis: the potential of gene-expression analysis in cardiomyopathy. Future Cardiol. 1(6):793–808CrossRefPubMedGoogle Scholar
- Kittleson MM, Hare JM (2005) Molecular signature analysis: using the myocardial transcriptome as a biomarker in cardiovascular disease. Trends Cardiovasc Med 15(4):130–138CrossRefPubMedGoogle Scholar
- Kittleson MM, Minhas KM, Irizarry RA, Ye SQ, Edness G, Breton E et al (2005) Gene expression analysis of ischemic and nonischemic cardiomyopathy: shared and distinct genes in the development of heart failure. Physiol Genom 21(3):299–307CrossRefGoogle Scholar
- Kittleson MM, Ye SQ, Irizarry RA, Minhas KM, Edness G, Conte JV et al (2004) Identification of a gene expression profile that differentiates between ischemic and nonischemic cardiomyopathy. Circulation 110(22):3444–3451CrossRefPubMedGoogle Scholar
- Treish I, Schwartz R, Lindley C (2000) Pharmacology and therapeutic use of trastuzumab in breast cancer. Am J Health-Syst Ph. 57(22):2063–2076Google Scholar
- Zhu S, Cawley SM, Bloch KD, Huang PL (2013) Trastuzumab and lapatinib differ in effects on calcium cycling and HER2 expression in human embryonic stem cell-derived cardiomyocytes. Cardiovasc Sys 1:10CrossRefGoogle Scholar
- Kalari KR, Nair AA, Bhavsar JD, O’Brien DR, Davila JI, Bockol MA et al (2014) MAP-RSeq: mayo analysis pipeline for RNA sequencing. BMC Bioinform 15:224CrossRefGoogle Scholar
- Radonic A, Thulke S, Mackay IM, Landt O, Siegert W, Nitsche A (2004) Guideline to reference gene selection for quantitative real-time PCR. Biochem Biophys Res Commun 313(4):856–862CrossRefPubMedGoogle Scholar
- Livak KJ, Schmittgen TD (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C) method. Methods 25(4):402–408CrossRefPubMedGoogle Scholar
- Gene Ontology Consortium (2015) Gene Ontology Consortium: going forward. Nucleic Acids Res 43((Database issue)):1049–1056CrossRefGoogle Scholar
- Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM et al (2000) Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nat Genet 25(1):25–29CrossRefPubMedPubMedCentralGoogle Scholar
- Opel A, Nobles M, Montaigne D, Finlay M, Anderson N, Breckenridge R et al (2015) Absence of the regulator of G-protein signalling, RGS4, predisposes to atrial fibrillation and is associated with abnormal calcium handling. J Biol Chem 290(31):19233–19244CrossRefPubMedPubMedCentralGoogle Scholar
- Tokudome T, Kishimoto I, Horio T, Arai Y, Schwenke DO, Hino J et al (2008) Regulator of G-protein signaling subtype 4 mediates antihypertrophic effect of locally secreted natriuretic peptides in the heart. Circulation 117(18):2329–2339CrossRefPubMedGoogle Scholar
- Xu YJ, Arneja AS, Tappia PS, Dhalla NS (2008) The potential health benefits of taurine in cardiovascular disease. Exp Clin Cardiol. 13(2):57–65PubMedPubMedCentralGoogle Scholar
- Ito T, Kimura Y, Uozumi Y, Takai M, Muraoka S, Matsuda T et al (2008) Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy. J Mol Cell Cardiol 44(5):927–937CrossRefPubMedGoogle Scholar
- Ito T, Yoshikawa N, Ito H, Schaffer SW (2015) Impact of taurine depletion on glucose control and insulin secretion in mice. J Pharmacol Sci. 129(1):59–64CrossRefPubMedGoogle Scholar
- Perry MC, Dufour CR, Eichner LJ, Tsang DW, Deblois G, Muller WJ et al (2014) ERBB2 deficiency alters an E2F-1-dependent adaptive stress response and leads to cardiac dysfunction. Mol Cell Biol 34(23):4232–4243CrossRefPubMedPubMedCentralGoogle Scholar
- Austin CD, De Maziere AM, Pisacane PI, van Dijk SM, Eigenbrot C, Sliwkowski MX et al (2004) Endocytosis and sorting of ErbB2 and the site of action of cancer therapeutics trastuzumab and geldanamycin. Mol Biol Cell 15(12):5268–5282CrossRefPubMedPubMedCentralGoogle Scholar
- De Keulenaer GW, Doggen K, Lemmens K (2010) The vulnerability of the heart as a pluricellular paracrine organ: lessons from unexpected triggers of heart failure in targeted ErbB2 anticancer therapy. Circ Res 106(1):35–46CrossRefPubMedGoogle Scholar
- Vermeulen Z, Segers VF, De Keulenaer GW (2016) ErbB2 signaling at the crossing between heart failure and cancer. Basic Res Cardiol 111(6):60CrossRefPubMedPubMedCentralGoogle Scholar
- Junttila TT, Akita RW, Parsons K, Fields C, Lewis Phillips GD, Friedman LS et al (2009) Ligand-independent HER2/HER3/PI3K complex is disrupted by trastuzumab and is effectively inhibited by the PI3K inhibitor GDC-0941. Cancer Cell 15(5):429–440CrossRefPubMedGoogle Scholar
- Donovan N, Crown JP, Clynes M (2006) Dual targeting of EGFR and HER-2 in breast cancer cell lines. J Clin Oncol 24(18_suppl):13132Google Scholar
- Barth AS, Zhang Y, Li T, Smith RR, Chimenti I, Terrovitis I et al (2012) Functional impairment of human resident cardiac stem cells by the cardiotoxic antineoplastic agent trastuzumab. Stem Cells Transl Med. 1(4):289–297CrossRefPubMedPubMedCentralGoogle Scholar
- Kolwicz SC Jr, Purohit S, Tian R (2013) Cardiac metabolism and its interactions with contraction, growth, and survival of cardiomyocytes. Circ Res 113(5):603–616CrossRefPubMedGoogle Scholar
- Sugden MC, Bulmer K, Holness MJ (2001) Fuel-sensing mechanisms integrating lipid and carbohydrate utilization. Biochem Soc Trans 29(Pt 2):272–278CrossRefPubMedGoogle Scholar
- Sugden MC, Holness MJ (2003) Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs. Am J Physiol Endocrinol Metab. 284(5):E855–E862CrossRefPubMedGoogle Scholar
- Piao L, Marsboom G, Archer SL (2010) Mitochondrial metabolic adaptation in right ventricular hypertrophy and failure. J Mol Med (Berl). 88(10):1011–1020CrossRefPubMedPubMedCentralGoogle Scholar
- Piao L, Fang YH, Cadete VJ, Wietholt C, Urboniene D, Toth PT et al (2010) The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: resuscitating the hibernating right ventricle. J Mol Med (Berl). 88(1):47–60CrossRefPubMedGoogle Scholar
- Churchill EN, Murriel CL, Chen CH, Mochly-Rosen D, Szweda LI (2005) Reperfusion-induced translocation of deltaPKC to cardiac mitochondria prevents pyruvate dehydrogenase reactivation. Circ Res 97(1):78–85CrossRefPubMedGoogle Scholar
- Kudej RK, White LT, Kudej AB, Vatner SF, Lewandowski ED (2002) Brief increase in carbohydrate oxidation after reperfusion reverses myocardial stunning in conscious pigs. Circulation 106(22):2836–2841CrossRefPubMedGoogle Scholar
- Lewandowski ED, White LT (1995) Pyruvate dehydrogenase influences postischemic heart function. Circulation 91(7):2071–2079CrossRefPubMedGoogle Scholar
- McVeigh JJ, Lopaschuk GD (1990) Dichloroacetate stimulation of glucose oxidation improves recovery of ischemic rat hearts. Am J Physiol 259(4 Pt 2):H1079–H1085PubMedGoogle Scholar