L’Helicobacter pylori è un batterio microaerofilo Gram-negativo, rinvenuto per la prima volta nello stomaco nel 1982. Non a caso, più  della metà della popolazione mondiale ospita l’Helicobacter pylori nel tratto gastrointestinale superiore.
della metà della popolazione mondiale ospita l’Helicobacter pylori nel tratto gastrointestinale superiore.
L’HP vive comunemente nello stomaco dove riesce a sopravvivere sia abbassando l’acidità gastrica mediante la secrezione di ureasi sia penetrando nello strato più interno e meno acido della mucosa gastrica.
Fisiopatologia dell’infezione da HP – L’Helicobacter pylori, grazie all’azione della proteasi e alla sua forma a spirale penetra facilmente nella mucosa gastrica provocando una gastrite cronica, ulcera gastro-duodenale e in alcuni casi cancro dello stomaco. La gastrite cronica attiva spesso evolve in gastrite atrofica che a sua volta può subire metaplasia e displasia della mucosa gastrica ed infine può evolvere in cancro dello stomaco.
La gastrite atrofica comporta ipocloridria e anemia perniciosa da carenza di vitamina B12 a sua volta dovuta a deficit del fattore intrinseco secreto dalle cellule parietali dello stomaco.
EPIDEMIOLOGIA – L’nfezione da HP si diffonde per contaminazione da persona infetta mediante contatto diretto oro-fecale o oro-orale o ingerendo cibi o bevande contaminati.
In media l’infezione da HP è presente nel 50% della popolazione mondiale. E’ maggiormente diffusa (fino al 90%) nei paesi in via di sviluppo a causa della malnutrizione e soprattutto della scarsità di acqua potabile. In questi paesi l’infezione si instaura precocemente durante l’infanzia mentre nei paesi industrializzati o con con stile di vita occidentale, l’infezione è più frequente nell’età adulta.
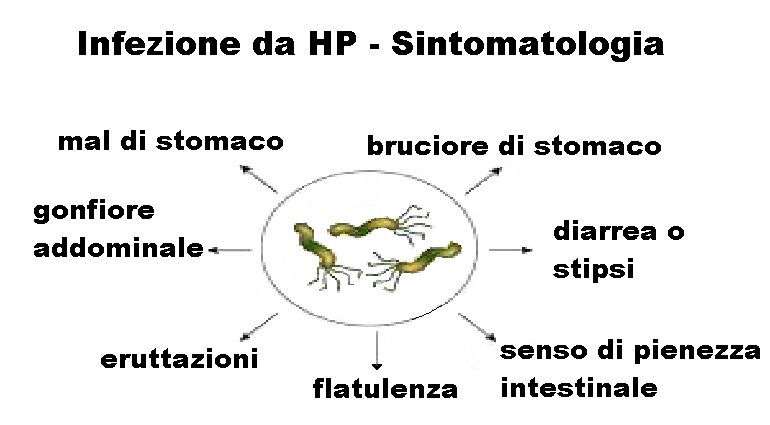
SINTOMATOLOGIA
L’80% delle persone infette risulta completamente asintomatica. I sintomi tipici sono la dispepsia con flatulenza, eruttazioni, senso di pienezza gastrica, perdita di appetito, perdita di peso, distensione addominale, diarrea e stipsi.
DIAGNOSI DI LABORATORIO- I test per diagnosticare l’H.pylori si suddividono in invasivi e non invasivi. I test non invasivi sono il Breath Urea Test, il ‘‘test del respiro” e il test di ricerca dell’antigene del batterio nelle feci, mentre test invasivi richiedono l’esame endoscopico e il prelievo di campioni biologici.
Il test più affidabile è proprio quello endoscopico, che richiede il prelievo di materiale biologico gastrico, poi analizzato in coltura microbica. In certi casi si può usare anche il test ELISA sulle urine del paziente; tale test offre una buona accuratezza con una sensibilità di circa il 95%.
Per eradicare l’Helicobacter pylori si usano diversi approcci terapeutici ma quelli che hanno più successo sono la triplice terapia e la terapia sequenziale per 4 settimane.
La terapia sequenziale, non è nient’altro che una duplice terapia con amoxicillina e un inibitore della pompa protonica (IPP, es. omeprazolo) per 5 giorni, seguita poi da una triplice terapia per gli altri 5 giorni. L’omeprazolo (Xantrazol® cpr 20 mg) è un farmaco inibitore della secrezione acida gastrica. Agisce bloccando irreversibilmente, tramite un’azione enzimatica nell’interno della cellula gastrica, le pompe protoniche che producono HCl. Una singola somministrazione giornaliera inibisce quasi totalmente la secrezione acida gastrica.
La triplice terapia viene usata in tutti i casi di infezione da H. pylori secondo varie combinazioni, usate nei diversi casi. Le combinazioni più frequenti sono:
- amoxicillina 2 g/die + claritromicina (Veclam® cpr 500 mg): 1 g/die + IPP (Xantrazol® cpr 20 mg: una compressa al mattino prima di colazione);
- oppure claritromicina 500 mg/die + metronidazolo 1 g/die + IPP dose standard;
- oppure tetraciclina 2 g/die + metronidazolo 1,5 g/die + bismuto subcitrato 480 mg/die + IPP dose standard.
References
- Chan FK: Helicobacter pylori and nonsteroidal anti-inflammatory drugs.
Gastroenterol Clin North Am. 2001; 30: 937-952 - Chan FK, Sung JY, Chung SC et al.: Randomised trial of eradication of Helicobacter pylori before non-steroidal anti-inflammatory drug therapy to prevent peptic ulcers. Lancet. 1997; 350: 975-997
- Leung WK, To KF, Chan FK, Lee TL, Chung SC, Sung JY: Interaction between Helicobacter pylori infection and non-steroidal anti-inflammatory drugs on gastric epithelial cell apoptosis and proliferation: implication on ulcerogenesis. Aliment Pharmacol Ther. 2000; 14: 879-885
- Achtman, M., and S. Suerbaum. 2000. Sequence variation in Helicobacter pylori. Trends Microbiol. 8:57-58.
- Akada, J. K., M. Shirai, H. Takeuchi, M. Tsuda, and T. Nakazawa. 2000. Identification of the urease operon in Helicobacter pylori and its control by mRNA decay in response to pH. Mol. Microbiol. 36:1071-1084.
- Akhiani, A. A., J. Pappo, Z. Kabok, K. Schon, W. Gao, L. E. Franzen, and N. Lycke. 2002. Protection against Helicobacter pylori infection following immunization is IL-12-dependent and mediated by Th1 cells. J. Immunol. 169:6977-6984.
- Akin, O. Y., V. M. Tsou, and A. L. Werner. 1995. Gastrospirillum hominis-associated chronic active gastritis. Pediatr. Pathol. Lab. Med. 15:429-435.
- Akopyants, N. S., S. W. Clifton, D. Kersulyte, J. E. Crabtree, B. E. Youree, C. A. Reece, N. O. Bukanov, E. S. Drazek, B. A. Roe, and D. E. Berg. 1998. Analyses of the cag pathogenicity island of Helicobacter pylori. Mol. Microbiol. 28:37-53.
- Alamuri, P., and R. J. Maier. 2004. Methionine sulphoxide reductase is an important antioxidant enzyme in the gastric pathogen Helicobacter pylori. Mol. Microbiol. 53:1397-1406.
- Al-Ghoul, L., S. Wessler, T. Hundertmark, S. Kruger, W. Fischer, C. Wunder, R. Haas, A. Roessner, and M. Naumann. 2004. Analysis of the type IV secretion system-dependent cell motility of Helicobacter pylori-infected epithelial cells. Biochem. Biophys. Res. Commun. 322:860-866.
- Allaker, R. P., K. A. Young, J. M. Hardie, P. Domizio, and N. J. Meadows. 2002. Prevalence of Helicobacter pylori at oral and gastrointestinal sites in children: evidence for possible oral-to-oral transmission. J. Med. Microbiol. 51:312-317.
-
Vaira, D., P. Malfertheiner, F. Megraud, A. T. Axon, M. Deltenre, A. M. Hirschl, G. Gasbarrini, C. O’Morain, J. M. Garcia, M. Quina, and G. N. Tytgat. 1999. Diagnosis of Helicobacter pylori infection with a new non-invasive antigen-based assay. Lancet 354:30-33.641. Vakil, N., B. Hahn, and D. McSorley. 2000. Recurrent symptoms and gastro-oesophageal reflux disease patients with duodenal ulcer treated for Helicobacter pylori infection. Aliment. Pharmacol. Ther. 14:45-51
-
van der Hulst, R. W. M., E. A. J. Rauws, B. Köycü, J. J. Keller, F. J. W. ten Kate, J. Dankert, G. N. J. Tytgat, and A. van der Ende. 1997. Helicobacter pylori reinfection is virtually absent after successful eradication. J. Infect. Dis. 176:196-200.
-
Voland, P., M. Zeitner, N. Hafsi, and C. Prinz. 2006. Human immune response towards recombinant Helicobacter pylori urease and cellular fractions. Vaccine 24:3832-3839.
-
Waidner, B., S. Greiner, S. Odenbreit, H. Kavermann, J. Velayudhan, F. Stahler, J. Guhl, E. Bisse, A. H. M. van Vliet, S. C. Andrews, J. G. Kusters, D. J. Kelly, R. Haas, M. Kist, and S. Bereswill. 2002. Essential role of ferritin Pfr in Helicobacter pylori iron metabolism and gastric colonization. Infect. Immun. 70:3923-3929.
-
Wang, H. J., C. H. Kuo, A. A. Yeh, P. C. Chang, and W. C. Wang. 1998. Vacuolating toxin production in clinical isolates of Helicobacter pylori with different vacA genotypes. J. Infect. Dis. 178:207-212.
-
Wang, T. C., and J. G. Fox. 1998. Helicobacter pylori and gastric cancer: Koch’s postulates fulfilled? Gastroenterology 115:780-783