Ultimo aggiornamento 09/10/2024
L’induzione artificiale del parto è l’insieme di interventi medici, chirurgici e farmacologici, volti a determinare l’inizio e il mantenimento del travaglio di parto (1). E’ utilizzata nel 15-20% dei parti (1-4). Comprende sia la stimolazione dell’attività contrattile uterina che l’induzione della maturazione cervicale, intesa quest’ultima come l’insieme dei fenomeni che portano ad un cambiamento della posizione dell’orifizio uterino interno (centralizzazione), ad un rammollimento, raccorciamento e appianamento della portio (cervix ripening) ed alla successiva dilatazione dell’orificio uterino interno prima e di quello esterno poi (2-5).
Indicazioni: gravidanza pretermessa (67%), PROM (15%), diabete (8%), IUGR (5%), gestosi ipertensiva (5%).

Schematicamente abbiamo suddiviso l’induzione del parto in induzione naturale e artificiale; quest’ultima a sua volta è suddivisa in meccanica e farmacologica.
Induzione naturale del parto (cervical sweepening): non utilizza farmaci nè strumentazione e si può praticare tranquillamente dalla 39a settimana. Utilizza metodi soft naturali e prodotti di estrazione vegetale come:
- Agopuntura – L’agopuntura in campo ostetrico può essere impiegata nell’induzione del travaglio. Sembra stimolare le contrazioni uterine tramite la stimolazione del sistema nervoso parasimpatico e la stimolazione della secrezione endogena di ossitocina. I limitati studi osservazionali e randomizzati non consentono di trarre conclusioni circa la sua reale efficacia.Il suo impiego in travaglio risulta tuttavia sicuro e privo di effetti teratogeni (69). Gli aghi vengono applicati un po’ ovunque: due sulle mani, uno sulla pancia e sei tra le caviglie e i piedi. Da quanto si è visto finora, se l’agopuntura funziona il travaglio parte tra le 36 e le 48 ore, non oltre.
- Rescue Remedy o Five Flowers Remedy o fiori di Bach: una miscela di cinque fiori (Clematis, Impatiens, Rock Rose, Cherry Plum e Star of bethelhem). Dosaggio: 20 gocce x 3 volte al dì dalla 36a settimana di gestazione
- Stimolazione manuale del capezzolo: attiva un riflesso neurormonale (riflesso di Ferguson) che stimola a sua volta la secrezione di ossitocina endogena da parte dei nuclei ipotalamici sopraottico e paraventricolare. La stimolazione può essere effettuata manualmente dalla donna, dal compagno oppure attraverso la suzione se si ha già un bambino e si è in fase di allattamento. In alternativa può funzionare anche l’uso del tiralatte. I capezzoli vanno sfregati intensamente per periodi di 1 minuto intervallati da 2-3 minuti di pausa, complessivamente per 1-2 ore. Anche questa metodica è poco utilizzata nei protocolli clinici.
- Impacchi caldi: l’applicazione di impacchi molto caldi sul seno oppure di un getto di acqua molto calda stimola la produzione naturale dell’ossitocina (riflesso di Ferguson).
- Attività fisica: camminare, svolgere una moderata attività fisica, nuotare (preferibile lo stile rana) sono tutte attività che possono favorire l’induzione del parto a costo e rischio
 zero. Le lavandaie del contado napoletano, senza alcuna istruzione, consigliavano alle gravide a termine di effettuare il bucato, ovviamente a mano, sul lavatoio del cortile di casa per favorire l’inizio del travaglio di parto.
zero. Le lavandaie del contado napoletano, senza alcuna istruzione, consigliavano alle gravide a termine di effettuare il bucato, ovviamente a mano, sul lavatoio del cortile di casa per favorire l’inizio del travaglio di parto.
INDUZIONE ARTIFICIALE DEL PARTO – dovrebbe essere riservato solo ai casi di provata necessità e mai per comodità (“raccomandazioni per la nascita”, OMS, 1985) alla 41a settimana circa. L’induzione può fallire anche nella gestante con le condizioni apparentemente più favorevoli (pluriparità, Bishop score >6). E’ universalmente accettato che il sistema di punteggio di Bishop (>6) costituisce attualmente il principale parametro in grado di predire il successo dell’induzione al parto (2). 
La cervicometria, determinata con US vaginale, non sempre fornisce elementi validi di outcome, soprattutto se valutata isolatamente (3-15).
METODI NON FARMACOLOGICI
Possono essere utilizzati da soli o in associazione tra loro o ancora in associazione a metodi farmacologici. Tali metodi consistono nello scollamento delle membrane amniocoriali, nell’amnioressi e nella dilatazione meccanica della cervice uterina.
Scollamento manuale delle membrane amnio-coriali: consiste nell’inserzione di un dito profondamente nella cervice uterina fino a raggiungere l’orifizio uterino interno ed il polo inferiore delle membrane fetali che viene, quindi, meccanicamente separato circolarmente, fin dove è possibile,  dal segmento uterino inferiore (16-18).
dal segmento uterino inferiore (16-18).
Il traumatismo della manovra determina un aumento della liberazione locale, da parte delle membrane fetali e della cervice uterina, di prostaglandine PGE1, PGE2 e PGF2α (3). La liberazione di prostaglandine è correlata all’estensione dello scollamento è rapida, acuta e transitoria (2-6 ore).
L’avvenuto scollamento è confermato dalla scansione ecografica transvaginale che evidenzia un’area anecogena posta fra l’orificio uterino interno e la parte fetale presentata. Tale area appare di forma ellissoidale, semilunare: “moon sign” e precede il fenomeno del funneling (19-22).
Amnioressi: consiste nella rottura meccanicamente indotta delle membrane amniocoriali. Si pratica con l’ausilio di un dito di guanto uncinato o con una pinza di Kocker o con strumento apposito, detto amniotomo, metallico o monouso in polipropilene, che si introduce nel canale cervicale e con il quale si afferra, al di sotto della parte presentata fetale, e si lacera, il polo inferiore delle membrane in modo da consentire la fuoriuscita del liquido amniotico.  L’amniotomia ha diverse, importanti conseguenze:
L’amniotomia ha diverse, importanti conseguenze:
- Innanzitutto, la fuoriuscita del liquido amniotico provoca la discesa della parte presentata indipendentemente dalle contrazioni.
- consente di visualizzare direttamente la quantità ed il colore del liquido amniotico.
- similmente a quanto avviene nel caso dello scollamento manuale delle membrane, l’amnioressi determina un’aumentata liberazione locale di prostaglandine PGE1, PGE2 e PGF2α. Le prostaglandine (PG) esercitano un effetto maturativo sul collagene e sulla matrice extracellulare della cervice.
- Le manovre locali e l’iperproduzione locale di PG inducono un’aumentata secrezione di ossitocina (effetto Ferguson) (23-26).
Dilatazione cervicale con metodi meccanici: è stata una tecnica largamente usata nella pratica clinica prima dell’impiego delle prostaglandine. Attualmente sono poco usati, sia per la minor efficacia che per il maggior rischio di infezioni intrauterine.
- dilatazione cervicale manuale: effettuata con la forza delle dita dell’operatore introdotte nell’orificio uterino esterno. La manovra è efficace su un collo maturo ma frequentemente si osservano lacerazioni cervicali profonde specialmente in caso di portio non ancora matura.
- Catetere di Foley – La punta di un catetere di Foley n. 20 è inserita nel canale cervicale; si
 iniettano 20-30 cc di soluzione sterile per gonfiare il palloncino e bloccare il catetere che è lasciato in situ finchè viene espulso comunque non oltre 12 ore.
iniettano 20-30 cc di soluzione sterile per gonfiare il palloncino e bloccare il catetere che è lasciato in situ finchè viene espulso comunque non oltre 12 ore.
Confrontando i metodi meccanici rispetto al placebo e a nessun trattamento non si riscontrano differenze significative nella percentuale di parti vaginali entro 24 ore, nel numero dei cesarei e nelle complicanze materno-fetali. Quando il confronto è stato effettuato col gel di prostaglandine (sia intracervicale che vaginale) si è visto che con l’induzione farmacologica si aveva un maggior numero di parti entro le 24 ore ma un maggior numero di iperstimolazione uterina; nessuna differenza nelle percentuali di taglio cesareo. Le complicanze materno-fetali gravi sono risultate molto rare; le più comuni sono febbre durante il parto o post-partum e sanguinamento vaginale dopo l’inserzione. Meno frequenti sono la rottura delle membrane, lo spostamento della parte presentata e il prolasso del cordone ombelicale (27-32). Una variante tecnica prevede l’immissione, attraverso il lume dello stesso Foley, di 15 cc di soluzione salina nello spazio fra la punta del foley e le membrane amniocoriali; ovviamente occorrerà bloccare il foley con una pinza emostatica per evitare il deflusso della soluzione salina (33-35).
- Solo per completezza di esposizione, ricordiamo la dilatazione cervicale con candelette di Krause, laminarie e dilatatori cervicali di Kogan.
| MECCANICI | scollamento manuale delle membrane amnio-coriali |
| dilatazione digitale | |
| Foley | |
| Krause | |
| amnioressi | |
| Dilatatori cervicali di Kogan | |
| FARMACOLOGICI | ossitocina (Syntocinon® fl 5 UI) |
| dinoprostone, PGE2 (Prepidil® gel vaginale 1m, 2 mg) | |
| dinoprostone, PGE2 (Propess® dispositivo vaginale 10 mg) | |
| misoprostolo (Cytotec® cpr 200 μg, 400 μg) |
METODI FARMACOLOGICI
Consistono nell’utilizzo di farmaci a livello topico o sistemico, atti a portare alla maturazione cervicale e ad un’attività contrattile regolare. E’ possibile scolasticamente suddividere le metodiche, secondo il loro utilizzo nelle diverse condizioni del canale cervicale. Qualora, infatti, la cervice risulti “matura” la maggior parte dei protocolli di induzione del parto utilizza l’ossitocina; al contrario, quando la cervice è immatura si preferisce l’utilizzo di prostaglandine per via intracervicale o vaginale (36-46).
Ossitocina sintetica – è una delle più potenti sostanze uterotoniche finora conosciute. Oltre che il miometrio, l’ossitocina stimola la contrazione delle cellule mioepiteliali che circondano gli acini mammari ed i dotti escretori della mammella, favorendo, in tal modo, la lattazione. Al di fuori della gravidanza l’ossitocina è prodotta dall’ipotalamo e secreta in maniera pulsatile dalla neuroipofisi (44).
In gravidanza esistono altre due potenziali fonti di ossitocina: la neuroipofisi fetale, in cui è riscontrabile la presenza di ossitocina alla 16a settimana circa (35-46), la decidua uterina e le membrane amnio-coriali.
L’ossitocina, quindi, è un ormone che va ad agire non solo su utero e mammella ma è anche una sostanza ad azione paracrina e/o autocrina locale agendo sui tessuti bersaglio legandosi a recettori specifici localizzati sulla membrana cellulare, innescando all’interno della cellula una serie di eventi che portano all’aumento del calcio intracellulare. La risposta finale all’azione dell’ossitocina dipende dalla natura delle cellule bersaglio stesse; nel caso del miometrio è costituita dalla contrazione delle cellule muscolari liscie, nel caso delle cellule deciduali è costituita dalla liberazione di prostaglandine (38-42).
 Il principale organo bersaglio dell’ossitocina è l’utero, il quale, a livello del fondo e del corpo, contiene un gran numero di recettori che via via vanno diminuendo nel segmento uterino inferiore e nella cervice. Il legame dell’ossitocina determina un aumento del calcio intracellulare con stimolazione della secrezione di prostaglandine. A sua volta poi le prostaglandine stesse sono uno stimolo alla produzione di ossitocina nei tessuti, mantenendo così un meccanismo di stimolazione reciproca (riflesso di Ferguson) (40-42).
Il principale organo bersaglio dell’ossitocina è l’utero, il quale, a livello del fondo e del corpo, contiene un gran numero di recettori che via via vanno diminuendo nel segmento uterino inferiore e nella cervice. Il legame dell’ossitocina determina un aumento del calcio intracellulare con stimolazione della secrezione di prostaglandine. A sua volta poi le prostaglandine stesse sono uno stimolo alla produzione di ossitocina nei tessuti, mantenendo così un meccanismo di stimolazione reciproca (riflesso di Ferguson) (40-42).
Poco è noto circa i fattori coinvolti nella modulazione della secrezione di ossitocina da parte della neuroipofisi materna e fetale. Un fattore importante, favorente la stimolazione della secrezione materna durante il parto, sarebbe costituito dalla distensione della cervice e della vagina che determinerebbe un arco nervoso riflesso il quale raggiungerebbe la neuroipofisi attraverso il midollo spinale (riflesso di Ferguson). A livello autocrino, l’estradiolo a concentrazioni fisiologiche è capace di stimolare la sintesi e la liberazione di ossitocina da parte della decidua e del corion. Per contro il progesterone non avrebbe nessun effetto stimolatorio o inibitorio sulla secrezione di ossitocina da parte di questi tessuti. Il tempo di emivita dell’ossitocina è breve (3-15 minuti). La concentrazione fisiologica plasmatica di ossitocina in travaglio è di 1.5-2.4 microunità/ml ed aumenta con la progressione del travaglio ed è massimo durante il secondo stadio (35-46). 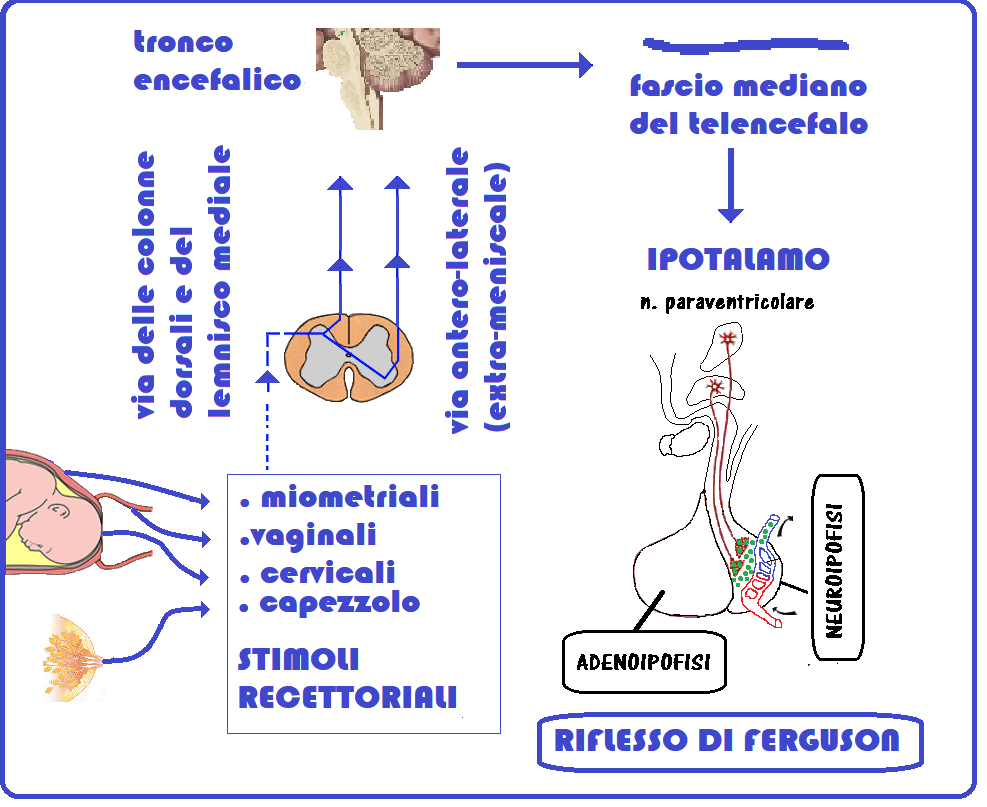
Nell’induzione del travaglio si inizia con Syntocinon 1 mU/minuto (4 gocce/minuto di soluzione glucosata o fisiologica da 500 cc contenente 5 Unità di ossitocina sintetica). In presenza di scarsa reattività miometriale dopo 20 minuti si può raddoppiare la dose ogni 20 minuti fino ad un massimo di 8 mU/minuto (32 gocce/min). Intensità e frequenza delle contrazioni uterine in genere aumentano con l’incremento delle dosi di OXT ma purtroppo aumenta anche il tono basale uterino con effetti negativi sull’irrorazione utero-placentare. Il protocollo migliore prevede dosi massime <4 mUI/minuto (16 gocce/min). Con 20 mUI/minuto (80 gocce/min) si supera il tono basale fisiologico miometriale di 15-18 mm Hg. L’uso prolungato di ossitocina, il sovradosaggio o un’infusione troppo rapida possono provocare blocco della diuresi materna, tachisistolia uterina, ipersistolia uterina, sovradistensione e rottura di utero, ipossia fetale, distress respiratorio fetale e morte fetale (24-32). La recente disponibilità di prostaglandine intracervicali (Dinoprostolo) ha permesso di utilizzare l’ossitocina per l’induzione di travaglio a dosaggi più bassi.
In linea generale le indicazioni e le controindicazioni all’impiego di ossitocina sono le stesse dell’induzione del parto. Gli effetti collaterali sono molto rari e in genere di lieve entità, quali: l’iperstimolazione uterina, dovuta ad una particolare sensibilità dell’utero per l’ossitocina, l’effetto antidiuretico, rilevabile solo quando vengono infuse quantità molto elevate (40-50 UI in bolo) (15), l’intossicazione da acqua ed ipertermia per eccessiva infusione di liquidi con i quali la sostanza è diluita. In rari casi l’ossitocina in bolo può causare rilasciamento della muscolatura liscia dei vasi con conseguenti ipotensione, tachicardia ed ipoperfusione coronaria.
Ossitocina sintetica e ossitocina naturale: l’ossitocina sintetica non supera la barriera emato-encefalica materna ma supera facilmente la barriera emato-encefalica fetale e sembra coinvolta nel meccanismo di insorgenza dell’autismo e lo sviluppo di caratteristiche caratteriali di aggressività del bambino (43-46).
Induzione con prostaglandine: le prostaglandine fanno parte di una numerosa famiglia di sostanze, gli eicosanoidi, che derivano dagli acidi grassi polinsaturi di origine alimentare ed in particolare. dall’acido arachidonico. Quest’ultimo, nell’organismo subisce un metabolismo ossidativo enzimatico molto complesso, comprendente tre principali vie: per opera della ciclossigenasi, viene convertito in prostaglandine, prostaciclina e trombossani; per opera delle lipossigenasi, viene convertito in acidi idrossieicosatraenoici, acidi idrossieicosatetraenoici e leucotrieni ed infine per opera della epossigenasi, viene convertito in epossidi attivi.
Le prostaglandine (PG) stimolano le contrazioni miometriali e inducono nella cervice uterina importanti modificazioni della sostanza fondamentale extracellulare: dissociazione del collagene ad opera dell’iperattività della collagenasi, aumento del contenuto di acqua e dei proteoglicani. Tutte queste modificazioni inducono, nell’arco di 24 ore, una progressione di 3.5 punti del cervical score di Bishop. Le prostaglandine agiscono sull’utero mediante stimolazione di recettori specifici di membrana. I meccanismi attraverso i quali le prostaglandine, in particolare la PGE2, determinerebbero gli eventi biomolecolari propri della maturazione cervicale sarebbero: una diminuzione della concentrazione del collagene nella cervice e una azione chemiotattica sui granulociti neutrofili che verrebbero, così, richiamati a livello cervicale (47-52).
Numerose formulazioni di PG sono attualmente utilizzate e generalmente la somministrazione topica è preferita a quella sistemica perchè quest’ultima con maggiore frequenza è causa di ipercontrattilità uterina, nausea, vomito, diarrea e iperpiressia. Restano ancora molte incertezze sul dosaggio ottimale e l’opportunità di ripetute somministrazioni vs. monosomministrazione (53-63).
- Prepidil® gel siringa pre-riempita da 1 mg e 2 mg (Dinoprostone, PGE2 gel intracervicale) -Utilizzata nell’induzione del parto alla 39-41a settimana di gravidanza con feto singolo, in presentazione cefalica ed assenza di alterazioni cardiotocografiche. La posologia prevede la somministrazione di una dose iniziale di 1 mg intracervicale o nel fornice posteriore. Dopo 6 ore può essere somministrata una seconda dose di 1-2 mg. Dopo 6 ore si può somministrare ossitocina ma mai contemporaneamente. Complicanze principali: nausea, vomito, diarrea e ipertono uterino. Rare ma gravissime complicanze possono essere la fibrinolisi (CID) e l’embolia di liquido amniotico (S. anafilattoide della gravidanza) soprattutto nelle gravide di età over 35 (54-57).
- Propess® dispositivo vaginale 10 mg (Dinoprostone, PGE2): posizionare il pessario nel fornice posteriore. Il pessario vaginale è costituito da una matrice polimerica (idrogel) sottile in cui sono dispersi 10 mg di dinoprostone che viene rilasciato ad una velocità costante compresa tra 0,3 e 0,4 mg/ora; è accelerata in caso di pH vaginale basico (>5) come in presenza di PROM, ma l’assorbimento è dimuito . In totale per un periodo di applicazione di 12 ore si liberano circa 4-5 mg di dinoprostone e quindi il dispositivo continua ad esercitare la sua funzione se lasciato in situ fino a 24 ore. Se dopo tale periodo lo stato di maturazione raggiunto dalla cervice è giudicato insufficiente, si deve provvedere alla rimozione del dispositivo vaginale. Si raccomanda un intervallo di almeno 30 minuti, dopo la rimozione del dispositivo vaginale, prima di procedere alla somministrazione sequenziale di ossitocina. L’intervallo di tempo fra applicazione di propess e parto è in media di 8 ore per le pluripare e di 20 ore per le nullipare. La somministrazione di PGE2 intravaginale sembra dotata di maggiore efficacia e semplicità di applicazione, in genere basta una sola applicazione, può essere rimosso facilmente e rapidamente dalla vagina in caso di complicazioni, ma è gravata di maggiori effetti collaterali negativi rispetto alla via intracervicale (58-63). Poiché l’inserto vaginale contiene un serbatoio di 10 mg di PGE2, si ipotizza che i problemi siano legati al fatto che ci sia un picco di rilascio iniziale di PGE2 troppo elevato in un periodo di tempo troppo breve (cosiddetta “dose dumping”). Al contrario con il dispositivo intravaginale si osservano con più frequenza casi di non-responders in cui occorre rimuovere i dispositivi vaginali e utilizzare il gel intracervicale (64-66).
Relaxina gel vaginale, Relaxina compresse masticabili (67,68):
References:
- American College of Obstetricians and Gynecologists: Induction and augmentation of labor. ACOG Technical Bulletin 157. Washington, D.C.: ACOG, 1991
- Bishop EH. Pelvic scoring for elective induction. Obstet Gynecol 1964; 24:266-8
- Williams MC, Krammer J, O’Brien WF. The value of the cervical score in predicting successful outcome of labor induction. Obstet Gynecol 1997;90: 784–789.
- Sujata Chandra, Donna Hutchens, David C Young, Joan M.G Crane: Transvaginal ultrasound and digital examination in predicting successful labor induction. Obstetrics & Gynecology Volume 98, Issue 1, July 2001, Pages 2–6
- Ann S. Hatfield, Luis Sanchez-Ramos, Andrew M. Kaunitz: Sonographic cervical assessment to predict the success of labor induction: a systematic review with metaanalysis. American Journal of Obstetrics and Gynecology. Volume 197, Issue 2, August 2007, Pages 186–192
- Rozenberg P, Chevret S, Chastang C and Ville Y: Comparison of digital and ultrasonographic examination of the cervix in predicting time interval from induction to delivery in women with a low Bishop score. BJOG 14 December 2004 DOI: 10.1111/j.1471-0528.2004.00549.x
- Ventura SJ, Martin JA, Curtin SC, Mathews TJ. Report of final natality statistics, 1996. Mon Vital Sta Rep1998;46: 1–99.
- Paterson-Brown S, Fisk NM, Edmonds DK, Rodeck CH. Preinduction cervical assessment by Bishop’s score and transvaginal ultrasound. Eur J Obstet Gynecol Reprod Biol 1991;40: 17–23.
- Ware V, Raynor BD. Transvaginal ultrasonographic cervical measurement as a predictor of successful labor induction. Am J Obstet Gynecol 2000;182: 1030–1032.
- Pandis GK, Papageorghiou AT, Ramanathan VG, Thompson MO, Nicolaides KH. Preinduction sonographic measurement of cervical length in the prediction of successful induction of labor. Ultrasound Obstet Gynecol 2001;18: 623–628.
- Gabriel R, Darnaud T, Chalot F, Gonzalez N, Leymarie F, Quereux C. Transvaginal sonography of the uterine cervix prior to labor induction. Ultrasound Obstet Gynecol 2002;19: 254–257.
- Boozarjomehri F, Timor-Tritsch I, Chao CR, Fox HE. Transvaginal ultrasonographic evaluation of the cervix before labor: presence of cervical wedging is associated with shorter duration of induced labor. Am J Obstet Gynecol 1994;171: 1081–1087.
- Gonen R, Degani S, Ron A. Prediction of successful induction of labor: comparison of transvaginal ultrasonography and the Bishop score. Eur J Ultrasound 1998;7: 183–187
- Chandra S, Crane JM, Hutchens D, Young DC. Transvaginal ultrasound and digital examination in predicting successful labor induction. Obstet Gynecol 2001;98: 2–6.
- Graf JL, Bealer JF, Gibbs DL, Adzick NS, Harrison MR. Chorioamniotic membrane separation: a potentially lethal finding. Fetal Diagn Ther 1997; 12: 81–84.
- R. Devlieger, S. A. Scherjon†, D. Oepkes†, R. Meerman†, D. Timmerman and F. P. H. A. Vandenbussche: Ultrasound visualization of fetal membrane detachment at the uterine cervix: the ‘moon sign’ Ultrasound Obstet Gynecol 2003; 22: 431–436
- Ortiz JU, Eixarch E, Peguero A, Lobmaier SM, Bennasar M, Martinez JM, Gratacós E. Chorioamniotic membrane separation after fetoscopy in monochorionic twin pregnancy: incidence and impact on perinatal outcome. Ultrasound Obstet Gynecol. 2016 Mar; 47(3):345-9. Epub 2016 Feb 4.
- Egawa M, Hayashi S, Yang L, Sakamoto N, Sago H. Chorioamniotic membrane separation after fetoscopic laser surgery for twin-twin transfusion syndrome. Prenat Diagn. 2013 Jan; 33(1):89-94. Epub 2012 Nov 29.
- Patel S, Korst LM, Llanes A, Lee RH, Ouzounian JG, Chmait RH. Chorioamniotic membrane separation over the cervical os (“moon sign”) in twin-twin transfusion syndrome. J Ultrasound Med. 2014;33(7):1147-54.
- Devlieger R, Scherjon SA, Oepkes D, Meerman R, Timmerman D, Vandenbussche FP. Ultrasound visualization of fetal membrane detachment at the uterine cervix: the ‘moon sign’. Ultrasound Obstet Gynecol. 2003 Oct;22(4):431-2.
- Rozenberg P, Gillet A, Ville Y. Transvaginal sonographic examination of the cervix in asymptomatic pregnant women: review of the literature. Ultrasound Obstet Gynecol 2002; 19: 302–311.
- McColgin SW, Bennett WA, Roach H. Parturitional factors associated with membrane stripping. Am J Obstet Gynecol 1993; 169:71-7
- Howarth GR, Botha DJ. Amniotomy plus intravenous oxytocin for induction of labour. Cochrane Database Syst Rev. 2001; (3):CD003250.
- Thornton S, Davison JM, Baylis PH. Amniotomy induced labour is not mediated by endogenous oxytocin. Br J Obstet Gynaecol 1989; 96:974-8
- Boulvain M, Kelly A, Lohse C, et al. Mechanical methods for induction of labour. Cochrane Database Syst Rev. 2003
- Ezimokhal M., Nwabineli JN THE USE OF FOLEY’S CATHETER IN RIPENING THE UNFAVOURABLE CERVIX PRIOR TO INDUCTION OF LABOUR. Br J Obstet Gynaecol 1980; 87 : 281.
- Embrey MP, Mollison BG. The unfavourable cervix and induction of labour using a cervical balloon. J Obstet Gynaecol Br Common W 1967; 74 : 44.
- Atad J, Bornstein J, Calderon I, et al. Nonpharmaceutical ripening of the unfavourable cervix and induction of labour by a novel double balloon device obstet. Gynecol 1991; 77 : 146.
- James C, Peedicayil S, Seshadri L. Use of Foley catheter as a cervical ripening agent prior to induction of labour. Int J Gynaecol Obstet 1994; 47 : 229.
- Sherman DJ, Frenkel E, Tovbin J, et al. Ripening of the unfavourable cervix with extra amniotic catheter balloon; clinical experience and review. Obstet Gynecol Surv 1996; 51 : 621-7.
-
Delaney, Shani MD; Shaffer, Brian L. MD; Cheng, Yvonne W. MD, MPH; Vargas, Juan MD; Sparks, Teresa N. MD; Paul, Kathleen MPH; Caughey, Aaron B. MD, PhD Labor Induction With a Foley Balloon Inflated to 30 mL Compared With 60 mL: A Randomized Controlled Trial. Obstetrics & Gynecology: June 2010 – Volume 115 – Issue 6 – pp 1239-1245 - Schreyer P, Sherman DJ, Ariel S, et al. Ripening the highly unfavourable cervix with extraamniotic saline installation or vaginal PGE2 application. Obstet Gynaecol 1989; 73 : 938.
- Lyndrup J, Nickelsen E, Weber T, et al. Induction of labour by balloon catheter with extra amniotic saline infusion (BCEAS). A randomized comparison with PGE2 vaginal pessaries. Eur J Obstet Gynecol Reprod Biol 1994; 53 : 189.
- Yaron Y, Kupferminc MJ, Peyser MR. Ripening of the unfavourable cervix with extra amniotic saline instillation Israel. J Obstet Gynecol 1992; 3 (Suppl) : 12.
- Husslein P, Kofler E, Rasmussen AB. Oxytocin and the initiation of human parturition. Plasma concentrations of oxytocin and 13, 14 dehydro-15-keto- prostaglandin F2α during induction of labor by artificial rupture of membranes. Am J Obstet Gynecol 1983; 147:503-7
- Nagata I, Kato K, Makimura N. Comparison of plasma oxytocin levels during spontaneous labour and labor induced by amniotomy, prostaglandin F2α, and prostaglandin E2. Am J Obstet Gynecol 1983; 147:259-66,
- Petrie RH. The pharmacology and use of oxytocin. Clin Perinatol 1981; 8:35-47
- Fuchs AR, Fuchs F, Husslein P. Oxytocin receptors and human parturition: a dual role for oxytocin in the initiation of labour. Science 1982; 215:1396-8
- Chibbar R, Wong S, Miller FD, et al. Estrogen stimulates oxytocin gene expression in human chorio-decidua. J Clin Endocrinol Metab 1995; 80:567-72
- American College of Obstetricians and Gynecologists: Induction of labor. ACOG Technical Bulletin 217. Int J Gynecol Obstet 1996; 53:65-72
- Kelly AJ, Tan B. Intravenous oxytocin alone for cervical ripening and induction of labour. Cochrane Database Syst Rev. 2001
- Whalley PJ, Pritchard JA. Oxytocin and water intonication. JAMA 1963; 186:601-3,
- Stubbs TM Oxytocin for labor induction. Clin Obstet Gynecol. 2000 Sep;43(3):489-94.
- Mercer B, Pilgrim P, Sibai B. Labor induction with continuous low-dose oxytocin infusion: a randomized trial. Obstet Gynecol. 1991 May;77(5):659-63.
- Satin AJ, Hankins GD, Yeomans ER. A prospective study of two dosing regimens of oxytocin for the induction of labor in patients with unfavorable cervices. Am J Obstet Gynecol. 1991 Oct; 165(4 Pt 1):980-4.
- Abelantado JM, Lopez Bernal A, Turnbull AC. Topographical distribution of prostaglandin E receptors in human myometrium. Br J Obstet Gynecol 1988; 95:348-53
- Coleman RA, Kennedy I, Humphrey PR. Prostanoids and their receptors. In: Comprehensive Medicinal Chemistry. Hausch C, Sammes PG, Taylor JB. (eds.) Vol 3. Pergamon Press, New York 643-714, 1989
- Uldbierg N, Ekman G, Malmström A. L. Biochemical changes in human cervical connective tissue after local application of prostaglandin E2. Obstet Gynecol Invest 1983; 15:1-9
- Hofmeyr GJ, Gulmezoglu AM. Vaginal misoprostol for cervical ripening and induction of labour. Cochrane Database Syst Rev. 2003
- Chioss G, Costantine MM, Bytautiene E, Betancourt A, Hankins GD, Saade GR, Longo M. In vitro myometrial contractility profiles of different pharmacological agents used for induction of labor. Am J Perinatol. 2012 Oct; 29(9):699-704. Epub 2012 May 29.
- Brindley BA, Sokol RJ. Induction and augmentation of labor: basis and methods for current practice. Obstet Gynecol Surv. 1988 Dec; 43(12):730-43
- Hofmeyr GJ, Gülmezoglu AM, Alfirevic Z Misoprostol for induction of labour: a systematic review. Br J Obstet Gynaecol. 1999 Aug; 106(8):798-803.
- William F. Rayburn Prostaglandin E2 gel for cervical ripening and induction of labor: A critical analysis. American Journal of Obstetrics and Gynecology. Volume 160, Issue 3, March 1989, Pages 529-534
- Frank J. Chuck: Labor induction with intravaginal misoprostol versus intracervical prostaglandin E2 gel (Prepidil gel): Randomized comparison. American Journal of Obstetrics and Gynecology. Volume 173, Issue 4, October 1995, Pages 1137-1142.
- Wiqvist I, Norstrom A, Wiqvist N: Induction of Labor by Intra-Cervical Pge2 in Viscous Gel: Mechanism of Action and Clinical Treatment Routines. AOGS 1986;65,5:485–492.
- Kelly AJ, Malik S, Smith L, Kavanagh J, Thomas J: Vaginal prostaglandin (PGE2 and PGF2a) for induction of labour at term. Article first published online: 7 October 2009
- ZANINI, A GHIDINI, A NORCHI, S BERETTA, E; CORTINOVIS, I BOTTINO, S Pre-Induction Cervical Ripening With Prostaglandin E2 Gel: Intracervical Versus Intravaginal Route. Obstetrics & Gynecology: October 1990
- Grignaffini A, Soncini E, Anfuso S, Ronzoni E: Dinoprostone: slow release vaginal insert (Propess) and intracervical gel (Prepidil) for the induction of labour with unriped cervix. Minerva Ginec 2004;56,5:413-418.
- Ekman G · Uldbjerg N.· Malmström A. · Ulmsten U. Increased Postpartum Collagenolytic Activity in Cervical Connective Tissue from Women Treated with Prostaglandin E2. Gynecol and Obstetric Investigation 1983, Vol.16, No. 5.
- Zarko Alfirevic et al: Labour induction with prostaglandins: a systematic review and network meta-analysis. BMJ 2015; 350
- Sven Lyrenas, Ingerged Clason, Ulf Ulmsten: n vivo controlled release of PGE2 from a vaginal insert (0.8 mm, 10 mg) during induction of labour. BJOG 2001;108,2: 169–178
- Taylor A.V.G., Boland J., Bernal A.L., MacKenzie I.Z.. Prostaglandin metabolite levels during cervical ripening with a controlled release hydrogel polymer prostaglandin E2 pessary. Prostaglandins 1991;41: 585–594.
- Khouzan M., Ledward R.. Difficulties with controlled release prostaglandin E2 pessaries [letter]. Lancet1990;336: 119.
- Westgate J., Williams A.. Evaluation of a controlled release vaginal prostaglandin E2 pessary with a retrieval system for the induction of labour. J Obstet Gynaecol 1994;14: 146–150.
- Rayburn W., Wapner R., Vanessa B., Spitzberg E., Molina R., Mandsager N., Yonekura L.. An intravaginal controlled release prostaglandin E2 pessary for cervical ripening and induction of labor at term. Obstet Gynecol 1992;79: 374–379.
- MacLennan AH, Green RC, Bryant-Greenwood GD, Greenwood FC, Seamark RF. Cervical ripening with combinations of vaginal prostaglandin F2-alpha estradiol, and relaxin. Obstet Gynecol. 1981;58(5):601-4.
- Ripening of the human cervix and induction of labor with intracervical purified porcine relaxin. MacLennan AH, Green RC, Grant P, Nicolson R.Obstet Gynecol. 1986 Nov; 68(5):598-601.
-
Smith C, Crowther C. “Acupuncture for induction of labour”. The Cochrane Library, Issue 1, 2004
- NICE Induction of labour. Clinical guideline 70 «nice.org.uk», luglio 2008
- Foong LC, Vanaja K, Tan G, Chua S, Membrane sweeping in conjunction with labor induction, «Obstet Gynecol.», ottobre 2000; 96(4):539-42. doi: 10.1016/s0029-7844(00)00995-9. PMID: 11004355
- Bricker L, Luckas M. Amniotomy alone for induction of labour, «Cochrane Systematic Reviews», 2000; 4:CD002862
- Mozurkewich EL, et al., Methods of induction of labour: a systematic review, «BMC Pregnancy and Childbirth», 2011; 27(11):84