- il feto ha proprietà immunogene, previene la ricognizione e quindi il rigetto da parte del sistema immunintario materno
- risposta immunitaria materna non è depressa ma specificamente modulata per evitare il rigetto dell’impianto fetale e si attua con meccanismi locali e sistemici (7,8);
- l’utero non rappresenta un sito “immunoprivilegiato”, essendo nota la possibilità di attecchimento della gravidanza anche in sedi extra-uterine (7,8).
- la barriera placentare non cosituisce un muro di separazione inerte e passivo, quanto piuttosto un alveare, un
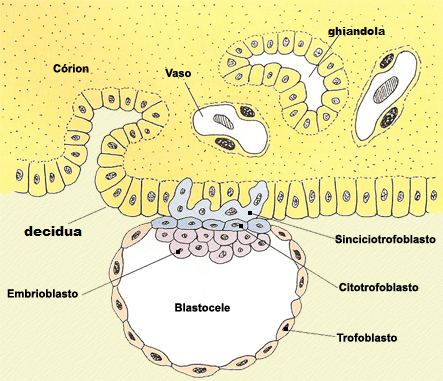
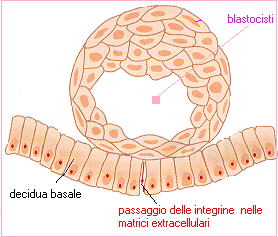 “campo di battaglia” di fenomeni reattivi e fenomeni di tolleranza immunitaria capaci di distinguere l’organismo fetale da organismi ostili (9,10). La placenta (dal greco πλακοῦς = schiacciata, focaccia) è una complessa struttura morfo-funzionale deputata alla regolazione degli scambi gassosi e nutritivi materno-fetali. Inoltre a livello placentare avvengono importanti modificazioni della risposta immunitaria in seguito all’annidamento dell’embrione. La formazione della placenta inizia poco dopo l’attecchimento embrionale, al 10° giorno circa dalla fecondazione ma gli scambi nutrizionali materno-fetali iniziano dal 19° circa quando iniziano a formarsi i vasi sanguigni fetali nella placenta. Il corion è la componente fetale della placenta ed è costituito da 3 tipi cellulari: il sinciziotrofoblasto (detto anche corion villoso o chorion frondosum) è a diretto contatto e dentro la decidua (la componente materna della placenta), il citotrofoblasto è posto medialmente fra il sinciziotrofoblasto e il disco embrionale mentre il trofoblasto (detto anche corion liscio o corion calvo o chorion laeve) circonda il blastocele e con il progredire della gravidanza aderisce alla decidua.
“campo di battaglia” di fenomeni reattivi e fenomeni di tolleranza immunitaria capaci di distinguere l’organismo fetale da organismi ostili (9,10). La placenta (dal greco πλακοῦς = schiacciata, focaccia) è una complessa struttura morfo-funzionale deputata alla regolazione degli scambi gassosi e nutritivi materno-fetali. Inoltre a livello placentare avvengono importanti modificazioni della risposta immunitaria in seguito all’annidamento dell’embrione. La formazione della placenta inizia poco dopo l’attecchimento embrionale, al 10° giorno circa dalla fecondazione ma gli scambi nutrizionali materno-fetali iniziano dal 19° circa quando iniziano a formarsi i vasi sanguigni fetali nella placenta. Il corion è la componente fetale della placenta ed è costituito da 3 tipi cellulari: il sinciziotrofoblasto (detto anche corion villoso o chorion frondosum) è a diretto contatto e dentro la decidua (la componente materna della placenta), il citotrofoblasto è posto medialmente fra il sinciziotrofoblasto e il disco embrionale mentre il trofoblasto (detto anche corion liscio o corion calvo o chorion laeve) circonda il blastocele e con il progredire della gravidanza aderisce alla decidua.
1) autoimmunizzazione materno-fetale: è la reazione del sistema immunitario della madre contro i globuli rossi del feto che ha un gruppo sanguigno diverso. Scatta per esempio quando la madre appartiene al gruppo Rh negativo e il feto presenta un gruppo Rh positivo ereditato dal padre. In genere la prima gravidanza si svolge senza problemi perchè grazie alla barriera rappresentata dalla placenta, il contatto tra i due gruppi sanguigni incompatibili avviene di fatto solo al momento del parto. In ulteriori gravidanze, però, gli anticorpi specifici contro il fattore Rh positivo della madre possono oltrepassare la placenta e causare emolisi ed anemia fetale, idrope e anasarca fetale. A scopo preventivo, si ricorre alla somministrazione di immunoglobuline specifiche alla madre subito dopo il parto o un aborto, IVG, minaccia di aborto (2).
2) Malattie autoimmuni: La madre, comunque, può trasmettere al feto una malattia autoimmune come il m. di Basedow, lupus (10-13), soprattutto se la madre presenta un particolare anticorpo chiamato anti-Ro, piuttosto frequente anche in un’altra malattia autoimmune, la malattia di Sjögren. Il lupus è considerato attualmente una delle più frequenti cause di aborto ripetuto spontaneo insieme anomalie cromosomiche fetali, trombofilia e malformazioni uterine (10-13).
3) Gestosi ipertensiva: Si ritiene possa avere un’origine immunologica anche un’altra complicanza della gravidanza, la preeclampsia o tossiemia gravidica, che comporta ipertensione parossistica, edemi e proteinuria, e può assumere evoluzioni drammatiche, fino alla morte fetale e/o della madre. L’ipotesi immunologica chiama in causa una mancata vasodilatazione e mancata invasione trofoblastica delle arteriole spirali e radiali per deficit della PGI2. Recenti studi hanno confermato l’esistenza di una predisposizione genetica alla preeclampsia associata all’antigene HLA DR4. La spiegazione può essere che vi sia un “linkage” fra HLA DR4 e gene della pre-eclampsia e Deficit delle cellule T con conseguente compromissione della risposta immunitaria materna (14).
- M. Govoni, G. Castellino, S. Giacuzzo, R. Capucci, F. Trotta: “Il SISTEMA IMMUNITARIO IN GRAVIDANZA:MODIFICAZIONI, ADATTAMENTI E RISPOSTE PATOLOGICHE”.Riv. It. Ost. Gin. -2006 -Vol. 10: 504
- Monochio F: “Immunologia della gravidanza e sua valutazione in laboratorio”. Riv Med Lab – JLM, Vol. 2, N. 4, 2001 (SIRSE Srl ed.)
- Kammerer U, von Wolff M, Markert UR. Immunology of human endometrium. Immunobiology 2004, 209: 569-74
- Tellin O, Coumans B, Zorzi W, et al. Tolerance to the foeto-placental ‘graft’: ten ways to support a child for nine months. Curr Opin Immunol 2000; 12: 731-7
- Erlebacher A. Why isn’t the fetus rejected ? Curr Opin Immunol 2001; 13: 590-3
- Loke YW, King A, Burrows TD. Decidua in human implantation. Hum Reprod 1995; 10 (suppl. 2); 14-21
- Skin DW, Murgita RA. Specific maternal anti-fetal lymphoproliferative responses and their regulation by natural immunosuppressivefactors. Clin Exp Immunol 1989; 76: 262-7
- Sacks G, Sargent I, Redman C. An innate view of human pregnancy. Immunol Today 1999; 20: 114-8
- Petraglia F, Florio P, Nappi C, et al. Peptide signalling in human placenta and membranes: autocrine, paracrine, and endocrine mechanisms.Endocr Rev 1996; 17: 156-86
- Y.J. Meir, L. Fischer Tamaro, N. Di Giusto, G. D’Ottavio e G. P.Mandruzzato: Aborto ripetuto immunologico (Atti SIGO, Congresso Napoli 2000; Fratelli Ferraro Editore, SRL; pagg 165-174).
- Franklin RD, Kutteh WH. “Antiphospholipid antibodies (APA) and recurrent pregnancy loss: treating a unique APA positive population”. Hum Reprod. 2002 Nov;17(11):2981-5.
- Backos M, Rai R, Baxter N, Chilcott IT, Cohen H, Regan L.: “Pregnancy complications in women with recurrent miscarriage associated with antiphospholipid antibodies treated with low dose aspirin and heparin”.Br J Obstet Gynaecol. 1999 Feb;106(2):102-7.
- Bulla R, Fischetti F, Bossi F, et al. Feto-maternal immune reaction at the placental level. Lupus 2004; 13: 625-9
- Bulla R, Fischetti F, Bossi F, et al. Feto-maternal immune reaction at the placental level. Lupus 2004; 13: 625-9
- Gleicher N, Siegel I.: “The immunologic concept of EPH-gestosis”. Prog Clin Biol Res. 1981; 70:229-43.
- ing A, Boocock C, Sharkey AM, et al. Evidence for the expression of HLA-C class I mRNAand protein by human first trimester trophoblast. J Immunol 1996; 156: 2068-76
- King A, Burrows TD, Hiby DE, et al. Surface expression of HLA-C antigen by human extravillous trophoblast. Placenta 2000; 21: 376-87
- Proll J, Blaschitz A, Hutter H, et al. First trimester human endovascular trophoblast cell express both HLA-C and HLA-G. Am J Reprod Immunol 1999; 42: 30-6
- Ellis SA, Sargent IL, Redman CW, et al. Evidence for a novel HLA antigen found on human extravillous trophoblast and a choriocarcinoma cell line. Immunology 1986; 59: 595-601
- Pazmany L, Mandelboim O, Vales-Gomez M, et al. Protection from natural killer cell-mediated lysis by HLA-G expression on target cells. Science 1996; 274: 792-5
- Munz C, Holmes N, King A, et al. Human hystocompatibility leucocyte antigen (HLA)-G molecules inhibit NKAT3 expressing natural killer cells. J Exp Med 1997; 185: 385-91
- Rouas-Freiss N, Lockwood CJ, Ma Y, et al. Direct evidence to support the role of HLA-G in protecting the fetus from maternal uterine natural killer cytolysis. Proc Natl Acad Sci USA. 1997; 94: 11520-5
- Solderstrom K, Corliss B, Lanier LL, et al. CD94/NKG2 is the predominant inhibitory receptor involved in the recognition of HLA-G by decidual and peripheral blood NK cells. J Immunol 1997; 159: 1072-5
- Moreau P, Paul P, Rouas-Freiss N, et al. Molecular and immunologic aspects of the nonclassical HLA class I antigen HLA-G: evidence for an important role in the maternal tolerance of the fetal allograft. Am J Reprod Immunol 1998; 40: 136-44
- Rieger L, Hofmeister V, Probe C, et al. Th1- and Th2-like cytokine production by first trimester decidual large granular lymphocytes is influenced by HLA-G and HLA-E. Mol Hum Reprod 2002; 8: 255-61
- Dorling A, Monk N, Lechler R. HLA-G inhibits the transendothelial cell migration of human NK cells: a strategy for inhibiting xenograft rejection. Transplan Proc 2000; 32: 938
- King A, Allan DS, Bowen M, et al. HLA-E is expressed on trophoblast and interacts with CD94/NKG2 receptors on decidual NK cells. Eur J Immunol 2000; 30: 1623-31
- Braud VM, Allan DS, O’Callaghan CA, et al. HLA-E binds to natural killer cell receptors CD94/NKG2A, B and C. Nature 1998; 391: 795-9
- Mandelboim O, Pazmany L, Davis DM, et al. Multiple receptors for HLA-G on human natural killer cells. Proc Natl Acad Sci USA 1997; 94: 14666-70
- Bulmer JN, Morrison L, Longfellow M, et al. Granulated lymphocytes in human endometrium: histochemical and immunohistochemical studies. Hum Reprod 1991; 6: 791-8
- Ozenci CC, Korgun ET, Demir R. Immunohistochemical detection of CD45+, CD56+, and CD14+ cells in human deciduas during early pregnancy. Early Pregnancy 2001; 5: 164-75
- 29. Dosiou C, Giudice LC. Natural killer cells in pregnancy and recurrent pregnancy loss: endocrine and immunologic perspectives. Endocrine Reviews 2005; 26: 44-62
- 30. Kodama T, Hara T, Okamoto E, et al. Characteristic changes of large granular lymphocytes that strongly express CD56 in endometrium during menstrual cycle and early pregnancy. Hum Reprod 1998; 13: 1036-43
- Ponte M, Cantoni C, Biassoni R, et al. Inhibitory receptors sensing HLA-G1 molecules in pregnancy: deciduas-associated natural killer cells express LIR-1 and CD94/NKG2A and acquire p49, an HLA-G1-specific receptor. Proc Natl Acad Sci USA 1999; 96: 5674-9
- Hiby SE, King A, Sharkey AM, et al. Human uterine NK cells have a similar repertoire of killer inhibitory and activatory receptors to those found in blood, as demonstrated by RT-PCR and sequencing. Mol Immunol 1997; 34: 419-30
- Verma S, King A, Loke YW. Expression of killer cell inhibitory receptors on human uterine natural killer cells.Eur J Immunol 1997; 27: 979-83




1 commento
I am curious to find ouut what blog platform youu happen tto be utilizing?
I’m experiencing some minor security issues with my latest website and I would like to find something more safeguarded.
Do you ave any solutions?