Ultimo aggiornamento 2021-09-11 15:22:32
L’idrope fetale è un accumulo patologico di liquido in almeno due tessuti molli o cavità sierose fetali. Si manifesta clinicamente come edema sottocutaneo, idrotorace, idropericardio e ascite frequentemente associati a polidramnios, ed aumento dello spessore placentare. Fu descritta per la prima volta da Potter nel 1943 (1). In caso di idrope estesa a quasi tutti gli organi si parala di anasarca fetale.
Frequenza: 1/3.000 gravidanze ma il calcolo è sicuramente sottostimato perchè le gravidanza affette da tale patologia spesso esitano in aborto spontaneo o morte fetale intrauterina.
Etiologia: la causa può essere immunologica (10%), non immunologica (60%) o idiopatica (30%), a seconda della presenza o assenza di anticorpi materni contro gli antigeni presenti sugli eritrociti fetali Rh+.
1. Immunologica: fino ad alcuni decenni fa la maggioranza dei casi (70%) di idrope fetale era secondaria ad  incompatibilità di gruppo sanguigno materno-fetale ma dopo i programmi di prevenzione efficaci, l’etiologia non immunologica costituisce la maggioranza dei casi. L’idrope fetale ad etiologia immunologica (attualmente 10% dei casi) è il risultato di incompatibilità materno-fetale per il gruppo sanguigno: madre Rh negativo e feto Rh positivo. La gravida sviluppa anticorpi anti-Rh materni, a seguito del contatto con delle emazie fetali Rh+ (<3 µl) con il sangue materno Rh-. Tali anticorpi attraversano la placenta e passano nel sistema circolatorio fetale causando emolisi e conseguente anemia fetale. Gli anticorpi materni attaccano e distruggono i globuli rossi del feto: la possibile conseguenza è l’anemia, nota come malattia emolitica del feto, che nei casi più gravi può arrivare a causare morte endouterina. In caso di prima gravidanza c’è un 16% di rischio che gli anticorpi anti-D materni passino la barriera placentare. In una successiva gravidanza, se il feto è ancora Rh positivo, si verifica una più rapida risposta immunitaria con produzione di elevati titoli di anticorpi IgG anti-D che, attraversata la placenta provocano emolisi ed anemia fetale che, nel 20% dei casi, può rivelarsi molto grave fino a provocare idrope, anasarca e morte fetale.
incompatibilità di gruppo sanguigno materno-fetale ma dopo i programmi di prevenzione efficaci, l’etiologia non immunologica costituisce la maggioranza dei casi. L’idrope fetale ad etiologia immunologica (attualmente 10% dei casi) è il risultato di incompatibilità materno-fetale per il gruppo sanguigno: madre Rh negativo e feto Rh positivo. La gravida sviluppa anticorpi anti-Rh materni, a seguito del contatto con delle emazie fetali Rh+ (<3 µl) con il sangue materno Rh-. Tali anticorpi attraversano la placenta e passano nel sistema circolatorio fetale causando emolisi e conseguente anemia fetale. Gli anticorpi materni attaccano e distruggono i globuli rossi del feto: la possibile conseguenza è l’anemia, nota come malattia emolitica del feto, che nei casi più gravi può arrivare a causare morte endouterina. In caso di prima gravidanza c’è un 16% di rischio che gli anticorpi anti-D materni passino la barriera placentare. In una successiva gravidanza, se il feto è ancora Rh positivo, si verifica una più rapida risposta immunitaria con produzione di elevati titoli di anticorpi IgG anti-D che, attraversata la placenta provocano emolisi ed anemia fetale che, nel 20% dei casi, può rivelarsi molto grave fino a provocare idrope, anasarca e morte fetale.
Gli anticorpi materni, di solito sono del tipo anti-D o, in misura minima, anti-C, anti-E o anti-M.
2. Non immunologica:
- Gravidanze gemellari: sindrome da trasfusione intergemellare (twin-twin transfusion sindrome, TTTS), tipica della gemellarità monocoriale, anche se non è impossibile anche in quella bicoriale ed è legata ad una anomala comunicazione fra arterie e vene che si verificano a livello placentare tra i due circoli fetali (11,12). Un feto diventa donatore e l’altro ricevente. Il primo, quindi, presenta anemia, difetto di crescita, oligoamnios mentre il secondo diventa macrosomico, poliglobulico e con polidramnios. Il feto IUGR può facilmente sviluppare idrope che può colpire, ramente, anche il feto macrosomico. La TTTS viene sospettata ecograficamente quando si osserva una discrepanza nel peso fetale superiore al 20% del peso calcolato al gemello più grande, associata ad alterazioni della quantità di liquido amniotico e ad alterazioni flussimetriche dell’arteria ombelicale (2,3,16).
- Patologie cardiovascolari fetali: aritmie, tachiaritmie a cui si può porre rimedio somministrando alla gravida farmaci antiaritmici (6), blocco S-A o A-V, cuore sinistro ipoplasico, anomalia di Ebstein, stenosi aortica o polmonare, sindrome cardio-splenica, insufficienza valvolare, canale atrio-ventricolare, ventricolo singolo, tetralogia di Fallot, prematura chiusura del forame ovale o del dotto arterioso di Botallo (da assunzione materna di indometacina), agenesia del dotto venoso di Aranzio (6,14,18).
- Ernia diaframmatica fetale
- Chilotorace congenito da difettoso drenaggio linfatico (19)
- Ipoplasia polmonare
- anemia fetale e talassemia: Con l’aggravarsi dell’anemia si verifica epato-splenomegalia. L’epatomegalia può causare ipertensione venosa portale ed ombelicale con danno epatico e ridotta sintesi proteica. L’ipertensione portale e l’ipoprotinemia possono dar luogo ad ascite. L’ipertensione venosa ombelicale può concorrere a determinare iperplacentosi. L’idrope fetale da Hb Bart è la forma più grave di α-talassemia ed è quasi sempre letale.
- Peritonite da meconio
- Volvolo intestinale
- Atresia digiuno-ileale
- Peritonite da meconio (17)
- Patologia placentare:
- Chorioangioma placentare
- Trasfusione feto-materna
- Trombosi vena ombelicale
- Torsione cordone ombelicale
- Nodo vero del cordone
- Angiomixoma del cordone ombelicale
- Aneurisma dell’arteria ombelicale
- Patologie materne:
- gravi emorragie, grave anemia, grave ipotroteinemia, estese trombosi venose
- patologia renale, polmonare, gastrointestinale ed epatica
- deficit metabolici, diabete scompensato
- infezioni (parvovirus B19 (5), citomegalovirus, coxackievirus, herpes simplex virus, toxoplasma gondii, treponema pallidum (10)).
3. Cromosomopatie: si riscontrano nel 16% dei casi di idrope fetale con una prevalenza della s. di Down (40%) e della s. di Turner (35%) (1).
Prognosi: in caso di anasarca fetale la prognosi è molto grave (aborto, morte fetale per insufficienza cardiaca fetale da grave ipovolemia).
Se la gravidanza è >33 w, occorre valutare la possibilità di un T.C. di elezione e trasferimento immediato del neonato in terapia intensiva neonatale (TIN).
Circa il 50% di questi neonati richiede trasfusioni “top-up” post-natali durante il ricovero in TIN.
La percentuale globale di sopravvivenza dei feti affetti da isoimmunizzazione Rh supera il 90%. Si osserva sopravvivenza del 100% dei feti non idropici e del 75% dei feti idropici.
Diagnosi:
- Ispessimento placentare: >5 cm, ma si possono raggiungere valori di 15 cm. L’ecostruttura placentare può apparire normale o ad aspetto “vetroso” con scomparsa del piatto coriale. In presenza di polidramnios, la placenta è compressa e può non diagnosticarsi l’iperplacentosi.
- ingrossamento della vena ombelicale: è il segno più precoce dell’idrope fetale. E’ ritenuto patologico un diametro della vena ombelicale >10 mm. L’ipertensione venosa ombelicale può concorrere a determinare od aggravare l’iperplacentosi (4).
- oligoamnios/polidramnios: un altro segno precoce dell’idrope è il polidramnios. Ma l’ipossia fetale può determinare centralizzazione del circolo e minor apporto vascolare nel distretto splancnico dando luogo a riduzione del filtrato renale e, in rari casi, ad oligoidramnios (tasca più grande verticale <3 cm).
- edema sottocutaneo dello scalpo fetale >5 cm; è un segno tardivo dell’idrope e non è sempre facile da rilevare.
- edema del cordone ombelicale ed alterazioni flussimetriche relative (15)
- effusione sottocutanea, pleurica, ascite, idrotorace. L’ascite è uno dei segni più precoci dell’idrope. L’idrotorace e l’effusione pericardica sono segni tardivi ma causano gravi difficoltà alle funzioni cardiocircolatorie e ipoplasia polmonare fetale . Inizialmente l’idrope può apparire come un piccolo strato di fluido in sede sottoepatica o nella pelvi.
- epato-splenomegalia: è il segno principale dell’isoimmunizzazione Rh. La formazione di focolai di eritropoiesi extramidollare provoca epato-splenomegalia.
- MAF ridotti
- dotto venoso di Aranzio; aumentato circolo sul dotto venoso (18)
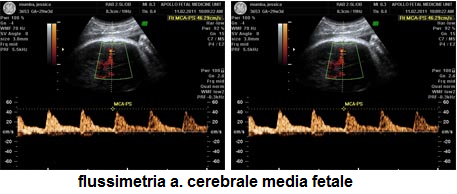
- elevata velocità di picco sistolica, velocità massima al momento della contrazione ventricolare (peak systolic velocity, PSV) misurata a livello dell’arteria cerebrale media (MCA) è associata con una sensibilità del 100%, e una percentuale di falsi positivi del 12%, nel predire moderata/grave anemia. Pertanto MCA PSV >1,5 MoM, confermato a distanza di alcuni giorni, può essere utilizzato come marcatore di moderata/grave anemia e la necessità di trasfusioni intrauterine.
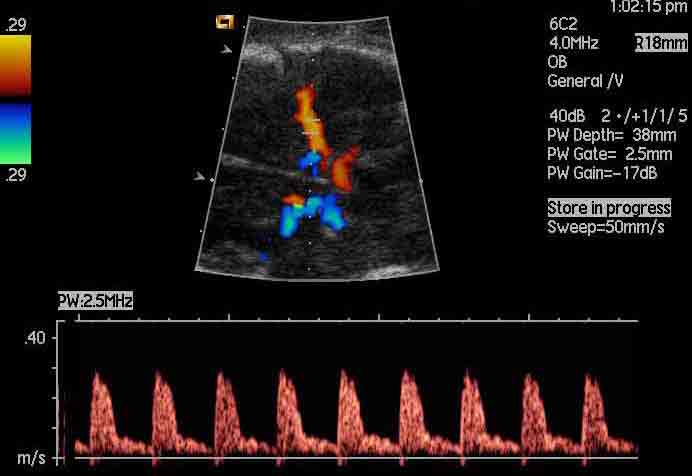
Dopo la diagnosi di idrope immune, completiamo una dettagliata indagine ecografica dell’anatomia fetale per quantificare la gravità della idrope e per escludere eventuali malformazioni strutturali supplementari.
Prevenzione:
A) Immunoglobuline RH: l’incidenza di idrope ad etiologia immunologica è diminuita in modo significativo con l’uso diffuso di immunizzazione passiva mediante somministrazione di immunoglobuline umane anti-D per le madri Rh negative nelle 72 ore seguenti ad un’emorragia, aborto, IVG, amniocentesi, prelievo di villi coriali e post partum (alloimmunizzazione). Dopo 72 ore occorre effettuare la titolazione degli anticorpi anti-D nella puerpera. L’immunoprofilassi anti-D consiste nella somministrazione, mediante iniezione intramuscolare, di immunoglobuline umane anti-D alle donne Rh negative,
Lo scopo è quello di impedire la formazione di anticorpi materni contro i globuli rossi del feto. La immunoprofilassi anti-D è consigliata di routine, oltre che nelle patologie sopra elencate, nel terzo trimestre di gravidanza (32 settimane circa) a tutte le donne Rh negative perché a questa epoca possono più facilmente verificarsi piccole emorragie transplacentari “occulte ”, che mettono in contatto il sangue materno e quello fetale, in assenza di manifestazioni cliniche.
L’efficacia di questo programma di prevenzione è stata dimostrata da un calo dell’incidenza della malattia emolitica Rh da 65/10.000 nascite nel 1960 a 10,6/10.000 nascite nel 1990. Una piccola percentuale di madri rimane suscettibile per questa patologia nelle successive gravidanze.
B) Determinazione del gruppo sanguigno fetale: Il 55% degli individui Rh+ sono eterozigoti. Per una madre Rh negativa, se il padre è omozigote per l’allele Rh, tutta la prole sarà Rh positivo e, quindi, essere a rischio di idrope fetale. Se il padre è eterozigote Rh+, le probabilità che il feto si Rh+ sono del 50%. Se il feto è Rh negativo, il rischio di malattia emolitica è zero. Perciò è importante effettuare la tipizzazione Rh per il padre e l‘esame del DNA fetale estratto dalle cellule fetali circolanti nel sangue materno. Se il feto è Rh negativo, la gravidanza può essere seguito come di routine evitando l’esposizione del feto a prodotti di estrazione ematica quali l’immunoglobulina Rh (13).
C) titolazione anti-D: Quando in una donna con fattore Rh negativo il test di Coombs indiretto è positivo, si deve eseguire la titolazione degli anticorpi anti-D.
D): USG seriate per scoprire eventuale insorgenza dell’idrope nelle fasi precoci.
Terapia:
a) emotrasfusioni fetali multiple: prelievo di sangue fetale dal cordone ombelicale ed emotrasfusione fetale nella vena ombelicale o intraperitoneale per via endoscopica con sangue Rh negativo preparato dal centro emotrasfusionale al quale è stato inviato precedentemente un campione del sangue materno. con sangue RH- appositamente preparato dal centro trasfusionale dopo prove crociate con sangue materno ed in accordo con ematocrito fetale e dosaggio reticolociti. La trasfusione va ripetuta se l’ematocrito fetale è <20% (12).
La gravità dell’anemia emolitica fetale con metodo diretto o indiretto. Il metodo diretto consiste nello studio di un campione di sangue fetale prelevato dal cordone ombelicale, mentre il metodo indiretto consiste nella classica valutazione spettrofotometrica di un campione di liquido amniotico. Se la concentrazione della bilirubina nel liquido amniotico si trova nella seconda zona di Liley, si ripete l’amniocentesi a distanza di 2-3 settimane. Se invece si trova nella terza zona di Liley, si pratica la cordocentesi per valutare l’ematocrito fetale (8.9).
La cordocentesi ripetuta, associata a trasfusione intrauterina, presenta una mortalità del 5% circa.
b) Shunt pleuro-polmonare e/o Toracentesi, pericardiocentesi: in caso di idrotorace può essere necessario il 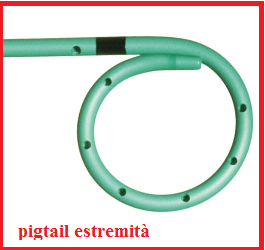 posizionamento di uno shunt pleuro-amniotico:inserzione di uno degli stent utilizzati per la chirurgia riparativa delle lesioni ureterali, un tubicino tipo “double-pig tail” o “a doppia J”, le cui estremità a ricciolo impediscono lo spostamento dello stent. lo stent di Strecker in tantalio è preferito da molti operatori perchè facile da posizionare e perchè dotato di ottima ecogenicità e radiopacità (26).
posizionamento di uno shunt pleuro-amniotico:inserzione di uno degli stent utilizzati per la chirurgia riparativa delle lesioni ureterali, un tubicino tipo “double-pig tail” o “a doppia J”, le cui estremità a ricciolo impediscono lo spostamento dello stent. lo stent di Strecker in tantalio è preferito da molti operatori perchè facile da posizionare e perchè dotato di ottima ecogenicità e radiopacità (26).
Lo stent consente il drenaggio del liquido dalla cavità pleurica o pericardica verso quella amniotica (20-25). Questo consente al polmone di espandersi e di svilupparsi correttamente. Si usa un ago di dimensioni superiori rispetto a quello dell’amniocentesi, per cui la procedura può essere causa di rottura delle membrane e parto pretermine. Al momento della nascita il tubo va chiuso prontamente per evitare un pneumotorace fetale. In alternativa si può ricorrere alla toracocentesi, cioè alla semplice aspirazione del liquido pleurico, tramite una procedura simile all’amniocentesi, che però spesso deve essere ripetuta più volte. Con tali procedure si ottiene:
- un miglioramento del ritorno venoso;
- una diminuzione della pressione venosa centrale del feto;
- una migliore compliance espansiva dei polmoni fetali e del diaframma;
- un miglioramento della ipossia anossica, tipica di questa condizione.
c) Laser-coagulazione delle anastomosi placentari: da eseguire in caso di trasfusione feto-fetale (TTTS).
d) T.C. di elezione appena si è sicuri della maturità polmonare fetale.
References list:
- Potter EL, 1943: Universal edema of fetus unassociated with erythroblastosis. Am J Obstet Gynecol 46:130-134.
- Jauniaux E., Maldergem L.V. et al.: “Nonimmune hydrops fetalis associated with genetic abnormalities”. Obstet. Gynecolol. 1990;75:568.
- Ashraf H Hamdan: “Pediatric Hydrops Fetalis” Medicine Pediatrics: Cardiac Disease and Critical Care Medicine
- De Vore GR, Mayden K, Tortora , et al, 1981: Dilatation of fetal umbilical vein in rhesus hemolytic anemia: a predictor of severe disease. Am J Obstet Gynecol 141:464-466.
- Sohan K, Carroll S, Byrne D, Ashworth M, Soothill P, 2000: Parvovirus as a differential diagnosis of hydrops fetalis in the first trimester. Fetal Diagn Ther 15(4):234-6.
- Fesslova V, Villa L, Nicolini U, 2000: Fetal hydrops due to a tachyarrhythmia progressing to organic pulmonary stenosis. Cardiol Young 10(2):158-61.
- Hoppen T, Hofstaetter C, Plath H, Kau N, Bartmann P, 2000: Agenesis of the ductus venosus and its correlation to hydrops fetalis. J Perinat Med 28(1):69-73
- Ettore G, Guarnera S, Bianca S, 1998: Diagnosis and management of non-immune hydrops fetalis. Prenat Diagn 18(11):1213.
- Odibo AO, Campbell WA, Feldman D, Ling PY, Leo MV, Borgida AF, Rodis JF, 1998: Resolution of human parvovirus B19-induced nonimmune hydrops after intrauterine transfusion.J Ultrasound Med 17(9):547-50.
- Levine Z, Sherer DM, Jacobs A, Rotenberg O, 1998:Nonimmune hydrops fetalis due to congenital syphilis associated with negative intrapartum maternal serology screening.Am J Perinatol 15(4):233-6.
- Fesslova V, Villa L, Nava S, Mosca F, Nicolini U, 1998: Fetal and neonatal echocardiographic findings in twin-twin transfusion syndrome. Am J Obstet Gynecol 179(4):1056-62.
- Trespidi L, Boschetto C, Caravelli E, Villa L, Kustermann A, Nicolini U, 1997: Serial amniocenteses in the management of twin-twin transfusion syndrome: when is it valuable?Fetal Diagn Ther 12(1):15-20.
- Horibe S, Imai A, Kawabata I, Tamaya T, 1995: Fetal blood sampling in the assessment of acute nonimmune hydrops fetalis. J Med 26(3-4):183-8.
- Jorgensen C, Andolf E, 1994: Four cases of absent ductus venosus: three in combination with severe hydrops fetalis. Fetal Diagn Ther 9(6):395-7
- Legarth J, Lingman G, Stangenberg M, Rahman F, 1994: Umbilical artery Doppler flow-velocity waveforms and fetal acid-base balance in Rhesus-isoimmunized pregnancies.J Clin Ultrasound 22(1):37-41.
- Mahone PR, Sherer DM, Abramowicz JS, Woods JR Jr, 1993: Twin-twin transfusion syndrome: rapid development of severe hydrops of the donor following selective feticide of the hydropic recipient. Am J Obstet Gynecol 169(1):166-8.
- Stiemer B, Becker R, Waldschmidt J, 1993: Intrauterine meconium peritonitis. A rare cause of non-immunologic hydrops fetalis. Ultraschall Med 14(1):44-7.
- Gudmundsson S, Huhta JC, Wood DC, Tulzer G, Cohen AW, Weiner S, 1991: Venous Doppler ultrasonography in the fetus with nonimmune hydrops. Am J Obstet Gynecol 164(1 Pt 1):33-7
- Takeuchi K, Moriyama T, Oomori S, Masuko K, Maruo T, 1999: Management of acute chylothorax with hydrops fetalis diagnosed in the third trimester of pregnancy.Fetal Diagn Ther 14(5):264-5.
- Kulkarni RP, Bellamy EA. A new thermo-expandable shape-memory nickel-titanium alloy stent for the management of ureteric strictures. BJU Int. 1999;83:755–9
- Kulkarni RP, Bellamy EA. Nickel-titanium shape-memory alloy memokath 051 ureteral stent for managing long term ureteral obstruction: 4-year experience. J Urol. 2001;166:1750–4.[PubMed]
- Klarskov P, Nordling J, Nielsen JB. Experience with Memokath 051 ureteral stent. Scand J Urol Nephrol. 2005;39:169–72.
- Papatsoris AG, Buchholz N. A novel thermo-expandable ureteral metal stent for the minimally invasive management of ureteral strictures. J Endourol. 2010;24:487–91
- Maan Z, Patel D, Moraitis K, El-Husseiny T, Papatsoris AG, Buchholz NP, et al. Comparison of stent-related symptoms between conventional double-J stents and a new-generation thermoexpandable segmental metallic stent: A validated-questionnaire-based study. J Endourol. 2010;24:589–93.
- Tekin MI, Aytekin C, Aygun C, PeSkircioglu L, Boyvat F, Ozkardes H. Covered metallic ureteral stent in the management of malignant ureteral obstruction: Preliminary results. Urology. 2001;58:919–23.
- F. PEPE, M. FAUZIA, M.C. DISTEFANO, A. PRIVITERA, C. STRANO, E. LEOTTA,L. COCO, F.M. DI GRAZIA, F. DE LUCA: “Malformazione adenomatoide cistica del polmone fetale. Casi clinici e revisione della letteratura”. Giorn. It. Ost. Gin. Vol. XXXV – n. 2 Marzo-Aprile 2013



2 commenti
Hi there are using Wordpress for your blog platform?
I’m new to the blog world but I’m trying to get started and set up my own. Do you
require any coding expertise to make your own blog? Any help would be
greatly appreciated!
Hi there! Would you mind if I share your blog with my twitter
group? There’s a lot of folks that I think would really appreciate your content.
Please let me know. Many thanks