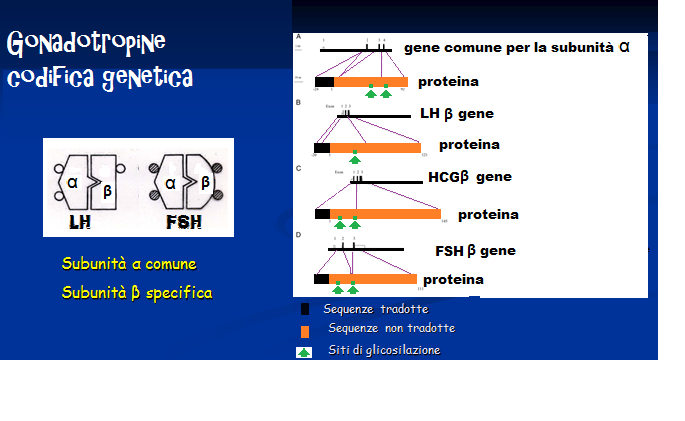
 carboidrati e risultano formate da due catene di aminoacidi dette subunità α (92 aminoacidi) e β (111 aminoacidi), unite con un legame non covalente ad elevata affinità formato da due ponti disulfidrici.. La subunità α é uguale per entrambe le gonadotropine, mentre varia la subunità β, in cui la sequenza degli aminoacidi é diversa per LH ed FSH. Il gene per la codificazione della catena alfa è posto sul cromosoma 6q12.21 mentre il gene per la catena beta è posto sul cromosoma 19q13.32 (32).
carboidrati e risultano formate da due catene di aminoacidi dette subunità α (92 aminoacidi) e β (111 aminoacidi), unite con un legame non covalente ad elevata affinità formato da due ponti disulfidrici.. La subunità α é uguale per entrambe le gonadotropine, mentre varia la subunità β, in cui la sequenza degli aminoacidi é diversa per LH ed FSH. Il gene per la codificazione della catena alfa è posto sul cromosoma 6q12.21 mentre il gene per la catena beta è posto sul cromosoma 19q13.32 (32).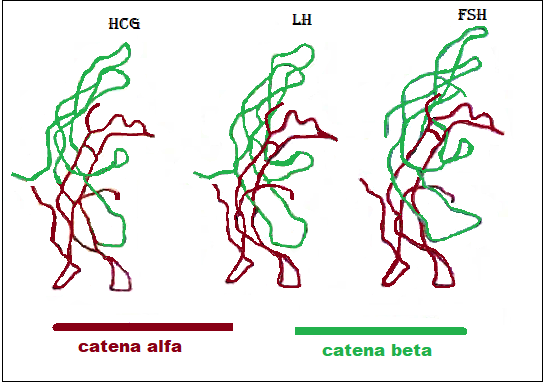
 glicosilazione (2).Tali polimorfismi genici danno luogo a enzimi con diversi livelli di attività metabolica o a recettori con diversa affinità per il farmaco, modificando la risposta farmacologica di un individuo. Le variazioni genetiche riguardano più spesso un singolo nucleotide e sono pertanto definite polimorfismi a singolo nucleotide (SNP) che non influenzano il normale pool ovocitario (16,17), ma possono interessare anche più nucleotidi o anche ampi tratti di DNA: sostituzioni, inserzioni, delezioni, amplificazioni e traslocazioni.
glicosilazione (2).Tali polimorfismi genici danno luogo a enzimi con diversi livelli di attività metabolica o a recettori con diversa affinità per il farmaco, modificando la risposta farmacologica di un individuo. Le variazioni genetiche riguardano più spesso un singolo nucleotide e sono pertanto definite polimorfismi a singolo nucleotide (SNP) che non influenzano il normale pool ovocitario (16,17), ma possono interessare anche più nucleotidi o anche ampi tratti di DNA: sostituzioni, inserzioni, delezioni, amplificazioni e traslocazioni.Variante genica PV-β dell’LH:
Nel 15% circa di giovani donne normogonadotrope, la risposta ovarica all’associazione di GnRH-a long protocol e rFSH risulta subottimale, nonostante la presenza di normali concentrazioni sieriche di LH e l’assenza di variabili prognostiche avverse. In assenza di alterazioni recettoriali queste paziento sono state definite “steady responders”. Si è ipotizzato che queste pazienti possano presentare un LH endogeno anomalo, contrassegnato da una ridotta attività biologica (steady response) per cui l’ormone sarebbe in grado di sostenere la crescita follicolare spontanea mentre in condizioni stressanti, di stimolo sovrafisiologico (COH) risulterebbe inadeguato, nonostante la presenza di concentrazioni circolanti apparentemente normali. Le isoforme della subunità dell’LH (V-LH) descritte per la prima volta dal gruppo finlandese di Petterson, sembra avere nella popolazione italiana un incidenza del 13% (13-15). Queste pazienti possono giovarsi di LH esogeno che evita di aumentare drasticamente le dosi di r-FSH per raggiungere un’ottimale crescita follicolare multipla (13-15). La variante genica V-β dell’LH è causata da due mutazioni puntiformi del gene della subunità, che comporta due alterazioni amminoacidiche missense nei codoni 8 e 15: Trp8Arg e Ile15Thr (Petterson, 1994; Huhtaniemi, 2000). A ciò si aggiunge una seconda mutazione che introduce una glicosilazione aggiuntiva in posizione 13 sull’asparagina sull’oligosaccaride di legame al recettore (Huhtaniemi, 1999). La frequenza dell’allele della variante oscilla tra lo 0 a più del 50% nella diverse popolazioni (in Finlandia la percentuale si assesta al 28%) (Huhtainiemi, 1999). La variante V-β LH è più frequente nelle donne PCOS specialmente se con BMI >30 Kg/m2 (15-18).
POLIMORFISMO DEI RECETTORI FSH: Esistono due polimorfismi a singolo nucleotide localizzati a livello dell’esone 10 del gene FSH-R che modificano la sensibilità della risposta ovarica ad una stimolazione con l’ormone FSH:
POLIMORFISMI DEI RECETTORI PER L’ESTRADIOLO:
Test genetici: I test si basano sull’analisi di 5 polimorfismi genetici, localizzati su 4 geni.

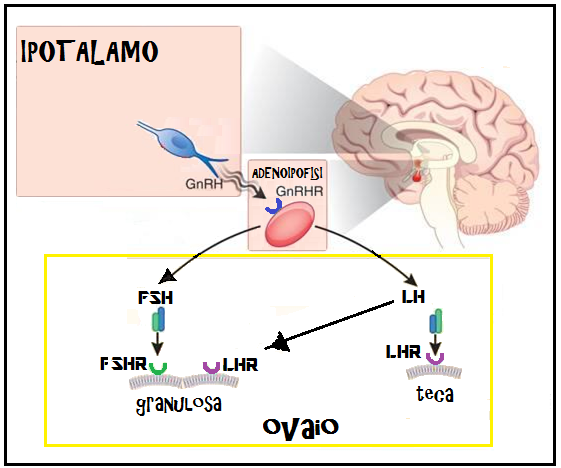
Sintesi ed accumulo delle gonadotropine
- Azione dell’FSH sul corpo luteo: L’azione dell’FSH in fase luteale si esplica prevalentemente a livello delle grandi cellule luteiniche stimolando l’aromatizzazione dei precursori androgeni in estrogeni; nè in vitro nè in vivo si è mai osservato alcun effetto apprezzabile dell’FSH sulla produzione di progesterone. Pertanto, l’azione dell’FSH sembra estrinsecarsi pressoché esclusivamente sulla produzione estrogenica.
- Azione dell’LH sul corpo luteo: La secrezione steroidea luteale gode di un certo grado di autonomia; infatti, Rossmanith e coll. nel 1990 hanno riscontrato nella donna che un certo numero di picchi secretori di estradiolo e progesterone non erano preceduti da picchi di LH. Inoltre, la ghiandola luteale se espiantata e studiata in vitro continua a secernere progesterone in modo pulsatile. Tuttavia, l’importanza dell’azione di stimolo esercitata dall’LH a livello luteale sulla secrezione di progesterone è ampiamente provata. Infatti l’immunoneutralizzazione dell’LH nella scimmia induce un calo repentino dei livelli plasmatici di progesterone provocando rapida luteolisi. Allo stesso modo la somministrazione di antagonisti del GnRH nella fase luteale determina calo della produzione di progesterone, mentre la contemporanea somministrazione di HCG o HMG, consente il mantenimento della funzione luteale pure in assenza di gonadotropine endogene. Inoltre nel 1988 Veldhuis e coll. hanno dimostrato nella donna l’esistenza di una stretta correlazione tra picchi di LH e progesterone: un picco di LH precede di 10 minuti quello di progesterone.
Nella fase follicolare avanzata, l’azione dell’LH si verifica in particolare nel compartimento della granulosa con l’attivazione dei meccanismi che conducono allo scoppio del follicolo e, quindi, all’evento ovulatorio (Schoot et al., 1992). Tuttavia è plausibile che, da un certo momento della crescita follicolare, l’LH possa, da solo, sostenere l’intero processo e sia anzi fondamentale per la selezione del follicolo dominante. Sulla base di tale teoria, la somministrazione contemporanea di FSH ed LH, ormoni presenti in quantità sovrapponibili nei preparati estrattivi a base di human menopausal gonadotropin (hMG), contrassegnati da un rapporto FSH/LH di 1:1, sembrava inizialmente indispensabile nei procedimenti di induzione alla superovulazione ai fini del reclutamento e del mantenimento della crescita follicolare multipla fino alle fasi pre-ovulatorie. Nel tempo si è osservato, invece, come la presenza di livelli di LH sovrafisiologici (di origine endogena e/o consequenziale alla somministrazione esogena dell’ormone) durante la fase proliferativa precoce-intermedia comportasse una serie di effetti deleteri sulla maturazione follicolare (concetto dell’ “LH ceiling”), tali da riflettersi in un decremento significativo della qualità ovocitaria (Polan, 1986) ed una maturazione ovocitaria accelerata con la conseguenza di recuperare ovociti post-maturi
Queste evidenze hanno spinto verso l’impiego di FSH estrattivo contrassegnato da un grado sempre più elevato di purificazione e quindi di una quota di LH sempre più esigua; l’impiego nella pratica clinica di FSH purificato si è rilevato in grado di garantire un’adeguata maturazione follicolare multipla con l’ottenimento di un soddisfacente numero di ovociti di buona qualità. L’apice di tale evoluzione farmacologia è rappresentato dai preparati ottenuti grazie all’ingegneria genetica a base di FSH ricombinante (r-FSH) totalmente privi di attività LH.
- Richard A. Jungmann and John S. Schweppe: “Mechanism of Action of Gonadotropin”. J. Biol. Chem. 1972, 247:5535-5542.
- Levy DP, Navarro JM, Schattman GL, Davis OK, Rosenwaks Z (2000) The role of LH in ovarian stimulation: exogenous LH, let’s design the future. Hum Reprod; 15:2258-2265.
- De Placido G, Alviggi C, Mollo A, Strina I, Ranieri A, Alviggi E, Wilding M, Varricchio MT, Borrelli AL and Conforti S (2004) Effects of recombinant LH (rLH) supplementation during controlled ovarian hyperstimulation (COH) in normogonadotrophic women with an initial inadequate response to recombinant FSH (rFSH) after pituitary downregulation. Clin Endocrinol; 60:637-643.
- De Placido G, Alviggi C, Perino A, Strina I, Lisi F, Fasolino A, De Palo R, Ranieri A, Colacurci N and Mollo A on behalf of the Italian Collaborative Group on Recombinant Human Luteinizing Hormon. (2005) Recombinant human LH supplementation versus recombinant human FSH (rFSH) step-up protocol during controlled ovarian stimulation in normogonadotrophic women with initial inadequate ovarian response to rFSH. A multicentre, prospective, randomized controlled trial. Human Reproduction; 20(2):390-396.
- Chappel SC and Howles C (1991) Revaluation of the roles of luteinizing hormone and follicle stimulating hormone in the ovulatory process. Hum Reprod; 6:1206-12.
- Werlin L (2001) A Multi-Center, Randomized, Comparative, Open-label Trial to Assess the Safety and Efficacy of Gonal-F® (r-hFSH) versus Gonal-F® and recombinant human Luteinizing Hormone (r-hLH) in Patients Undergoing ICSI.
- Ilpo T. Huhtaniemi: “Polymorphism of gonadotropin action; molecular mechanisms and clinical implications”. Acta Neurobiol Exp 1996;56:743-751
- Cole LA (2009). “New discoveries on the biology and detection of human chorionic gonadotropin”. Reprod. Biol. Endocrinol. 7: 8.
- Gregory JJ, Finlay JL (April 1999). “Alpha-fetoprotein and beta-human chorionic gonadotropin: their clinical significance as tumour markers”. Drugs 57 (4): 463–7
- Lee-Huang S, Huang PL, Sun Y, Huang PL, Kung HF, Blithe DL, Chen HC (March 1999). “Lysozyme and RNases as anti-HIV components in beta-core preparations of human chorionic gonadotropin”. Proc. Natl. Acad. Sci. U.S.A. 96 (6): 2678–81.
- Lijesen GK, Theeuwen I, Assendelft WJ, Van Der Wal G (September 1995). “The effect of human chorionic gonadotropin (HCG) in the treatment of obesity by means of the Simeons therapy: a criteria-based meta-analysis”. Br J Clin Pharmacol 40 (3): 237–43.
- American Society of Bariatric Physicians, position statement on HCG diet
- Alviggi C, Petterson K, Mollo A, Clarizia R, Strina I, Coppola M, Ranieri A, De Placido G.: “Impaired multiple follicular development in carriers of Trp8Arg and Ile15Thr LH-beta variant undergoing controlled ovarian stimulation. Abstract of the 21th Annual Meeting of the ESHRE, Copenhagen, 19-22, June 2005
- Ranieri A, Alviggi C, Mollo A, Strina I, Varricchio MT, Amato V, Clarizia R, Coppola M, De Marino C, De
Placido G.: “Frequenza della variante beta-LH Trp8 Arg e Ile15-Thr in pazienti normogonadotrope, normoovulatorie che presentano inadeguata risposta ovarica alla stimolazione ovarica controllata in corso di cicli ART”. Atti LXXXI Congresso SIGO, Bologna 20-24 settembre 2005. - Alviggi C, Clarizia R, Petterson K, Mollo A, Strina I, Ranieri A, Coppola M, Pirozzi I, De Placido G.: “Association between different profiles of ovarian response to rFSH and a point mutation of native LH”. Abstract of the 22th Annual Meeting of the ESHRE, Prague, 19-22 June 2006.
- Casarini L, Pignatti E, Simoni M.: “Effects of polymorphisms in gonadotropin and gonadotropin receptor genes on reproductive function”. Rev Endocr Metab Disord. 2011 Dec;12(4):303-21.
- La Marca A, Sighinolfi G, Argento C, Grisendi V, Casarini L, Volpe A, Simoni M.: “Polymorphisms in gonadotropin and gonadotropin receptor genes as markers of ovarian reserve and response in in vitro fertilization”. Fertil Steril. 2013 Mar 15;99(4):970-8.e1. doi: 10.1016/j.fertnstert.2013.01.086.
- Behre HM, Greb RR, Mempel A, Sonntag B, Kiesel L, Kaltwaßer P, Selinger E, Röpke F, Gromoll J and Simoni M (2005) Significance of a common single nucleotide polymorphism in exon 10 of the follicle-stimulating hormone (FSH) receptor gene for ovarian response to FSH: a pharmacogenetic approach to controlled ovarian hyperstimulation.Pharmcogen Genom 15,451”“456.
- Daelemans C, Smits G, de Maertelaer V, Costagliola S, Englert Y, Vassart G and Delbaere A (2004) Prediction of severity of symptoms in iatrogenic ovarian hyperstimulation syndrome by follicle-stimulating hormone receptor Ser680 Asn polymorphism. J Clin Endocrinol Metab 89,6310”“6315.
- De Castro F, Ruiz R, Montoro L, Pérez-Hernández D, Sánchez-Casas Padilla E, Real LM and Ruiz A (2003) Role of follicle-stimulating hormone receptor Ser680Asn polymorphism in the efficacy of follicle-stimulating hormone. Fertil Steril 80,571”“576.
- de Castro F, Moron FJ, Montoro L et al. 2004 Human controlled ovarian hyperstimulation outcome is a polygenic trait. Pharmacogenetics 14, 285”“293.
- De Castro F, Moron FJ, Montoro L, Galan JJ, Real LM, Ruiz A Re: polymorphisms associated with circulating sex hormone levels in postmenopausal women. J. Natl. Cancer Inst. 97, 152”“153 (2005).
- de Koning C.H., T.Benjamins, P.Harms, R.Homburg, J.M.van Montfrans, J.Gromoll, M.Simoni and C.B.Lambalk The distribution of FSH receptor isoforms is related to basal FSH levels in subfertile women with normal menstrual cycles Human Reproduction Vol.21, No.2 pp. 443”“446, 2006
- Georgiou I, Konstantelli M, Syrrou M, Messinis IE, Lolis DE. Oestrogen receptor gene polymorphisms and ovarian stimulation for in-vitro fertilization. Hum Reprod 1997; 12:1430”“1433.
- Greb RR, Grieshaber K, Gromoll J, Sonntag B, Nieschlag E, Kiesel L and Simoni M (2005) A common single nucleotide polymorphism in exon 10 of the human follicle stimulating hormone receptor is a major determinant of length and hormonal dynamics of the menstrual cycle. J Clin Endocrinol Metab, 90,4866”“4872.
- Laven JSE, Mulders AGMGJ, Suryandari DA, Gromoll J, Nieschlag E, Fauser BCJM and Simoni M (2003) Follicle-stimulating hormone receptor polymorphisms in women with normogonadotropic anovulatory infertility. Fertil Steril 80,986”“992.
- Perez Mayorga M, Gromoll J, Behre HM, Gassner C, Nieschlag E and Simoni M (2000) Ovarian response to follicle-stimulating hormone (FSH) stimulation depends on the FSH receptor genotype. J Clin Endocrinol Metab 89,1255”“1258.
- Simoni M, Nieschlag E and Gromoll J (2002) Isoforms and single nucleotide polymorphisms of the FSH receptor gene: implications for human reproduction. Hum Reprod Update 8,413”“421.
- Sudo S, Kudo M, Wada S, Sato O, Hsueh AJ and Fujimoto S (2002) Genetic and functional analyses of polymorphisms in the human FSH receptor gene. Mol Hum Reprod 8,893”“899.
- Sundarrajan C, Liao W, Roy AC, Ng SC 1999 Association of oestrogen receptor gene polymorphisms with outcome of ovarian stimulation in patients undergoing IVF. Molecular Human Reproduction 5, 797”“802.
- Vaskivuo TE. et al. (2002) Effects of follicle-stimulating hormone (FSH) and human chorionic gonadotropin in individuals with an inactivating mutation of the FSH receptor. Fertil Steril 78: 108-113
- Ben-Rafael Z, Levy T, Schoemaker J. 1995 Pharmacokinetics of follicle-stimulating hormone: clinical significance. Fertil Steril. 63:689–700




1 commento
Whoa! This blog looks exactly like my old one! It’s on a completely
different subject but it has pretty much the same layout and design. Great choice of colors!