Il coriocarcinoma di origine gestazionale è una proliferazione di tessuto trofoblastico, tumore maligno raro (1/25.000-45.000 gravidanze) che può svilupparsi in gravidanza o dopo qualsiasi gravidanza, anche a seguito di un parto normale o un aborto o una gravidanza extrauterina, anche se di solito si forma dopo una mola vescicolare (50%) Primariamente si localizza nella cavità uterina ma non sono rari i casi di coriocarcinoma gestazionale primari della tuba.
Altre forme maligne di tumori del trofoblasto, oltre al coriocarcinoma, sono il tumore del sito placentare Placental Site Trophoblastic Tumor (PSTT) e il tumore trofoblastico epitelioide.
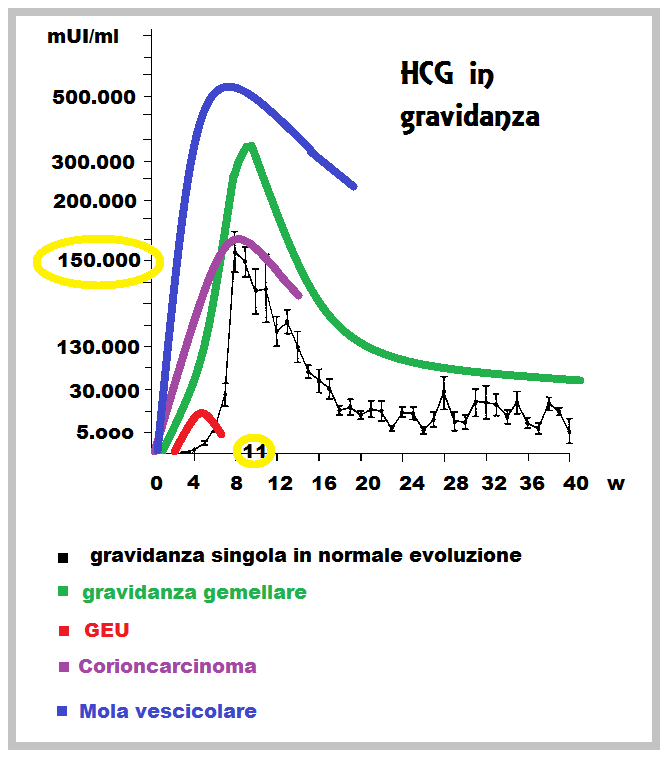
Il coriocarcinoma di origine gestazionale è stato il primo tumore solido a essere curato con la chemioterapia e oggi la maggior parte delle pazienti guarisce anche quando la malattia ha già dato delle metastasi. Una caratteristica importante di questa neoplasia è l’iperproduzione di HCG.
Fattori di rischio – Il fattore di rischio più importante in assoluto è la mola vescicolare, altri fattori di rischio sono l’età, dato che questo tipo di patologia è più comune prima dei 20 anni e dopo i 40; precedente gravidanza molare e la razza asiatica. Il coriocarcinoma di solito insorge a distanza di 7-11 dall’evento gravidico ma può presentarsi anche dopo anni.
Sintomatologia – i sintomi sono tardivi nonostante la rapida diffusione del coriocarcinoma. lI sintomo più comune del coriocarcinoma gestazionale è rappresentato da perdite anomali di sangue (AUB) in gravidanza e/o dopo una gravidanza per lungo periodo.
(AUB) in gravidanza e/o dopo una gravidanza per lungo periodo.
Se la neoplasia è metastatizzata, si possono osservare tosse, dolore al torace e dispnea, cefalea, lipotimia, vomito e altri in relazione all’organo colpito.
Se la malattia si presenta durante una gravidanza, si verificano tipicamente
- minaccia di aborto,
- aborto spontaneo,
- eclampsia
- morte fetale; raramente il feto sopravvive.

La malattia trofoblastica gestazionale viene sospettata in donne con un test di gravidanza positivo e una delle seguenti situazioni:
- utero di dimensioni molto più grandi rispetto al previsto
- sintomi o segni di preeclampsia
- perdita di tessuto simile a uva
- reperti ecografici suggestivi: massa contenente cisti multiple, assenza feto e liquido amniotico evidenziati durante l’ecografia effettuata per valutare la gravidanza
- metastasi di origine sconosciuta in donne in età fertile
- livelli inaspettatamente alti di β-hCG durante i test di gravidanza (il tumore trofoblastico del sito placentare e il tumore trofoblastico epitelioidale determinano bassi livelli di β-hCG
Diagnostica – Dosaggio delle gonadotropine, biopsia, USG, TAC total body, RMN.
USG: massa ipercogena che quasi sempre occupa l’intera cavità uterina, ipervascolarizzata. Durante ln gravidanza potrebbero essere visibili residue formazioni fetali.
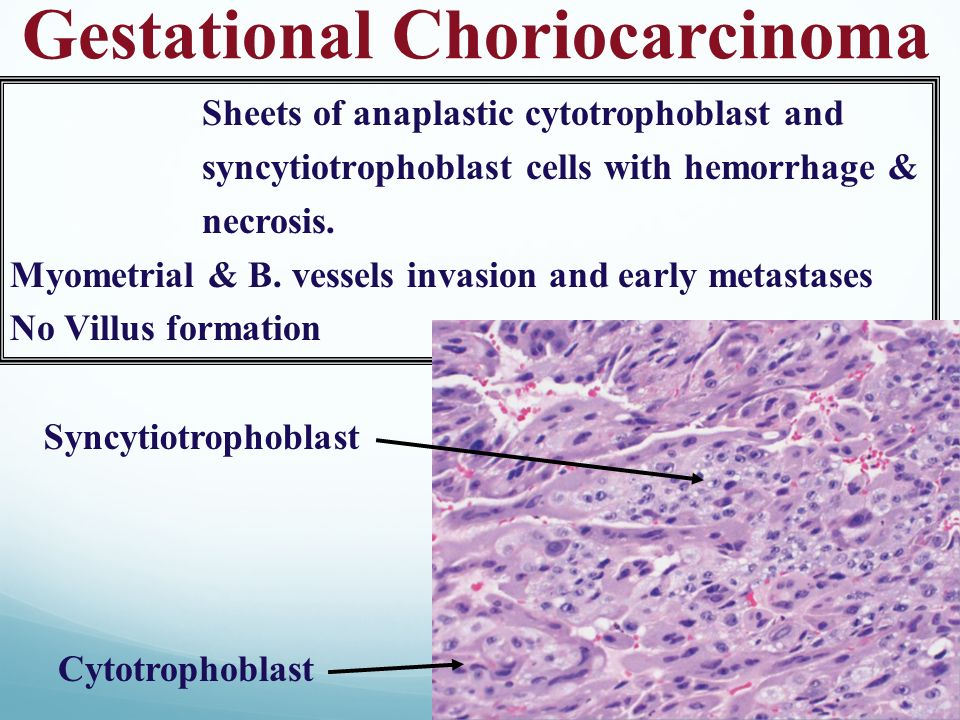
Anatomia patologica – tumore invasivo, di solito altamente metastatico è composto da cellule del cito-sinciziotrofoblasto con atipie ed elevato indice mitotico; non si osservano, normali o idropici.

Stadiazione – L’International Federation of Gynecology and Obstetrics (FIGO) Oncology Committee nel 2000 ha sviluppato un sistema di stadiazione per la neoplasia trofoblastica gestazionale
| STADIAZIONE FIGO DEL CORIOCARCINOMA GESTAZIONALE | |
|
I |
Confinato all’utero |
|
II |
Che si estende al di fuori dell’utero ma limitatamente alle strutture genitali (annessi, vagina, legamento largo) |
|
III |
Che si estende ai polmoni, con o senza coinvolgimento del tratto genitale |
|
IV |
Diffuso a diversi organi |
SEDE DELLE METASTASI NELLA MALATTIA TROFOBLASTICA MALIGNA
– POLMONE: 80-90%
– VAGINA: 30%
– PELVI: 20%
– FEGATO: 10%
– ENCEFALO: 10%
– INTESTINO: 25%
– RENE: <5%
– MILZA: <5%
– ALTRO: <5%
Terapia – Curetage della cavità uterina o isterectomia; se la malattia persiste, la chemioterapia quasi sempre è in grado di risolvere la patologia anche in caso di metastasi diffuse. La chemio si avvale dello schema EMA/CO che prevede il ricorso a Etoposide, Actinomicina D, Methotrexate, Vincristina, Ciclofosfamide, Cisplatino per 8 settimane; terapia complementare con Ac.folico. Controllo settimanale delle concentrazioni sieriche di HCG.
Il trattamento chemioterapico è considerato efficace se almeno 3 misurazioni consecutive di β-hCG sierica ripetute ad intervalli di 1 settimana sono normali.
La gravidanza deve essere prevenuta per 6 mesi dopo il trattamento poiché la gravidanza aumenterebbe i livelli di β-hCG, rendendo difficile determinare se il trattamento ha avuto successo.
La malattia non metastatica può essere trattata con un singolo farmaco chemioterapico (metotrexato o D-actinomicina).
Se la chemioterapia con un singolo farmaco è inefficace, è indicata l’isterectomia o la chemioterapia di combinazione. Praticamente il 100% delle pazienti con malattia non metastastica può guarire. La malattia metastatica a basso rischio è trattata con chemioterapia con un singolo farmaco o con farmaci in combinazione. La malattia ad alto rischio di metastatizzazione richiede una chemioterapia aggressiva di combinazione.
I tassi di guarigione sono del 90-95% per la malattia a basso rischio e del 60-80% per il coriocarcinoma ad alto rischio.
L’isterectomia è presa in considerazione per le pazienti >40 anni o per quelle che desiderano essere sterilizzate e può essere necessaria per le donne con una grave infezione o un sanguinamento altrimente non sopprimibile.
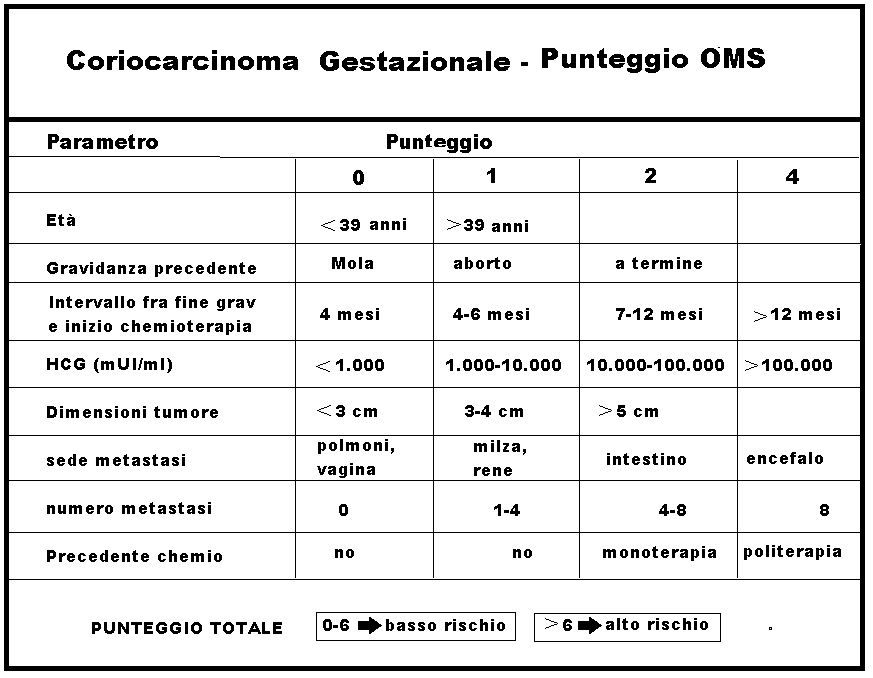
Prognosi – Una cattiva prognosi è anche suggerita dai seguenti criteri proposti nel 2000 dal National Institute of Health [NIH]:
- Escrezione urinaria hCG > 100 000 UI in 24 h
- Durata della malattia > 4 mesi (intervallo dalla precedente gravidanza)
- Metastasi cerebrali o epatiche
- Malattia dopo una gravidanza a termine
- hCG sierica > 40 000 mUI/mL
- Precedente insuccesso della chemioterapia
- Punteggio OMS >8
La malattia trofoblastica gestazionale non compromette la fertilità e non predispone a complicanze prenatali o perinatali (malformazioni congenite, aborti spontanei).
References:
- Ahmed A, De Geest K, Van Natta T, Sorosky J: Metastatic choriocarcinoma to the lung coexistent with a viable pregnancy. Gynecol Obstet 2006;94:56-57
- Seung Me L et al: A successfully treated case of primary tubal choriocarcinoma coexistent with viable intrauterine pregnancy. Gynecol Oncol 2005; 671-673
- Butler R, Chada Y, Davies J, Singh M: A case of primary tubal gestazional choriocarcinoma. Austr and NZ J Obst Gynecol 2010;50:200-204.
- Gerulath AH. Gestational Trophoblastic Disease. SOGC Clinical Practice Guideline. 2002
May;(114). - Seckl MJ, Sebire NJ, Berkowitz RS. Gestational trophoblastic disease. Lancet. 2010; 376:717-29.
- Guerrero-Hernández A, Jennings-Aguilar Y, LópezZúñiga DF, Ochoa-Carrillo FJ, Briones-Garduño JC.
Coriocarcinoma gestacional. Caso clínico de medicina crítica en ginecología y obstetricia. GAMO 2012; 11(1). - Altieri A, Silvia Franceschi JF, Smith J, Vecchia CL. Epidemiology and aetiology of gestational trophoblastic diseases. Lancet Oncol 2003; 4(11):670-8.
- Rotas M, Khulpateea N, Binder D. Gestational choriocarcinoma arising from a cornual ectopic pregnancy: a case report and review of the literature. Arch Gynecol Obstet 2007;276:645-7.
- Goldstein DP, Zanten-Przybysz IV, Bernstein MR, Berkowitz RS. Revised FIGO staging system for gestational trophoblastic tumors. Recommendations regarding therapy. J Reprod Med 1998;43(1):37-43.
- García-Benasach F, Ríos-Vallejo M, Savirón-Cornudella R, Díaz-Terán E, Iglesias-Goy E. Metástasis
cerebrales de coriocarcinoma tras una gestación a término. Prog Obstet Ginecol 2006;49(2):98-101.
8. Ma Y, Xiang Y, Wan XR, Chen Y, Feng FZ, Lei CZ, et al. The prognostic analysis of 123 postpartum
choriocarcinoma cases. Int J Gynecol Cancer 2008;18(5):1097-101. - Soper JT, Mutch DG, Schink JC. Diagnosis and treatment of gestational trophoblastic disease: ACOG
Practice Bulletin No. 53. Gynecologic Oncology 2004;93(3):575-85. - Seckl MJ, Sebire NJ, Fisher RA, Golfier F, Massuger L, Sessa C; ESMO Guidelines Working Group. Gestational trophoblastic disease: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013;24 Suppl 6:vi39-50.