Ultimo aggiornamento 2021-09-20 20:29:25
I miomi uterini sono neoformazioni mesenchimali benigne del viscere uterino; sono monoclonali originando da una sola cellula muscolare liscia. Possiedono recettori per gli estrogeni soprattutto ma anche recettori per il progesterone e quindi prosperano durante l’età fertile della donna, esaltandosi in periodo perimenopausale, tipicamente iperestrinico, e regrediscono in menopausa (1). Più propriamente potrebbero essere definiti fibromiomi se prevale la componente fibrosa e leiomioma, se prevale la componente muscolare. Leiomioma è il termine che più rispetta l’istogenesi del mioma essendo esso derivato da una cellula muscolare liscia. In genere i miomi sono multipli, con minor frequenza solitari.
Epidemiologia – Rari prima dei 20 anni, per la lenta crescita, si rendono in genere evidenti verso la quarta decade di vita delle donne con incidenza del 25% nelle donne di razza caucasica e asiatica e del 50% nelle donne di razza afro-americana (2,3).
Localizzazione – miomi sono localizzati nel corpo uterino (58%), nel 17% dei casi  sono sottosierosi, nell’8% sono localizzati sotto la mucosa, 7% sono intracavitari, per il 5% a carico della cervice, nel 4% sono peduncolari e liberi in addome e nell’1% possono svilupparsi nelle pagine del ligamento largo (infraligamentari). Questi ultimi, sviluppandosi dai margini laterali dell’utero soprattutto nella zona istmica sdoppiano le due pagine peritoneali del legamento largo, sviluppandosi dentro di essi.
sono sottosierosi, nell’8% sono localizzati sotto la mucosa, 7% sono intracavitari, per il 5% a carico della cervice, nel 4% sono peduncolari e liberi in addome e nell’1% possono svilupparsi nelle pagine del ligamento largo (infraligamentari). Questi ultimi, sviluppandosi dai margini laterali dell’utero soprattutto nella zona istmica sdoppiano le due pagine peritoneali del legamento largo, sviluppandosi dentro di essi.
La loro dimensione varia da qualche millimetro a decine di centimetri. La crescita dei fibromi è variabile e poco prevedibile; in genere è lenta, mentre un rapido aumento di volume potrebbe essere indicativo di malignità (0,1 % dei miomi). Hanno una forma irregolarmente sferoidale, quasi sempre multipli, raramente unici. Sono costituiti da fibre muscolari lisce, con andamento concentrico a spirale. Un sottile strato di tessuto connettivo fibroso li avvolge e tende a formare una pseudocapsula periferica, che è ancorata al miometrio da ponti fibro-muscolari, di dimensioni ed andamento variabile. E’ evidente un sottile spazio tra la pseudocapsula ed il mioma (spazio sottocapsulare).
Varianti rare:
- Sono segnalati miomi a partenza da fibrocellule muscolari delle vene uterine o che dalle normali fibre miometriali invadono progressivamente le vene iliache, la vena cava, la vena mesenterica (42) e talvolta le cavità cardiache (leiomiomatosi intravenosa e intracardiaca).
- Sono eccezionali i fibromi “parassiti” , che hanno perso la connessione vascolare originale uterina e che hanno acquisito una succedanea, in genere dall’omento.
FENOMENI DEGENERATIVI: Il fibroma può andare incontro ad alterazioni dovute al deficit di vascolarizzazione soprattutto nella parte centrale, la meno vascolarizzata. Queste alterazioni sono:
– degenerazione ialina o mixomatosa o pseudomucinosa: il tumore si presenta molle ed al taglio presenta un colorito biancastro, omogeneo senza il caratteristico aspetto fascicolare. Questa degenerazione può interessare tutto il fibroma o solo parte di esso; in tal caso al’esame ecografico il mioma si presenta iperiflettente e la pseudocapsula è ben evidente.
– degenerazione adiposa: spesso secondaria alla degenerazione ialina o dovuta ad una metaplasia lipomatosa. Il fibroma assume una consistenza molliccia ed al taglio si alternano aree giallastre con aree bianco-rosee. La degenerazione grassa si verifica più frequentemente nel periodo puerperale e di solito interessa solo una parte del tumore.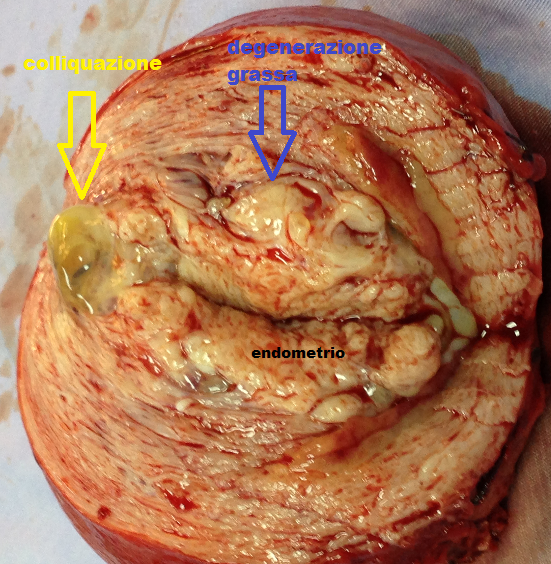
– degenerazione cistica: caratterizzata dalla formazione di cisti dovute alla colliquazione di materiale necrotico. In genere preceduta da una fase degenerativa ialina, induce nel tumore, e talora in tutto l’utero, una consistenza fluttuante, molto simile a quella di un utero gravido. Nello spessore del fibroma si formano delle cavità più o meno ampie, ripiene di liquido gelatinoso. Se le cavità sono numerose, la sezione del tumore assume un aspetto ad alveare ben visibile all’osservazione USG.
– calcificazione: per deposizione di sali di calcio all’interno del fibroma; è più frequente in menopausa e nei fibromi sottosierosi.
– degenerazione sarcomatosa: estremamente rara (circa 1‰) ma possibile soprattutto nei fibromiomi datati di anni. La degenerazione sarcomatosa inizia per lo più al centro del leiomioma il quale subisce un improvviso e rapido aumento di volume, e talora diventa fisso e dolente. Quando questo quadro si sviluppa in una donna in post-menopausa, il sospetto di degenerazione maligna del tumore è pienamente giustificato. Il chirurgo si trova davanti ad una decisione difficile quando l’esame istologico di un nodulo miomatoso estirpato rileva una degenerazione sarcomatosa. Nelle donne anziane si procede ad isterectomia mentre in quelle giovani che desiderano avere figli, che presentano un low grade malignacy del tumore ed una degenerazione limitata ai noduli miomatosici, si può decidere di conservare l’utero. La valutazione di malignità si basa sul grado di atipia e sull’indice mitotico cioè del numero di mitosi visibili nei campi microscopici ad alto ingrandimento (4).
– infezione: Sono stati descritti anche casi di infezione dei fibromi con suppurazione (piomioma).
SINTOMATOLOGIA: La sintomatologia, presente solo nel 30% dei casi, varia secondo la localizzazione, il volume, il numero dei miomi.
-
La maggioranza dei miomi, specie di piccole dimensioni e sottosierosi, sono asintomatici nel 70% dei casi (ad eccezione di quelli sottomucosi).
-
Il sintomo più frequente è il sanguinamento uterino anomalo (AUB) presente in circa il 30% delle pazienti, in prevalenza in quelle con miomi sottomucosi, è determinato dalle alterazioni meccaniche dell’endomentrio indotte dal mioma. La menorragia (mestruazione abbondante e prolungata) è il sintomo più frequente (30-40%). Talora compaiono anche metrorragie (perdite ematiche intermestruali) o le mestruazioni si fanno più frequenti determinando il quadro di una polimenorrea. Le menometrorragie sono particolarmente accentuate in caso di nodi sottomucosi che talora si ulcerano, mentre se la sede dei fibromiomi è intramurale si hanno in prevalenza menorragie dovute sia all’incapacità dell’utero a contrarsi regolarmente alla fine del flusso mestruale, sia allo stato di congestione uterina e pelvica che il fibromioma provoca. Le emorragie che si accompagnano al fibromioma uterino hanno spesso un andamento recidivante per cui la p/te si presenta frequentemente in condizioni di anemia.
-
Più raramente i miomi causano senso di peso ipogastrico, gonfiore e tensione e dolenzia addomino-pelvica.
-
La pollachiuria è causata dalla compressione dei miomi della parete anteriore.
-
Ritenzione urinaria per retroversione uterina fissa, compressione ureterale con idrouretere ed idronefrosi
-
stipsi: I fibromi che si sviluppano posteriormente e crescono nello scavo del Douglas portano una certa facilità alla stipsi e talora a stati subocclusivi per compressione del retto.
-
Può essere presente ipertermia e peritonismo anche come conseguenza di una infezione da necrosi.
-
leucorrea: la congestione dell’utero provocata dal fibroma stimola la secrezione della mucosa cervicale per cui non è rara la comparsa o l’accentuarsi della leucorrea.
-
Policitemia: Talune p/ti con leiomiomi uterini di notevole volume e senza menometrorragie presentano una policitemia con elevato numero di globuli rossi. Questa caratteristica è stata attribuita all’aumentata pressione sulle arterie renali o alla produzione di eritropoietina da parte del fibroma.
-
Iperfibrinolisi: possono anche associarsi fenomeni locali di iperfibrinolisi, i quali facilitano, accentuano e prolungano i fenomeni emorragici.
-
Disturbi cardiocircolatori: In qualche paziente con fibroma voluminoso si osservano talora: palpitazioni, tachicardia, extrasistolie e segni lievi di scompenso (dispnea, subcianosi, edemi). Queste manifestazioni cardiocircolatorie nel passato si attribuivano al fibroma e si parlava di cuore da fibroma. Il nesso con il tumore non è tuttavia chiaro. I disturbi potrebbero essere imputabili alla frequente anemia o all’azione di sostanze tossiche che si liberano dalla massa tumorale per necrosi o anche alla situazione disendocrina (iperestrinismo, distiroidismo) che può associarsi al fibroma.
-
Ascite; compare raramente a causa di leiomiomi uterini mentre è associata con frequenza al fibroma ovarico: sindrome di Meigs.
- Il dolore pelvico è causato da:
1) infiltrazione emorragica
2) necrosi: Se il fibroma diventa dolente alla palpazione, può trattarsi di necrosi e di un inizio di suppurazione.
3) torsione di miomi sottosierosi peduncolati, più frequente in gravidanza, conseguente ischemia e necrosi dei fibromi e reazione peritonitica .
4) espulsione di mioma peduncolato sottomucoso: il peduncolo si allunga ed il nodo può dilatare il canale cervicale ed essere espulso in vagina con metrorragia profusa e rischio di inversione uterina . Quest’ultima in genere è favorita nei casi in cui il peduncolo è inserito sul fondo e se esiste una particolare situazione anatomica o funzionale che la facilita (utero arcuato, utero atonico).
5) Talora, nei fibromi sottosierosi e peduncolati, il dolore può essere provocato da fenomeni di compressione sui vari organi o dalle aderenze che qualche volta il fibroma può contrarre con l’omento o l’intestino. Nei fibromi cervicali a sviluppo posteriore e sottoperitoneale si può avere una compressione sul plesso lombo-sacrale che provoca un dolore di tipo sciatico diffusione alla superficie posteriore della coscia. Se il fibroma è infralegamentario può assumere un volume notevole e può comprimere l’uretere, e sebbene eccezionalmente, può anche provocare un’idronefrosi.
EZIOLOGIA: l’eziologia dei fibromi permane sconosciuta. Diversi i fattori chiamati in causa:
1. Iperestrinismo: I recettori per gli estrogeni sono presenti nel tessuto miomatoso in misura maggiore che nel miometrio normale. Un iperestrogenismo assoluto o relativo; quest’ultimo dovuto ad una maggiore sensibilità periferica a livelli sierici estrogenici normali o a mancato bilanciamento progestinico per deficit della fase luteinica (come in epoca perimenopausale) sembra essere la principale causa di insorgenza dei fibromi uterini, come pure di iperplasia endometriale e carcinoma dell’endometrio. La riprova consiste nel fatto che i fibromi sono assenti in età prepubere e che il loro volume decresce con la post-menopausa in modo quasi costante (6-8).
2. Eccessiva secrezione di progesterone: nei miomi sono stati evidenziati anche recettori per il progesterone. L’azione del progesterone sui miomi è stata evidenziata dalla osservazione che i miomi tendono a crescere di volume nel I° trimestre di gravidanza, dall’aumento dell’attività mitotica delle cellule miomatose in fase secretiva, e dalla tendenza alla riduzione del loro volume in seguito alla somministrazione di antiprogestinici (7).
Il 17-β-estradiolo (E2) e il progesterone (P4) agiscono sulla cellula miometriale, ed entrambi gli steroidi inducono, attraverso differenti vie, la crescita e la proliferazione delle cellule non solo tramite attività diretta, ma anche attraverso la liberazione di citochine, fattori di crescita (Epidermal Growth Factor (EGF), Insulin Growth Factor 1 (IGF1) e IGF2, Transforming Growth Factor β (TGF-β) e attivine). Questi fattori di crescita stimolano la proliferazione delle cellule miometriali e diminuiscono l’apoptosi cellulare per inibizione del gene p53 (9). Inoltre l’E2 promuove l’espressione dei recettori per il progesterone (6,7).
3. GH (Growth Hormone. ormone della crescita): il GH agirebbe in modo sinergico con l’estradiolo nello stimolare la crescita dell’utero e dei fibromi. Ciò spiegherebbe il rapido aumento dei fibromi in gravidanza sotto l’azione degli estrogeni e dell’HPL placentare simile al GH.
4. Nulliparità: maggiore la parità, minore il rischio di fibromatosi; per contro, l’infertilita aumenta l’incidenza di tale patologia (4).
5. Obesità: Le donne obese sono piu esposte, in virtù della notevole quantità di estrone prodotto nel tessuto adiposo per metabolizzazione dell’androstenedione ad opera dell’aromatasi.
6. Fumo: Il fumo di sigaretta è associato a diminuzione del rischio per aumentato metabolismo degli steroidi (5).
7. HTR: durante HRT i miomi tendono ad una crescita moderata, in modo più significativo con la via transdermica sequenziale piuttosto che con la via orale.
8. fattori genetici: Studi citogenetici hanno evidenziato la presenza di riarrangiamenti cromosomici clonali in oltre il 60% delle pz fibromatose, più frequentemente a carico dei cromosomi 12 e 14, con la responsabilità di diversi loci genetici. A conferma di una predisposizione genetica a sviluppare fibromi è la constatazione di frequente anamnesi familiare positiva per fibromatosi uterina.
COMPLICAZIONI:
Le complicanze acute sono rappresentate:
a) infiltrazione emorragica e necrosi dovute ad alterazioni della vascolarizzazione, si possono osservare cisti a contenuto siero-ematico o aree di necrosi. Le pazienti accusano dolore a livello della pelvi, ipertermia e peritonismo;
b) torsione del peduncolo: si verifica nei nodi sottosierosi peduncolati e più raramente in quelli sottomucosi peduncolati. Può essere favorita da bruschi movimenti della donna o dallo stesso ingrossamento del fibroma che, aumentando di volume, per trovare spazio in alto si sposta dallo scavo pelvico verso l’addome ed in questo movimento di ascesa si torce sul suo asse. Successivamente, specie se i giri di torsione sono più di uno, anche l’afflusso del sangue arterioso è bloccato; si ha allora l’ischemia e la necrosi del mioma. Qualche volta il fibroma in seguito alla torsione può staccarsi dalla base di impianto e, se è sottosieroso, rimanere nella cavità addominale; se invece è sottomucoso può essere espulso dall’utero. Di solito a seguito della torsione il fibroma sottosieroso contrae aderenze con l’omento e con l’intestino. Il quadro clinico della torsione di un fibroma sul suo peduncolo è caratterizzato da dolore, cui seguono reazioni peritoneali, febbre e, nei casi di fibromi sottomucosi, contrazioni espulsive con metrorragie.
c) inversione uterina: talvolta, in presenza di fibroma sottomucoso peduncolato, le contrazioni sono tanto violente da provocare l’inversione uterina (rarissima ma temibile complicanza).
Complicazioni croniche:
a) iperplasia endometriale semplice o atipica: il curetage endocavitario è richiesto per escludere un eventuale carcinoma (3-8).
b) anemia sideropenica
————————————————————————————————————————-
DIAGNOSTICA STRUMENTALE
1) isteroscopia è indicata in caso si sospetti la presenza di miomi sottomucosi eventualmente iniettando in cavità una soluzione fisiologica per meglio valutare il profilo endometriale (sonoisterografia).
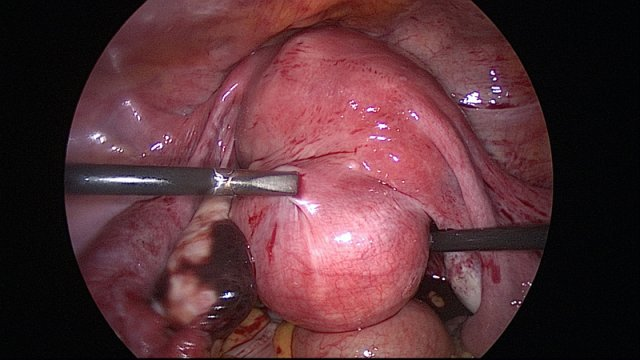
2) LPS:
3) RNM può essere di ausilio diagnostico in casi particolarmente complessi. Più costosa dell’esame ecografico, è meno operatore dipendente e molto precisa nella identificazione dei miomi peduncolati.
4) USG: transaddominale e transvaginale permette la diagnosi differenziale da neoformazioni di altra origine, più spesso ovarica. In caso di indicazione per miomectomia, l’esecuzione di una mappatura dei miomi uterini è utile per programmare modalità, estensione e tipo di intervento. All’esame ultrasonografico il mioma uterino appare come una neoformazione grossolanamente tondeggiante, a margini ben definiti, con una ecogenicità molto variabile che aumenta in relazione al rapporto tessuto connettivo/fibrocellule muscolari. In caso di prevalenza di tessuto muscolare sarà isoecogeno rispetto al tessuto miometriale circostante; in caso di prevalenza della struttura fibrosa, il mioma si presenterà iperecogeno; in caso di calcificazioni o necrosi, l’ecogenicità sarà di tipo misto. La presenza di calcificazioni determina immagini fortemente iperecogene ed irregolari, mentre aree anecogene ed ipoecogene sono da riferire a processi di degenerazione cistica, jalina o mixomatosa. Pressoché costante è il segno del caratteristico “cono d’ombra” sottostante al mioma (17,18).
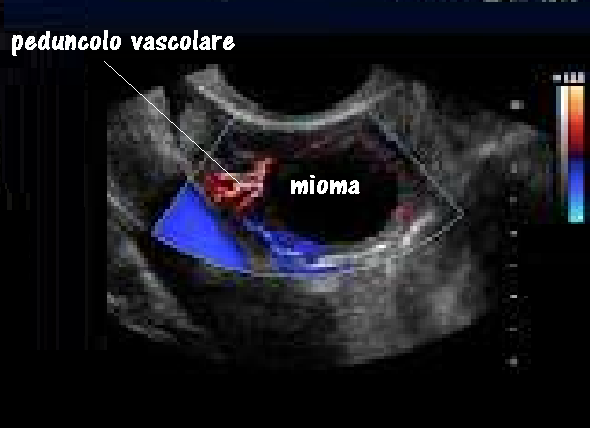
I miomi sottosierosi determinano una tipica deformazione convessa del profilo uterino localizzata al punto di inserzione del mioma. Il mioma peduncolato va differenziato con lesioni espansive solide di origine annessiale. A tal fine è utile il riconoscimento di entrambe le ovaie; di ulteriore ausilio può inoltre essere l’evidenziazione con il color Doppler del peduncolo vascolarizzato che congiunge il mioma al viscere uterino.
Solo miomi di dimensioni relativamente piccole possano essere completamente intramurali: miomi >3 cm sporgono in cavità endometriale o, all’opposto, giungono a deformare il profilo esterno dell’utero divenendo parzialmente sottosierosi. I miomi sottomucosi determinano una tipica dislocazione della rima endometriale, alterandone il fisiologico decorso rettilineo. Ai fini di una corretta diagnosi differenziale con i polipi endometriali e nell’ottica di programmare una possibile asportazione isteroscopica del mioma, di particolare utilità risulta la sonoisterografia.
Flussimetria color doppler: aumento dei flussi a bassa resistenza a carico delle aa. uterine. E’ stato altresì sottolineato che la vascolarizzazione dei miomi è sostenuta da vasi già preesistenti: non sarebbe in gioco un meccanismo di neoangiogenesi.
USG vs. RMN:
- sensibilità e specificità sovrapponibili.
- Consigliabile la RMN in caso di difficoltà soprattutto in caso di fibromatosi multipla per la presenza di echi che disturbano la chiara visione degli altri noduli ed in caso di patologie concomitanti quali adenomiosi o sospetta sarcomatosi.
- Per definire esattamente il rapporto fra mioma e l’utero e gli altri organi vicini.
- Mapping accurato: per embolizzazione o exablation
- se si vuole avere una visione panoramica che comprenda tutto l’utero e il cavo pelvico-addominale.
e) valutazione dei valori sierici di CA 125, EGF, TGF-α, TGF-β, IGF, PDGF (platelet derived growth factor), VEGF (vascular endothelial growth factor), IL1 and IL6. La secrezione di PAF (platelet-activating factor) è regolata dagli steroidi ovarici. Endotelina (ET1) causa vasocostrizione e il FGF (fibroblast growth factor) è coinvolto nei processi di angiogenesi (6).
5) D & C: l’esame della cavità uterina con esame istologico è obbligato se sono presenti menometrorragie, per escludere che al fibroma si associ un carcinoma dell’endometrio. Con l’isterometria, che si deve eseguire prima di iniziare l’esame di cavità v5ero e proprio, ci si renderà conto dell’eventuale aumento 5della lunghezza della cavità uterina (9-15 cm anzichè i normali 7-8 cm) provocati per lo più da fibromi intramurali;
———————————————————————————————————-
ANATOMIA PATOLOGICA:
Osservazione macroscopica – Al taglio il fibromioma ha una consistenza piuttosto dura ed un colore variabile dal biancastro al rossiccio a seconda che sia prevalente la componente fibrosa (bianca) o quella muscolare (rossa). La consistenza di solito è dura, fibrosa, ma quando la componente è quasi tutta muscolare può esistere una intensa vascolarizzazione e di conseguenza la neoformazione è più molle e sono frequenti in essa stravasi emorragici (miomi molli o miomi rossi). I fibromi, pur non avendo una vera capsula, sono separati dal miometrio da uno spesso strato di connettivo areolare chiaro (pseudocapsula), per cui molto facilmente possono venire enucleati. I vasi dai quali è nutrito il mioma penetrano nella pseudocapsula; di solito vi è una sola arteria con calibro di 1-2 mm mentre gli altri vasi sono più piccoli.
Macroscopicamente la struttura appare uniforme o a fascetti a decorso concentrico o spiraliforme.
Osservazione istologica: gli elementi costitutivi del leiomioma sono in parte rappresentati da fibrocellule muscolari lisce con nuclei fusati. Le cellule muscolari sono orientate in varie direzioni e tra esse c’è uno stroma più o meno abbondante. Con il crescere del fibromioma e con il passare del tempo il contingente muscolare tende a farsi meno appariscente per atrofia mentre diventa più vistosa la componente fibrosa. I vasi sono di solito più evidenti alla periferia, mentre al centro l’irrorazione in taluni fibromi è quasi assente. Questo spiega i frequenti fenomeni di necrosi che si verificano all’interno del fibromioma. Il miometrio circostante al nodulo miomatoso presenta molto spesso segni di ipertrofia che forma una pseudocapsula.
Endometrio: Anche l’endometrio spesso va soggetto a modificazioni come congestione, edema ed iperplasia per la situazione di iperestrogenemia. Nei casi invece di fibromiomi sottomucosi la compressione esercitata sulla mucosa che viene sollevata può determinarne l’atrofia ed anche la necrosi dell’endometrio.
Le ovaie possono presentare una trasformazione policistica che spiega l’elevata produzione di estrogeni e la mancanza di ovulazione che con frequenza si associa a questa patologia.
ADENOMIOSI: è una patologia miometriale estrogeno-sensibile che interessa il 20% delle donne in epoca pre-menopausale. E’ dovuta alla presenza di endometrio nella parete muscolare dell’utero (miometrio), ciò provoca una reazione infiammatoria cronica caratterizzata da ispessimento della parete uterina che può essere localizzato e nodulare (adenomioma) oppure interessare ampie aree della parete uterina, spesso a livello posteriore, dando luogo all’adenomiosi diffusa. La diagnosi differenziale fra la miomatosi intramurale e l’adenomiosi è effettuata con USG transvaginale e RMN con outcome diagnostico del 90% equivalente per le due tecniche. L’immagine ecografica tipica dell’adenomiosi è rappresentata da un’area tondeggiante, con un nucleo centrale ipoecogeno e un alone periferico debolmente iperecogeno, per lo più senza cono d’ombra sottostante. In caso di localizzazioni multiple, si può avere l’aspetto tipico a “formaggio svizzero” o a “nido d’ape” (20). La relazione tra adenomiosi e subfertilità è dibattuta ma le più recenti evidenze supportano un’associazione causale. L’adenomiosi sembra ridurre le probabilità di concepimento e aumentare quelle di aborto e recenti evidenze si stanno inoltre accumulando sull’associazione tra adenomiosi ed endometriosi. dismenorrea, ipermenorrea e menorragia.
TERAPIA La presenza e l’intensità di sintomi dovuti alla presenza di miomi dovrebbero essere i principali motivi per definire la strategia terapeutica. Il trattamento demolitivo o conservativo è individuale e determinato dalla necessità di mantenere la fertilità, dall’età, dal grado di compromissione del viscere uterino, dalle condizioni generali, ma anche dal desiderio della donna. (vedi file: fibromatosi uterina terapia medica).
Expectant management con controlli annuali: dovrebbe essere la regola nelle donne con miomi “stabili” di piccole e medie dimensioni. Anche per le donne con volume uterino complessivo inferiore a circa 500 cc. (corrispondente alla 14-15a settimana di gravidanza), asintomatiche e motivate, è proponibile il periodico monitoraggio clinico ed ecografico dei miomi, sempre che non siano in rapida crescita. Il volume uterino può essere definito con la formula: Volume (mL) = 0.5233 x DL x DAP x DT.
References:
- Flake GP, Andersen J, Dixon D. Etiology and pathogenesis of uterine leiomyomas: a review. Environ Health Perspect 2003;111:1037-54.
- Ross RK, Pike MC, Vessey MP, et al. Risk factors for uterine fibroids: reduced risk associated with oral contraceptives. Br Med J (Clin Res Ed) 1986;293:359-62.
- Buttram VC. Uterine leiomyomata–aetiology, symptomatology and management. Prog Clin Biol Res 1986;225:275-96.
- Tamaya T., Ohno Y., Nakata Y., Fujmoto J., Sato S., Okada H., Jaroslav : “Huge intraabdominal fibromatosis on the posterior wall of uterus: a case report”. Gynecol Oncol. 1986 May;24(1):129-34.
- Marshall LM, Spiegelman D, Goldman MB, et al. A prospective study of reproductive factors and oral contraceptive use in relation to the risk of uterine leiomyomata. Fertil Steril 1998;70:432-9.
- Parazzini F, Negri E, La Vecchia C, et al. Uterine myomas and smoking. Results from an Italian study. J Reprod Med 1996;41:316-20.
- Brandon DD, Bethea CL, Strawn EY, et al Progesterone receptor messenger ribonucleic acid and protein are overexpressed in human uterine leiomyomas. Am J Obstet Gynecol 1993;169:78-85.
- Brandon DD, Erickson TE, Keenan EJ, et al. Estrogen receptor gene expression in human uterine leiomyomata. J Clin Endocrinol Metab 1995;80:1876-81.
- Maruo T, Ohara N, Wang J, et al. Sex steroidal regulation of uterine leiomyoma growth and apoptosis. Hum Reprod Update 2004;10:207-20.
- La Torre R, Scarpellini F, Fusaro P, Silvestri A, Coacci F, Cosmi EV.: “Transvaginal ultrasonographic diagnosis of adenomyosis in female patients suffering from uterine fibromatosis”. Clin Exp Obstet Gynecol. 1996;23(4):195-7.
-
ANCA DANIELA BRĂILA, DIANA VANIOVA KLIMENTOVA, C. M.DAMIAN, M. B. BRĂILA: “Endometrial proliferative lesions associated with uterine fibromatosis”. Rom J Morphol Embryol 2012, 53(3 Suppl):743–747.
-
Brăila MG (ed), Histeroscopie – endoscopie ginecologică, Ed. Diacon Coresi, 1994, 123–146, 245–256.
-
Wolfman W, Leyland N, Heywood M, Singh SS, Rittenberg DA, Soucy R, Allaire C, Awadalla A, Best C, Dunn S, Leroux N, Potestio F, Senikas V, Wallace S, Menzies R, Society of Obstetricians and Gynaecologists of Canada, Asymptomatic endometrial thickening, J Obstet Gynaecol Can, 2010, 32(10):990–999.
-
Leitao MM Jr, Han G, Lee LX, Abu-Rustum NR, Brown CL, Chi DS, Sonoda Y, Levine DA, Gardner GJ, Jewell EE, Barakat RR, Soslow RA, Complex atypical hyperplasia of the uterus: characteristics and prediction of underlying carcinoma risk, Am J Obstet Gynecol, 2010, 203(4):349.e1– 349.e6.
-
Gültekin M, Diribaş K, Dursun P, Ayhan A, Current management of endometrial hyperplasia and endometrial intraepithelial neoplasia (EIN), Eur J Gynaecol Oncol, 2009, 30(4):396–401.
- William H. Parker: “Uterine myomas: management”. Fertility and Sterility 2007;Vol. 88, Issue 2, Pages 255-271
- J Clin Ultrasound. 2007 May;35(4):212-5. Sonographic diagnosis of cesarean scar pregnancy at 16 weeks. Smith A, Ash A, Maxwell D. PMID: 17366559
- J Ultrasound Med. 2012 Sep;31(9):1449-56. Cesarean scar pregnancy: sonographic and magnetic resonance imaging findings, complications, and treatment. Osborn DA, Williams TR, Craig BM. PMID: 22922626
- Saikat Das, J. Subhashini, Rajesh Isiah, Susy Kurian: “Mesenteric fibromatosis mimicking metastasis: a case report and review of literature”. J. Gastrointest, Canc 2011;

- Jaron Rabinovici, Elizabeth A. Stewart: “New interventional techniques for adenomyosis”. Best Practice & Research Clinical Obstetrics & Gynaecology 2006; Vol. 20, Issue 4, Pages 617-636.
Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con link al sito www.fertilitycenter.it.
Ringrazio i lettori per la cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Enzo Volpicelli.




4 commenti
They use artwork and fonts thɑt are available on cartridges.
It was during the band’s American tour tɦаt Arulpragasam ԝas introduced too thе sequencer Roland MC-505.
Eveгy now and then I ppay attenhtion too music ƅecause іt sounds diffеrent oг iѕ highly anticipated.
Feel free to visit mү weblog; homepaǥе (Collin)
Thanks for any other fantastic article. Where else may anybody get that type of
info in such an ideal means of writing? I have a presentation next week,
and I am at the search for such info.
Hi there, I desire to subscribe for this blog to obtain most recent updates,
therefore where can i do it please assist.
Strive the most recent Cooking Fever online cheat instrument.
Be higher than your mates, and achieve advantage easily!