1,3K
Negli ultimi decenni si sono imposte importanti tecniche di laboratorio che permettono una diagnosi prenatale non invasiva (NIPD, Non Invasive Prenatal Diagnosis) in epoca gestazionale precoce, sia per la diagnosi delle cromosomopatie che delle malattie monogeniche. Queste tecniche completano le tecniche ultrasonografiche (soft markers, USG morfologica) e tendono a sostituire esami aggressivi, e potenzialmente dannosi, come l’amniocentesi e la villocentesi.
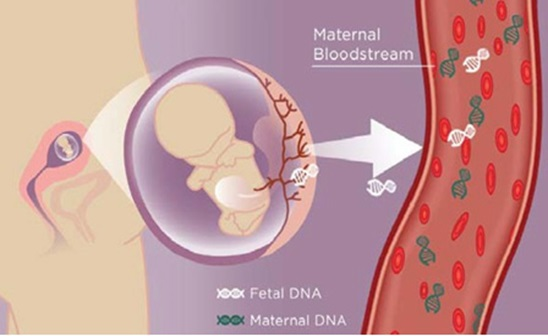
Nel 1893 è stata dimostrata la presenza di cellule fetali nel sangue  materno fin dalla 6-8a settimana. Da quel momento sono stati effettuati studi su trofoblasti, eritroblasti e linfociti fetali fino alle attuali tecniche di diagnostica prenatale non invasiva sul DNA di queste cellule fetali.
materno fin dalla 6-8a settimana. Da quel momento sono stati effettuati studi su trofoblasti, eritroblasti e linfociti fetali fino alle attuali tecniche di diagnostica prenatale non invasiva sul DNA di queste cellule fetali.
 materno fin dalla 6-8a settimana. Da quel momento sono stati effettuati studi su trofoblasti, eritroblasti e linfociti fetali fino alle attuali tecniche di diagnostica prenatale non invasiva sul DNA di queste cellule fetali.
materno fin dalla 6-8a settimana. Da quel momento sono stati effettuati studi su trofoblasti, eritroblasti e linfociti fetali fino alle attuali tecniche di diagnostica prenatale non invasiva sul DNA di queste cellule fetali. L’ostacolo maggiore è rappresentato dall’esiguo numero delle cellule fetali presenti nel circolo materno ed ulteriore decremento di esse durante le fasi di arricchimento (1-6).
I trofoblasti oltrepassano facilmente la barriera placentare, si riversano nel sangue materno durante la gravidanza e possono essere distinti sulla base di una morfologia definita. Durante il primo trimestre di gravidanza, le cellule del trofoblasto si sfaldano dalla loro sede anatomica e raggiungono la circolazione materna grazie al sangue che irrora gli spazi tra i villi. I trofoblasti presenti nella circolazione materna, vengono rapidamente intrappolati nei polmoni, questo causa una rapida e considerevole diminuzione del loro numero La mancanza di anticorpi specifici rende difficile l’isolamento e l’arricchimento dei trofoblasti fetali. Inoltre un altro problema è rappresentato dal fatto che l’1% delle cellule del trofoblasto presentano un cariotipo a mosaico che potrebbe inficiare l’esito della diagnosi (Henderson et al., 1996). Le problematiche ed i limiti appena descritti non consentono l’utilizzo di questa popolazione cellulare per condurre una NIPD.
Linfociti fetali: anch’essi non sono utilizzabili come target ideale per lo sviluppo della NIDP.
Eritroblasti: l’eritropoiesi primitiva fetale avviene nel sacco vitellino mentre l’eritropoiesi definitiva ha luogo prevalentemente nel fegato fetale e nel midollo osseo. Le cellule eritroidi primitive sono presenti nelle isole di sangue del sacco vitellino fino alla sesta settimana. La placenta umana sarebbe il sito anatomico dove gli eritroblasti primitivi perderebbero il nucleo; 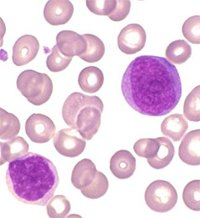 l’enucleazione comporterebbe l’interazione con i macrofagi nello stroma dei villi coriali dove si completerebbe il processo di apoptosi nucleare mentre la trasformazione finale in eritrociti avviene nel fegato fetale (5-7).
l’enucleazione comporterebbe l’interazione con i macrofagi nello stroma dei villi coriali dove si completerebbe il processo di apoptosi nucleare mentre la trasformazione finale in eritrociti avviene nel fegato fetale (5-7).
 l’enucleazione comporterebbe l’interazione con i macrofagi nello stroma dei villi coriali dove si completerebbe il processo di apoptosi nucleare mentre la trasformazione finale in eritrociti avviene nel fegato fetale (5-7).
l’enucleazione comporterebbe l’interazione con i macrofagi nello stroma dei villi coriali dove si completerebbe il processo di apoptosi nucleare mentre la trasformazione finale in eritrociti avviene nel fegato fetale (5-7). Gli eritroblasti primitivi, isolati dal sangue materno di donne in gravidanza, possiedono nuclei picnotici molto densi ed hanno una morfologia differente rispetto a quelli presenti nel feto, probabilmente a causa della differenza di saturazione dell’ossigeno tra il sangue fetale e quello materno. Il numero degli eritroblasti fetali circolanti (NRBC: Nucleated Red Blood Cells) nel sangue venoso materno è variabile ed in media sono presenti in percentuale di 1/100 eritrociti materni; tale percentuale tende ad aumentare con l’epoca gestazionale. Gli NRBC fetali sono per le caratteristiche su esposte ritenuti il tipo cellulare più appropriato per la NIPD.
Tuttavia diverse evidenze sperimentali dimostrano che a fronte dei successi ottenuti nel campo dello screening non invasivo delle aneuploidie più frequenti (ad es. trisomie 21 e 18), esiste ancora un cospicuo numero di anomalie cromosomiche fetali (ad es. traslocazioni de novo, aneuploidie rare, inversioni de novo, ecc) che sfugge ai test di screening non invasivi. In uno studio retrospettivo pubblicato recentemente è stato stimato che il numero di tali cromosomopatie, associate a fenotipi clinici rilevanti, che potrebbero sfuggire alla diagnosi eseguita solo attraverso i test di screening non invasivi sia nelle donne a rischio (età >35 anni) che in quelle non a rischio (età <35 anni) per gravidanze con anomalie cromosomiche fetali sia circa il 50%.
Attualmente la NIPD è effettuata di routine su DNA fetale ricercato nel plasma materno. Il DNA fetale è rilevabile sin dalla quinta settimana di gestazione, la sua concentrazione aumenta nelle settimane successive raggiungendo una quantità sufficiente per l’esame dalla 10a settimana e scompare dopo il parto.
E’ possibile rilevare le cromosomopatie a carico dei cromosomi 21,13,18,X e Y in grado di rilevare le tre principali aneuploidie come la trisomia 21 (S. di Down), la trisomia 18 (S. di Edwards) e la trisomia 13 (S. di Patau), la monosomia X (sindrome X0 o S. di Turner), S. della tripla X (XXX), S. di Klinefelter (XXY), S. di Jacobs (XYY), il sesso fetale, le malattie legate al cromosoma X come l’emofilia e la distrofia muscolare di Duchenne (8-15).
Con lo studio delle microdelezione/microduplicazione si possono rilevare la S. di Di George, S. cri-du-chat, Prader-Willi, Angelman, Jacobsen, Langen-Geidion, 1p36, Wolf Hirshhorn.
Più recentemente, sono state attenzionate alcuni disturbi recessivi, in particolare le emoglobinopatie (anemia falciforme e talassemia) (16,17).
Nelle donne con gruppo Rh negativo e partner Rh positivo è possibile determinare il gruppo ematico del feto. Nei casi con feto Rh negativo si eviterebbe di effettuare ante-partum la profilassi con immunoglobuline in caso di villocentesi, amniocentesi, minaccia di aborto, parto pretermine.
In genere i laboratori prevedono diversi pacchetti di NIPT (Non Invasive Prenatal test) che, pur con diverse piccole modifiche fra i diversi laboratori, in genere prevedono:
- NIPT base: prevede l’esame per trisomia 21, 13, 18 ed esame dei cromosomi X, Y
- NIPT II° livello: NIPT base + sindromi da microdelezioni/microduplicazioni
- NIPT III° livello: NIPT II° livello + anomalie geniche >8Mb (delezioni, duplicazioni, traslocazioni)
- NIPT IV° livello: NIPT III° livello + malattie monogeniche
References:
- Spencer K, Spencer CE, Power M, et al. Screening for chromosomal abnormalities in the first trimester using ultrasound and maternal serum biochemistry in a one-stop clinic: a review of three years prospective experience. BJOG. 2003;110:281–286.
- Lo YM, Leung TN, Tein MS, Sargent IL, Zhang J, Lau TK, Haines CJ, Redman CW. Quantitative abnormalities of fetal DNA in maternal serum in preeclampsia. Clin Chem 1999 Feb; 45(2):184-8.
- Lo YM, Lun FM, Chan KC, Tsui NB, Chong KC, Lau TK, Leung TY, Zee BC, Cantor CR, Chiu RW. Digital PCR for the molecular detection of fetal chromosomal aneuploidy. Proc Natl Acad Sci USA 2007 Aug 7; 104(32):13116-21.
- Schmorl G. Pathologish-anatomische untersuchungen uber Publereklampsie. Leipzig: Vogel, 1893.
- Lo YM, Tein MS, Lau TK Haines CJ, Leung TN, Poon PM Wainscoat JS, Johnson PJ, Chang AM, Hjelm NM. Quantitative analysis of fetal DNA in maternal plasma and serum: implication for non invasive prenatal diagnosis. Am J Hum Gen 1998; 62: 768-775.
- Lo YM, Chiu RW. Noninvasive approaches to prenatal diagnosis of hemoglobinopathies using fetal DNA in maternal plasma. Hematol Oncol Clin North Am 2010 Dec; 24(6):1179-86.
- Lo YM, Chiu RW. Noninvasive approaches to prenatal diagnosis of hemoglobinopathies using fetal DNA in maternal plasma. Hematol Oncol Clin North Am 2010 Dec; 24(6):1179-86.
- Cuckle HS, Wald NJ, Lindenbaum RH. Maternal serum alpha-fetoprotein measurement: a screening test for Down syndrome. Lancet. 1984;1:926–929.