La somatostatina, ormone decatetrapeptide, scoperto nel 1968, è prodotto in varie regioni dell’organismo; essenzialmente ha proprietà inibenti.
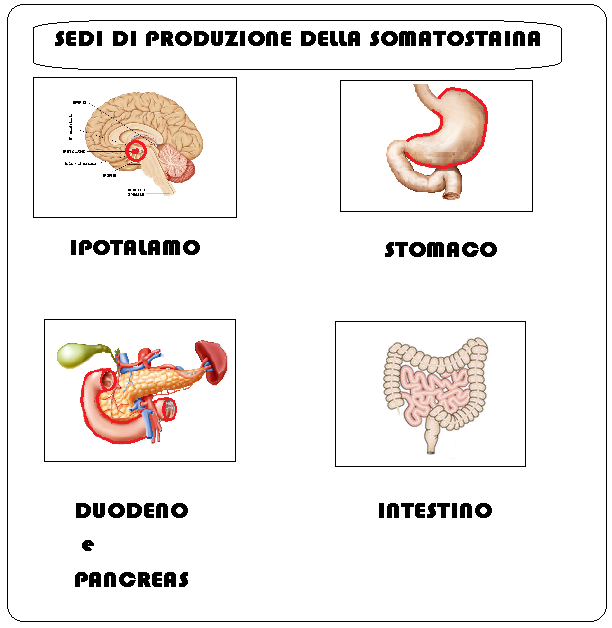
Sedi di produzione – la somatostatina è prodotta in diverse regioni del ns. organismo (1-6); le più importanti sono:
- ipotalamo: regione periventricolare, strato esterno e interno dell’eminenza mediana, gambo ipofisario, nuclei premammillari ventromediali, arcuati e ventrale
- pancreas. Le cellule pancreatiche δ (sistema APUD, Amine Precursor Uptake and Decarboxylation), secernono somatostaine e, come quelle gastro-intestinali, hanno la caratteristica comune di essere originate a livello embrionale dalla cresta neurale romboencefalica, di secernere sostanze di tipo ormonale e di contenere ammine e loro precursori e di poterli decarbossilare.
- tratto intestinale: le cellule δ del sistema APUD si trovano a diversi livelli del tubo digerente
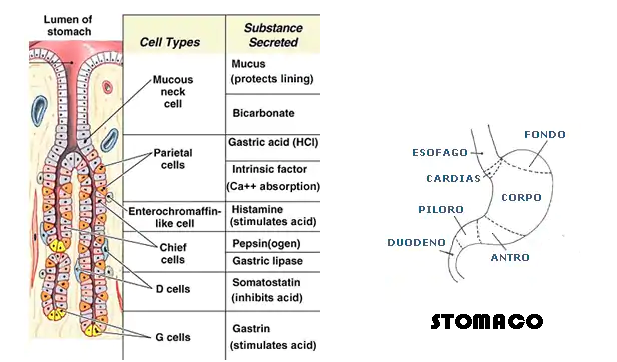
- stomaco: secreta dalle cellule antrali δ (sistema APUD), ha effetto inibitorio sulla secrezione di gastrina, acido cloridrico, istamina, pepsina e, a livello duodenale, la secrezione disecretina e colecistochinina (CCK).
Concentrazioni sieriche: valori normali si aggirano sui 10-22 pg/ml che aumentano con l’avanzare dell’età e per tale motivo la somatostatina è anche detta ormone della vecchiaia. Valori molto elevati (>400 pg/ml) si riscontrano nel ca. midollare della tiroide, feocromocitoma (47 pg/ml) (12,13), somatostatinoma (19-27).
Attività della somatostatina (ST) – La ST svolge funzioni diverse a seconda dell’organo di produzione (8-11):
- Esercita un potente effetto inibente sulla secrezione di GH (somatotropina o ormone della crescita) e prolattina a livello ipotalamico e ipofisario.
- inibisce l’attività secretoria del glucagone e a livello pancreatico riducendo l’iperglicemia e, di conseguenza, l’iperinsulinemia in modo significativo (14-18).
- renina, ormoni tiroidei e cortisolo sono anch’essi inibiti dalla ST
- effetto inibente anche sulla secrezione gastrica di secretina, acido cloridrico, gastrina e la secrezione duodenale di di colecistochinina (CCK)
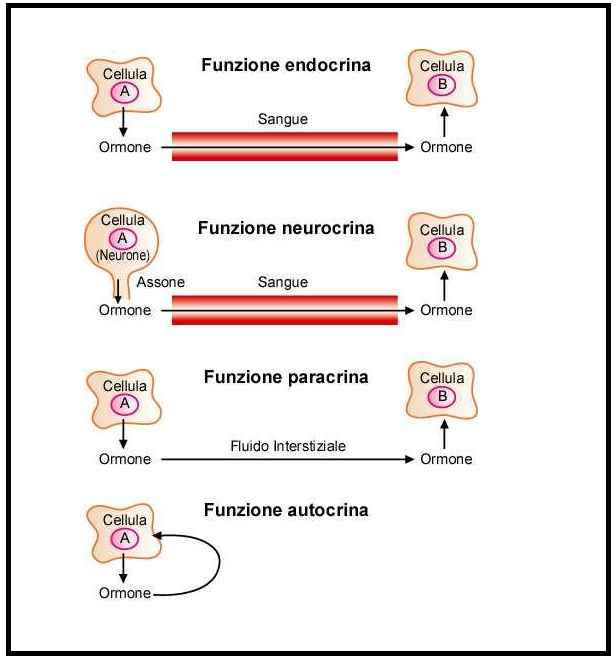
Meccanismo d’azione della somatostatina – La ST viene riversata nel circolo ematico, nelle sinapsi e nello spazio intercellulare in risposta ad una varietà di stimoli. In considerazione delle sue molteplici funzioni, vari siti di sintesi e rilascio, e rapida inattivazione, nonché concentrazioni estremamente basse nel sangue periferico, la somatostatina può difficilmente essere considerata un ormone vero e proprio che classicamente viene riversato in circolo per raggiungere l’organo bersaglio. Invece gli organi bersaglio della ST possono trovarsi vicino alle cellule produttrici di somatostatina o possono essere raggiunti attraverso la circolazione locale come il sistema portale ipofisario e la circolazione microportale nella mucosa intestinale. La somatostatina rilasciata dai neuroni agisce come un ormone ipofisotropico e un neurotrasmettitore o neuromodulatore. Inoltre, la somatostatina può anche agire in modo paracrino essendo rilasciata nello spazio intercellulare. Questo spazio può talvolta essere compartimentato da giunzioni strette in modo che l’azione del peptide sia limitata solo alle cellule adiacenti. In questo modo, la somatostatina delle isole pancreatiche influenza le attività delle cellule α e ß nelle vicinanze. Le cellule intestinali δ, prototipi di APUD o cellule paraneuroniche, mostrano una notevole somiglianza con le cellule neurosecretorie non solo nei processi biochimici ma anche morfologicamente. Mentre i neuroni della somatostatina nel cervello rispondono agli agonisti dopaminergici e catecolaminergici, le cellule δ nell’intestino rispondono agli stimoli chimici nel lume rilevandoli con microvilli.
In passato la somatostatina è stata utilizzata nella terapia di numerose patologie neoplastiche (cura Di Bella). Attualmente è utilizzata solo per la cura di tumori benigni dell’ipofisi e poche altre patologie.
References:
- Toni R (2004) The neuroendocrine system: organization and homeostatic role. J Endocrinol Invest 27(Suppl 6):35–47
- Scharrer E, Scharrer B (1940) Secretory cells within the hypothalamus. Res Publ Assoc Res Nerv Ment Dis 20:170–1942.
- Pearse AG (1986) The diffuse neuroendocrine systems: peptides, amines, placodes and the APUD theory. Prog Brain Res 68:25–31
- DeLellis RA, Tischler AS (1991) The dispersed neuroendocrine cell system. In: Kovacs K, Asa SL (eds) Functional endocrine pathology, vol 1. Blackwell Scientific Publications, Boston, pp 493–508
- [In vitro somatostatin secretion from the median eminence and the neurohypophysis].Zingg HH, Dreifuss JJ, Patel YC.Bull Schweiz Akad Med Wiss. 1978 Mar; 34(1-3):145-53.
- Hypothalamic hormones.Reichlin S, Saperstein R, Jackson IM, Boyd AE 3rd, Patel Y.Annu Rev Physiol. 1976; 38:389-424.
- Neuroendocrinology. 1981;33(4):246-56.Somatostatin: regulation of secretion.Role of growth hormone (GH)-releasing hormone and somatostatin in the mediation of clonidine-induced GH release in sheep.
- Cellular localization of somatostatin in endocrine-like cells and neurons of the rat with special references to the A1-cells of the pancreatic islets and to the hypothalamus.Hökfelt T, Efendić S, Hellerström C, Johansson O, Luft R, Arimura A.Acta Endocrinol Suppl (Copenh). 1975; 200:5-41.
-
Magnan E, Cataldi M, Guillaume V, Mazzocchi L, Dutour A, Razafindraibe H, Sauze N, Renard M, Oliver C.Endocrinology. 1994 Feb; 134(2):562-7.
-
Arimura A, Fishback JB.Elliott AD, Ustione A, Piston DW. Somatostatin and Insulin Mediate Glucose-Inhibited Glucagon Secretion in the Pancreatic α-Cell by Lowering cAMP. Am J Physiol Endocrinol Metab. 201
- Secretion of somatostatin and its physiologic function.Reichlin S.J Lab Clin Med. 1987 Mar; 109(3):320-6.
-
Horm Metab Res. 1982 Feb;14(2):71-6. Plasma somatostatin in normal subjects and in various diseases: increased levels in somatostatin-producing tumors. Saito H, Saito S.
- Plasma and tumor levels of somatostatin (SRIF) and somatostatin immunochemistry in medullary thyroid carcinoma: apparently discrepant preliminary results. Franc B, Chayvialle JA, Modigliani E, Calmettes C, Caillou B, Dutrieux-Berger N, Houdent C, Kujas M.Henry Ford Hosp Med J. 1987; 35(2-3):147-8.
-
Acta diabetologia latinaMay 1975, Volume 12, Issue 3–4, pp 219–231| The effect of somatostatin on plasma insulin and growth hormone levels in basal conditions and after glucagon in normal and acromegalic subjects Ferdinando Massara, Giustina Porzio, Franco Camanni, Gian Michele Molinatti
-
Alberti K. G. M. M., Christensen N., Christensen E. S., Hansen P. A., Iversen J., Lundbæk K., Seyer-Hansen K., Ørskov H.: Inhibition of Insulin Secretion by Somatostatin — Lancet2, 1299, 1973.
- Copinschi G., Virasoro E., Vanhaelst L., Leclercq R., Golstein J., L’Hermite M.: Specific Inhibition by Somatostatin of Growth Hormone Release after Hypoglycaemia in Normal Man — Clin. Endocr.3, 441, 1974.
-
Curry D. L., Bennet L. L.: Dynamics of Insulin Release by Perfused Rat Pancreases. Effects of Hypophysectomy, Growth Hormone, Adrenocorticotropic Hormone and Hydrocortisone — Endocrinology93, 602, 1973.
-
De Vane G. W., Siler T. M., Yen S. S. C.: Acute Suppression of Insulin and Glucose Levels by Synthetic Somatostatin in Normal Human Subjects — J. clin. Endocr.38, 913, 1974.CrossRefGoogle Scholar
- Protocol for the Examination of Specimens from Patients with Tumors of the Endocrine Pancreas. Based on AJCC/UICC TNM, 7th ed. Protocol web posting date: Aug 2016. College of American Pathologists (CAP). Northfield, IL [Revised: Aug 2016; Accessed: July 2018]
- Protocol for the Examination of Specimens from Patients with Neuroendocrine Tumors (Carcinoid Tumors) of the Small Intestine and Ampulla. Based on AJCC/UICC TNM, 7th ed. Protocol web posting date: Oct 2013. College of American Pathologists (CAP). Northfield, IL [Revised: Oct 2013; Accessed: Mar 2018]
- Protocol for the Examination of Specimens from Patients with Neuroendocrine Tumors (Carcinoid Tumors) of the Stomach. Based on AJCC/UICC TNM, 7th ed. Protocol web posting date: Oct 2013. College of American Pathologists (CAP). Northfield, IL [Revised: Jun 2014; Accessed: Mar 2018]
- NCCN Clinical Practice Guidelines in Oncology, Neuroendocrine and Adrenal Tumors. Version 4.2018. National Comprehensive Cancer Network. Fort Washington, PA [Updated: May 2018; Accessed: Jul 2018]
- O’Toole D, Grossman A, Gross D, Fave GD, Barkmanova J, O’Connor J, Pape U, Plöckinger U, Mallorca Consensus Conference participants, European Neuroendocrine Tumor Society. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: biochemical markers. Neuroendocrinology. 2009; 90(2): 194-202. PubMed
- Oberg K, Knigge U, Kwekkeboom D, Perren A, ESMO Guidelines Working Group. Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012; 23 Suppl 7: vii124-30. PubMed
- Vinik AI, Woltering EA, Warner RR, Caplin M, O’Dorisio TM, Wiseman GA, Coppola D, Go VL, North American Neuroendocrine Tumor Society (NANETS). NANETS consensus guidelines for the diagnosis of neuroendocrine tumor. Pancreas. 2010; 39(6): 713-34. PubMed
- Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec J, Salazar R, Sauvanet A, Kianmanesh R, Barcelona Consensus Conference participants. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology. 2012; 95(2): 98-119. PubMed
- Kulke MH, Anthony LB, Bushnell DL, de Herder WW, Goldsmith SJ, Klimstra DS, Marx SJ, Pasieka JL, Pommier RF, Yao JC, Jensen RT, North American Neuroendocrine Tumor Society (NANETS). NANETS treatment guidelines: well-differentiated neuroendocrine tumors of the stomach and pancreas. Pancreas. 2010; 39(6): 735-52. PubMed



1 commento
If you wish ffor to tame a good deal from this article thsn yyou hawve to apply these techniues too
your won web site.