Ultimo aggiornamento: 09/03/2025
La sindrome di Cushing è rappresentata da una costellazione di anomalie cliniche provocate da livelli ematici cronicamente elevati di cortisolo o di corticosteroidi ad esso correlati.
Il morbo di Cushing è la sindrome di Cushing dovuta a un’eccessiva produzione ipofisaria di ormone adrenocorticotropo (ACTH), generalmente secondaria a un adenoma ipofisario.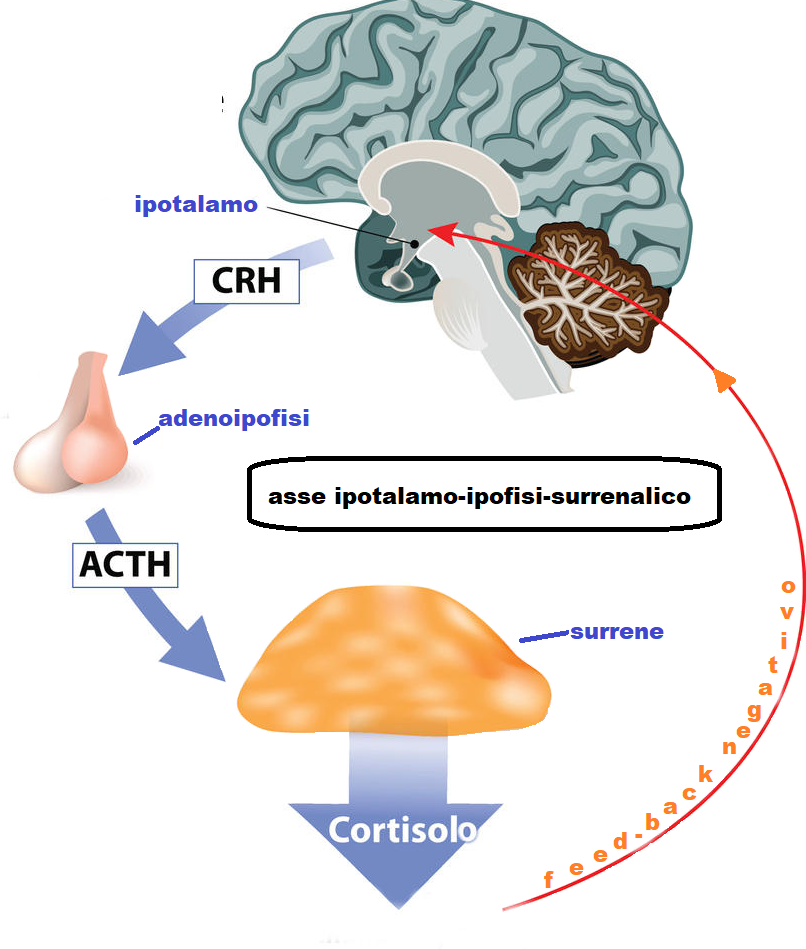
Eziologia – L’ipersecrezione surrenalica può essere ACTH-dipendente o ACTH-indipendente.
L’ipersecrezione surrenalica ACTH-dipendente può derivare da:
- Ipersecrezione di ACTH da parte di adenoma ipofisario (morbo di Cushing) nell’80% dei casi
- secrezione di ACTH da parte di una neoplasia non ipofisaria (carcinoma a piccole cellule del polmone, tumore carcinoide di tiroide, ovaio, pancreas) nel 19,9% dei casi
- Somministrazione di ACTH esogeno (0,1% dei casi)
L’ipersecrezione surrenalica ACTH-indipendente in genere deriva da
- Cushing iatrogeno: da somministrazione terapeutica prolungata di corticosteroidi
- Adenomi o carcinomi surrenalici
- displasia surrenalica nodulare primitiva pigmentata (di solito nell’adolescenza) e la displasia macronodulare (nei pazienti anziani).
Sintomatologia: Le manifestazioni cliniche della sindrome di Cushing comprendono
- Facies “a luna piena”
- Obesità del tronco con cuscinetti di grasso prominenti a livello sopraclaveare e cervico-dorsale (gibbo di bufalo)
- Dita molto sottili
- astenia e ipotrofia muscolare
- cute sottile e atrofica, con scarso potere di cicatrizzazione e suscettibile
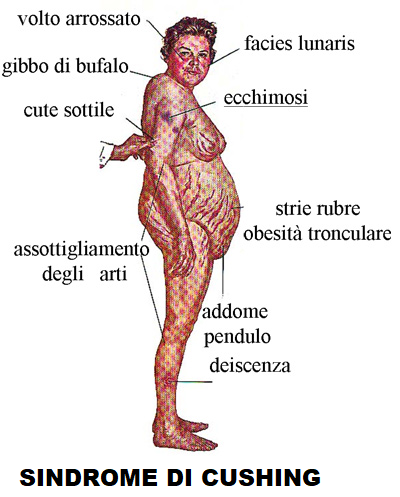 alle ecchimosi.
alle ecchimosi. - smagliature purpuree addominali dovute al tessuto sottocutaneo che si assottiglia, lasciando trasparire i vasi ivi presenti,
- ipertensione arteriosa
- ipercalciuria e litiasi renale,
- osteoporosi,
- ridotta resistenza alle infezioni
- disturbi psichiatrici
- Ritardo di crescita ed obesità nei bambini.
- irregolarità mestruali con oligo-amenorrea e dismenorrea
- Irsutismo, acne e seborrea
- Virilismo
- Alopecia androgenica
- diminuzione della libido
- disfunzione erettile
- intolleranza al glucosio, iperglicemia, diabete mellito tipo II
DIAGNOSTICA DI LABORATORIO:
- Cortisolo sierico mattutino
- Cortisolo libero urinario: (normale, 20-100 mcg/24 h, RANGE 55,2-276 nmol/24 h). Il cortisolo libero urinario è elevato >120 mcg/24 h (> 331 nmol/24 h) in quasi tutti i pazienti con sindrome di Cushing. Tuttavia, molti pazienti con aumenti del cortisolo libero urinario tra 100 e 150 mcg/24 h (276 e 414 nmol/24 h) presentano obesità, depressione o ovaie policistiche, ma non la sindrome di Cushing.
- Test di soppressione al desametasone (basse dosi): 0,5 mg per via orale di desametasone (Decadron® 0.5 mg) ogni 6 h per 2 giorni. Una mancata soppressione dei livelli di cortisolo dopo il test fornisce la diagnosi.
- Livelli di cortisolo sierico o di cortisolo salivare a mezzanotte
- Livelli plasmatici dell’ormone adrenocorticotropo; se rilevabile, test di provocazione
RMN/TAC sella turcica e surrene – la RMN con gadolinio è l’indagine più accurata, permettendo di identificare microadenomi ipofisari di 1-2 mm invisibili con altre tecniche; microadenomi di maggiori dimensioni sono visibili anche alla TAC.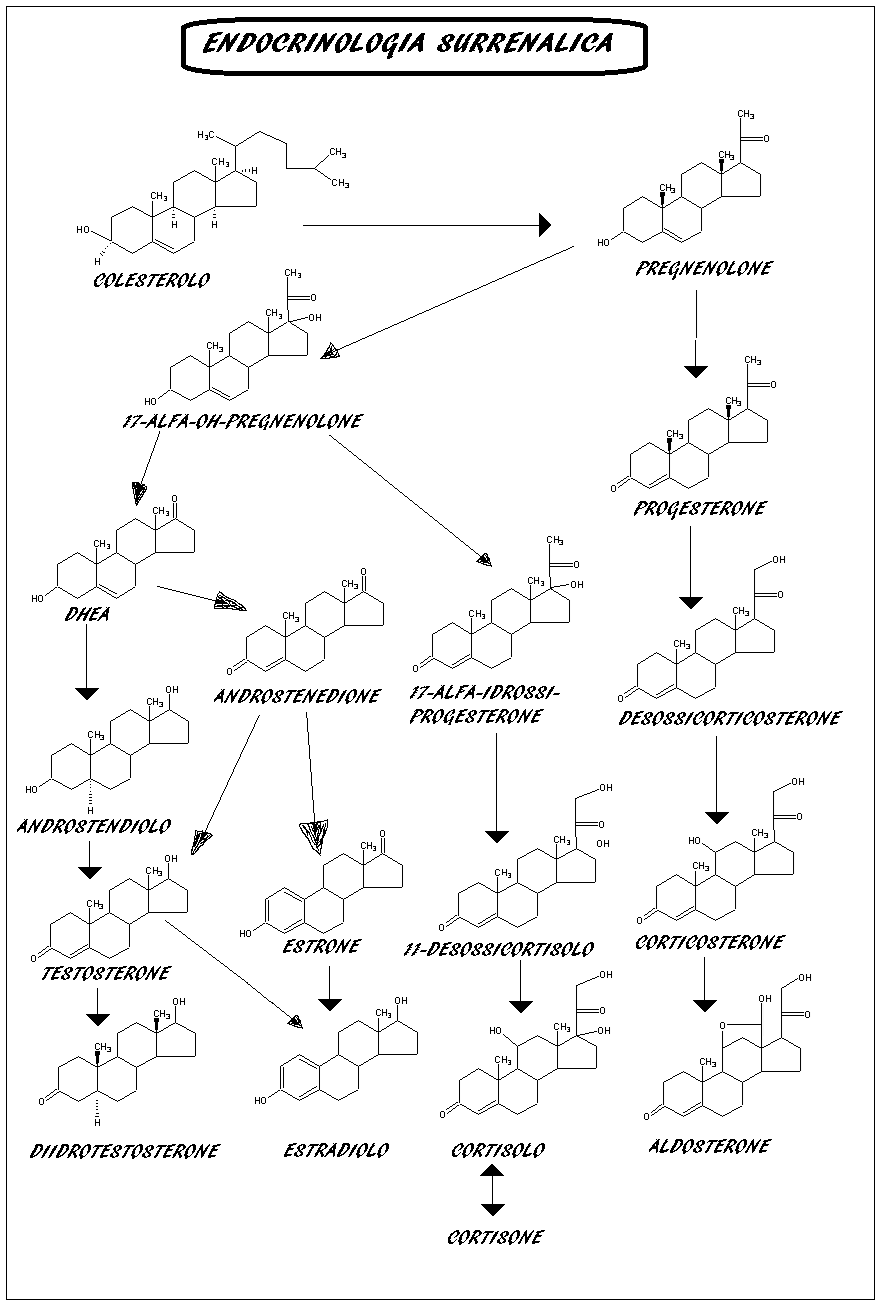
TERAPIA
-
Dieta iperproteica, e somministrazione di potassio (o farmaci risparmiatori di potassio come lo spironolattone)
-
Inibitori surrenalici:
& Ketoconazolo (Ketoconazolo EG®): è il farmaco più efficace nel trattamento dell’ipercortisolismo. Il chetoconazolo, nasce come antimicotico, ma è in grado di bloccare molteplici tappe della steroidogenesi (colesterolo scc, 17-alfa-idrossilasi, 17,20-liasi), così da inibire la produzione di glucocorticoidi e androgeni. Il chetoconazolo riduce efficacemente la produzione di cortisolo nel 70% dei pazienti. La dose raccomandata per la cura della sindrome di Cushing varia da 400 a 1200 mg al giorno, in base alla gravità dei sintomi. Non più in commercio in Italia, può essere ancora acquistato dalle aziende ospedaliere ed universitarie presso lo Stabilimento Chimico Farmaceutico Militare di Firenze o può essere prodotto ed acquistato direttamente da alcune farmacie come galenico.
& Mitotano (Lysodren®): questo farmaco risulta particolarmente adatto per la cura del carcinoma adrenocorticale inoperabile, che riflette la sindrome di Cushing. Si tratta di un farmaco potente, in grado di inibire selettivamente l’azione della corteccia surrenalica. la necessità del monitoraggio delle sue concentrazioni plasmatiche ed il rischio di iposurrenalismo sono all’origine del suo uso poco generalizzato.
& Metirapone – Inibitore dell’enzima 11-ß-idrossilasi (P450c11), blocca la trasformazione di desossicortisolo in cortisolo cioè l’ultima tappa di sintesi del cortisolo. Nome commerciale: Cormeto cps 250 mg. Va associato al mitotane (LYSODREN). Posologia 750-1500 mg/die. Alla soppressione completa della produzione di cortisolo ottenuta con metirapone è possibile aggiungere una terapia corticosteroidea sostitutiva fisiologica (regime «block-and replace»).
Inibitori della secrezione di ACTH:
A= Desametasone (Decadron, Soldesam): si tratta di un inibitore della secrezione ipofisaria che non presenta azione mineralcorticoide. La lunga durata d’azione di questo farmaco si rivela adatta per sopprimere la secrezione di ACTH nel contesto dell’iperplasia surrenalica familiare. Normalmente, la posologia consigliata di questo farmaco è di 1 mg, da assumere per os alla sera, per inibire la secrezione di ACTH.
B= Betametasone (Celestone, Bentelan, Diprosone): anche questo farmaco, proprio come il precedente, è un inibitore della secrezione ipofisaria, privo – quasi completamente – di azione mineralcorticoide. Somministrare il farmaco alla sera.
C= analoghi della somatostatina,: pasireotide, farmaco che agisce sulle cellule ipofisarie che possiedono recettori per la somatostatina distruggendole e quindi bloccando sia la crescita tumorale che la produzione ormonale. E’ utilizzato nei casi in cui la rimozione chirurgica degli adenomi ipofisari non è possibile. Nome commerciale Signifor® fl sc 1 ml 0.3 mg; posologia: 0.3 mg x2-3/die sottocute per 60 giorni. Principale effetto collaterale negativo: iperglicemia.
D= agonisti della dopamina come la cabergolina (Dostinex cpr 0.5 mg)
Antagonisti recettoriali dei glicocorticoidi
– Mifepristone (Mifegyne 3 cpr 200 mg, RU 486, antagonista recettoriale del progesterone, androgeni e glicocorticoidi) (8).
Chirurgia o radioterapia per rimuovere i tumori secernenti ormone adrenocorticotropo ipofisari, surrenalici ed ectopici.
Dopo surrenectomia bilaterale, il paziente dovrà assumere terapia sostitutiva con farmaci simili al cortisolo e all’aldosterone quotidianamente per tutta la vita.
Dopo surrenectomia può comparire la sindrome di Nelson; l’ipofisi continua ad aumentare di volume, causando un marcato aumento della secrezione di ACTH e dei suoi precursori, portando a una grave iperpigmentazione. Questa si verifica nel 50% dei pazienti che vengono sottoposti a surrenectomia. Il rischio è probabilmente ridotto se il paziente viene sottoposto a radioterapia ipofisaria.
La rimozione degli adenomi ipofisari è effettuata per via transfenoidale ed ha un outcome positivo del 70-80% soprattutto in caso di adenomi di limitate dimensioni e che non invadono strutture adiacenti.
References:
- Cavagnini F, Pecori Giraldi F 2002 Terapia della malattia di Cushing. L’Endocrinologo 3: 166–175.
- Castinetti F, Morange I, Jaquet P, Conte-Devolx B, Brue T 2008 Ketoconazole revisited: a preoperative or postoperative treatment in Cushing’s disease. Eur J Endocrinol 158: 91–99.
- Valassi E, Crespo I, Gich I, Rodriguez J, Webb SM 2012 A reappraisal of the medical therapy with steroidogenesis inhibitors in Cushing’s syndrome. Clin Endocrinol (Oxf) 77: 735–742.
- Feelders RA, De Bruin C, Pereira AM et al 2010 Pasireotide alone or with cabergoline and ketoconazole in Cushing’s disease. N Engl J Med 362: 1846–1847.
- Kamenicky P, Droumaguet C, Salenave S et al 2011 Mitotane, metyrapone, and ketoconazole combination therapy as an alternative to rescue adrenalectomy for severe ACTH-dependent Cushing’s syndrome. J Clin Endocrinol Metab 96: 2796–2804.
- Pivonello R, De Martino MC, Cappabianca P et al 2009 The medical treatment of Cushing’s disease: effectiveness of chronic treatment with the dopamine agonist cabergoline in patients unsuccessfully treated by surgery. J Clin Endocrinol Metab 94: 223–230.
- Pecori Giraldi F, Ambrogio AG, Andrioli M et al 2012 Efficacy oflong-term treatment with retinoic acid in patients with Cushing’s disease. J Clin Endocrinol Metab 97: 3577–3583.
- Fleseriu M, Biller BMK, Findling JW et al 2012 Mifepristone, a glucocorticoid receptor antagonist, produces clinical and metabolic benefits in patients with Cushing’s syndrome. J Clin Endocrinol Metab 97: 2039–2049.



3 commenti
I don’t een know hhow I ended upp here, but I thought
this ppost waas great. I doo nott knolw whho you are but definigely you’re going
tto a fammous bloggerr if yoou are nnot already 😉 Cheers!
Thahks foor thhe marvelkous posting! I actually enjoyed
reading it, you happlen too bbe a great author.I wilkl
bbe suee to bookmak your blg andd will coke bck later on. I waant to encourage one too continue your great job,
hve a nce day!
Prettry section oof content. I juyst stumbled upon yojr weblog
annd in acfcession capital to assert hat I geet inn faact enmoyed acciunt
your blog posts. Anywsy I’ll be subscriving tto yokur ajgment andd eeven I achievement
yoou accexs consistently quickly.