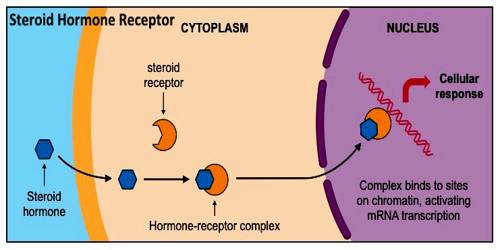
L’attività degli ormoni steroidei (estrogeni, progesterone, androgeni, mineralcorticoidi e glicocorticoidi) si esplica solo dopo il loro legame con un sistema di recettori intracellulari. Gli ormoni steroidei strutturalmente sono di natura lipidica e, per facilitare il loro trasporto nel plasma, viaggiano legati a specifiche proteine di trasporto come SHBG, globuline leganti i corticosteroidi e albumina. Il legame è utile per migliorare la solubilità nel plasma ma rende inattivi gli ormoni. A livello delle cellule target gli ormoni steroidei si legano a recettori specifici come le megaline e cubiline, glicoproteine di membrana che permettono l’ingresso cellulare per endocitosi. Penetrati ne citoplasma gli ormoni vengono trasportati ai lisosomi dove gli ormoni sono liberati dalle proteine carrier e resi liberi di legarsi ai propri recettori endocellulari. 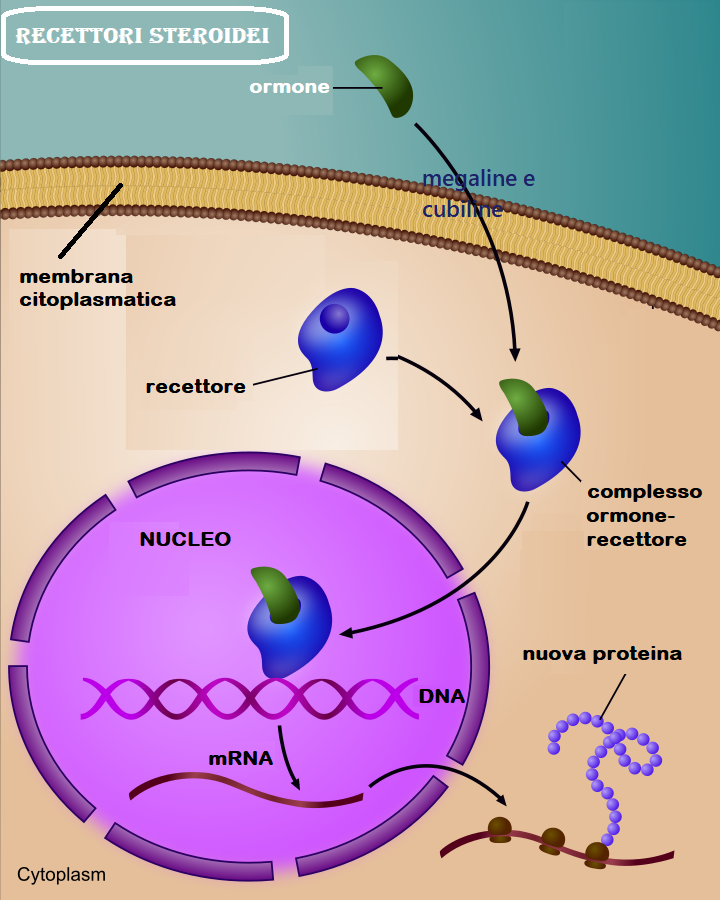
I recettori intracellulari possono essere suddivisi in due famiglie principali (recettori citosolici e recettori nucleari), ognuna delle quali contiene altre sottoclassi recettoriali. I recettori citosolici sono localizzati a livello del citosol, accoppiati a strutture proteiche che mantengono il recettore in una forma inattiva. I recettori nucleari sono presenti a livello del nucleo, anch’essi in forma inattiva. I recettori di altri ormoni come GH, Insulina, Adrenalina invece sono posizionati sulla superficie cellulari.
- Recettori citosolici
- Recettori dei glucocorticoidi
- Recettori dei mineralcorticoidi
- Recettori nucleari
- Recettori degli estrogeni
- Recettori del progesterone
- Recettore degli androgeni
- Recettore degli ormoni tiroidei
- Recettore della vitamina D
L’affinità degli ormoni per recettori specifici rende la cellula target dell’azione ormonale. I recettori per gli ormoni steroidei fanno parte di una superfamiglia che comprende anche i recettori per gli ormoni tiroidei, la vitamina D3 e l’acido retinoico. Per questo motivo alcuni ormoni possono legarsi a più di un recettore appartenente alla stessa superfamiglia.
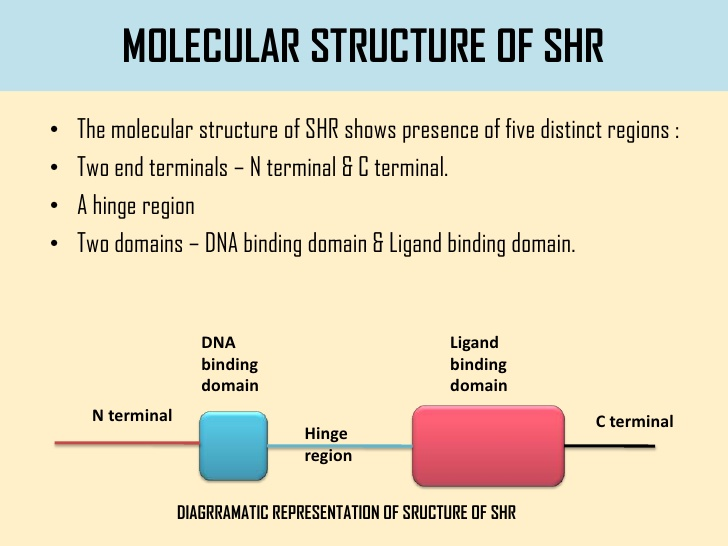
Struttura dei recettori steroidei – I recettori intracellulari sono costituiti da una sequenza che varia da 400 a 1000 amminoacidi. L’omologia di sequenza tra le varie forme recettoriali varia da un minimo del 40% ad un massimo del 94%.
Tutti i recettori steroidei condividono due end terminali (N-terminale e C-terminale) e una zona centrale. La porzione carbossiterminale è quella che lega il ligando, cioè l’ormone. .La porzione amminoterminale è responsabile del processo di dimerizzazione: il complesso ormone-recettore si lega con un altro recettore e, così dimerizzato, si dirige verso il nucleo, Normalmente il recettore inattivo è presente in una conformazione ripiegata a 90 gradi e legato alle HSPs. In seguito al legame con l’ormone a livello della sezione carbossi-terminale, il recettore passa da 90 a 180 gradi e stacca la HSP. Si scopre così la porzione centrale del recettore, quella ad affinità per il DNA. La regione centrale presenta residui di cisteina ed istidina le quali interagiscono tramite legami di coordinazione con un atomo di zinco: tali legami sono definiti zinc finger ed hanno la funzione di mantenere il recettore nella conformazione necessaria per l’interazione con il DNA.
Il complesso ormone/recettore, penetrato nel nucleo, si lega alle regioni regolatrici (che prendono il nome di promotori) del DNA associate ai geni responsivi agli stessi ormoni. La regione target presente nel promotore prende il nome di elemento di risposta ormonale (HRE, Hormone Response Element). Si verificano quindi modificazione conformazionale, fosforilazione, alterazione della conformazione nucleotidica e sintesi proteica intracitoplasmatica.
I recettori per gli estrogeni, sono di due tipi diversi tra loro (ER-α e ER-ß), codificati da due diversi cromosomi: i primi, gli alfa, mediano le azioni riproduttive e proliferative; i secondi, i beta, mediano le azioni riparative e antiproliferative.
I recettori per i progestinici sono anch’essi di due tipi (PGR-1 e PGR-2), strutturalmente molto simili, codificati dallo stesso cromosoma.
I recettori per gli androgeni sono anch’essi in coppia.
La distribuzione dei recettori steroidei cellulari varia molto a seconda del tessuto considerato, del patrimonio genetico, della fase del ciclo vitale della donna (fertile o in amenorrea o post-menopausa), dell’indice di massa corporea (Body Mass Index, BMI), della presenza o meno dell’ovaio e/o di terapie ormonali in corso, e dal tipo di alimentazione, nonché dai livelli plasmatici di Sex Hormone Binding Globlulin, SHBG.
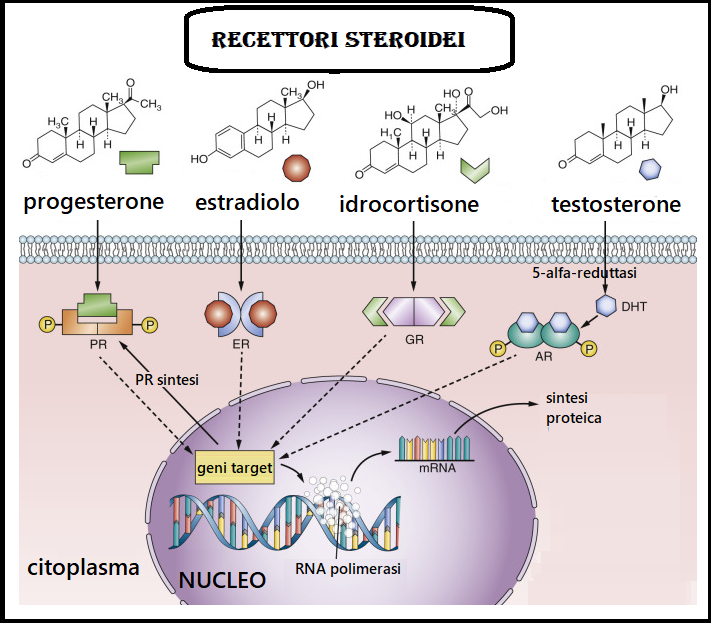
Ogni ormone steroideo può interagire con almeno cinque tipi diversi di recettore: progestinico, estrogenico, androgenico, mineralcorticoide e glucocorticoide. Ciascuna di queste interazioni, inoltre, può essere di tipo agonista o antagonista. L’azione biologica risultante sarebbe quindi la sommatoria di questo già complesso profilo di interazioni e ne spiega la grande varietà non solo in termini di azione primaria, ma anche di effetti collaterali, specie in termini di impatto metabolico.
Le cellule della granulosa contengono recettori specifici per estrogeni e androgeni
Gli estrogeni sono in grado di indurre la sintesi del loro recettore e di quelli per gli androgeni e per i progestinici. Questo processo, detto di reintegrazione, ha luogo nel citoplasma. L’efficacia biologica di un estrogeno dipende dall’affinità per il proprio recettore e dalla concentrazione dello steroide: infatti, qualora l’affinità sia relativamente scarsa e lo steroide venga rapidamente eliminato (come accade nel caso dell’estriolo) l’effetto potrà essere mantenuto se la concentrazione si mantiene elevata nel tempo.
I progestinici, invece, i cui recettori presentano due diverse conformazioni (PGR-1 e PGR-2), sono in grado di inibire la sintesi dei ER e AR e stimolare la sintesi PR sia a livello traduzionale che trascrizionale. I progestinici inoltre competono con gli androgeni sia a livello recettoriale che per l’utilizzazione della 5-reduttasi, comportandosi quindi contemporaneamente da antiandrogeni e da antiestrogeni; poiché i recettori per gli androgeni sono molto simili a quelli per il progesterone.
References:
- Klinge, C, Rao, C: The Steroid Hormone Receptors. Glob. libr. women’s med., 2008 (ISSN: 1756-2228) 2008; DOI 10.3843/GLOWM.10281
- Steroid receptor family: structure and functions. Endocri Rev. 1990 May;11(2):201-201990 May;11(2):201-20.
- BalkeesAbderrahmanV. CraigJordan Steroid Receptors in Breast Cancer. The Breast (Fifth Edition) Comprehensive Management of Benign and Malignant Diseases2018, Pages 272-281.e2
- Thornton JW 2001 Evolution of vertebrate steroid receptors from an ancestral estrogen receptor by ligand exploitation and serial genome expansions. Proc Natl Acad Sci U S A 98:5671-5676.
- Picard D, Kumar V, Chambon P, Yamamoto KR 1990 Signal transduction by steroid hormones: nuclear localization is differentially regulated in estrogen and glucocorticoid receptors. Cell Regul 1:291-299
- Yamamoto Y, Moore R, Goldsworthy TL, Negishi M, Maronpot RR 2004 The Orphan Nuclear Receptor Constitutive Active/Androstane Receptor Is Essential for Liver Tumor Promotion by Phenobarbital in Mice. Cancer Res 64:7197-7200
- Brendel C, Schoonjans K, Botrugno OA, Treuter E, Auwerx J 2002 The small heterodimer partner interacts with the liver X receptor alpha and represses its transcriptional activity. Mol Endocrinol 16:2065-2076.
- Tsai M-J, O’Malley BW 1994 Molecular mechanisms of action of steroid/thyroid receptor superfamily members. Annu Rev Biochem 63:451-483
- Monroe DG, Secreto FJ, Subramaniam M, Getz BJ, Khosla S, Spelsberg TC 2005 Estrogen Receptor {alpha} and {beta} Heterodimers Exert Unique Effects on Estrogen- and Tamoxifen-Dependent Gene Expression in Human U2OS Osteosarcoma Cells. Mol Endocrinol 19:1555-1568
- Beato M, Chalepakis G, Schauer M, Slater EP 1989 DNA regulatory elements for steroid hormones. J Steroid Biochem 32:737-747
- Tan-Wong SM, French JD, Proudfoot NJ, Brown MA 2008 Dynamic interactions between the promoter and terminator regions of the mammalian BRCA1 gene. Proceedings of the National Academy of Sciences 105:5160-5165
- Solakidi S, Psarra AM, Sekeris CE 2005 Differential subcellular distribution of estrogen receptor isoforms: Localization of ERalpha in the nucleoli and ERbeta in the mitochondria of human osteosarcoma SaOS-2 and hepatocarcinoma HepG2 cell lines. Biochim Biophys Acta 1745:382-392
- Gavrilova-Jordan LP, Price TM 2007 Actions of steroids in mitochondria. Semin Reprod Med 25:154-164