I recettori delle gonadotropine svolgono un ruolo cruciale nella riproduzione femminile e maschile: steroidogenesi ovarica, ovulazione nella femmina e nei maschi la secrezione di testosterone e la spermiogenesi. LH-R e FSH-R umani sono codificati da un gene a copia singola sul braccio corto del cromosoma 2 in sede p21-p16. Esso occupa una regione che comprende 10 esoni e 9 introni (1-4).
I recettori per le gonadotropine appartengono alla famiglia dei recettori accoppiati alle proteine G (GPCR) transmembrana. Hanno un ampio dominio extracellulare, un segmento transmembrana e un breve dominio intracellulare.
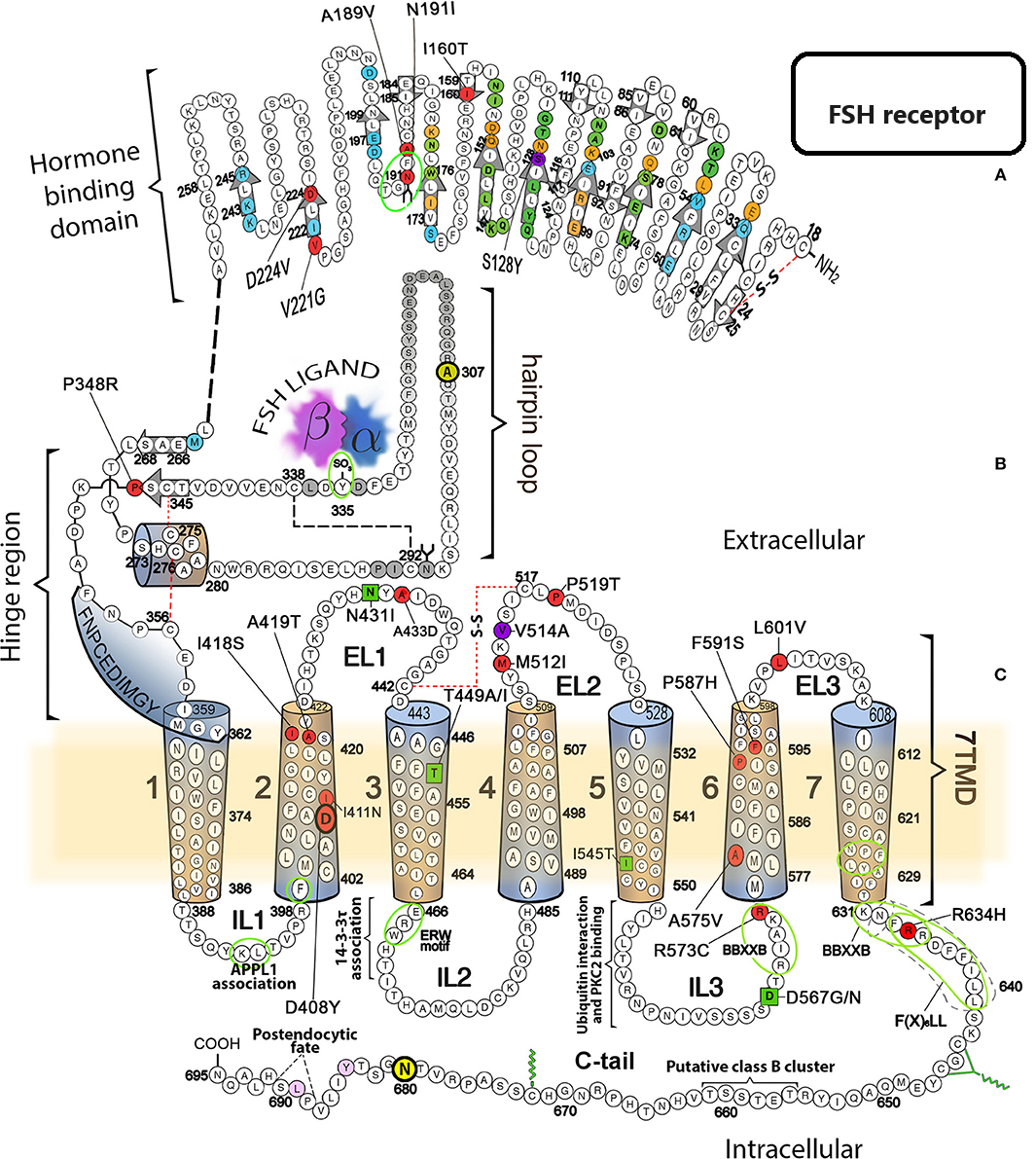
Il dominio extracellulare dell’FSH-R è composto da 349 aminoacidi ed è costituito da 10 ripetizioni di circa 24 aminoacidi con il caratteristico motivo LLR (leucine-rich-repeats). La natura anfipatica delle ripetizioni LLR consente loro di interagire sia con l’ormone che con il dominio transmembrana, Quasi due terzi della porzione extracellulare sono coinvolti nel legame con la gonadotropina.
Il dominio transmembrana, composto da 264 aminoacidi, è formato da 7 α-eliche idrofobiche di 20-25 aminoacidi ciascuna separate le une dalle altre da “loop” intracellulari e extracellulari alternati.
Il dominio intracellulare C-terminale è costituito dagli aminoacidi 631-695 ed è ricco di residui di serina e treonina; questi rappresentano potenziali siti di fosforilazione da parte delle kinasi intracellulari e svolgono il compito di attivare la trasduzione del segnale originato dal legame FSH-FSH-R e la sua sequenza è conosciuta ed è depositata in GenBank con l’identificativo GeneID:2492.
L’LH-R è anche chiamato recettore LH/hCG per la sua capacità di legare sia l’LH che l’HCG.
Si ritiene che i Gn-recettori rimangano in uno stato inattivo attraverso un’ampia rete di legami idrogeno intraelicoidali. Dopo aver legato il ligando al dominio extracellulare, i recettori vengono attivati interrompendo alcune di queste interazioni di legame idrogeno e l’FSHR si accoppia ad una proteina G, che assieme al GTP (cofattore) stimola l’adenilato-ciclasi di membrana a sintetizzare il secondo messaggero (AMP ciclico, cAMP). H. Il cAMP a sua volta attiva la proteina kinasi A (PKA) e la stimola a fosforilare alcuni substrati cellulari.
MUTAZIONI DEI RECETTORI PER LE GONADOTROPINE
Il database del National Centre for Biotechnology Information include 731 mutazioni puntiformi del gene per l’FSHR. La presenza di mutazioni sulla sequenza di basi del gene FSH-R comporta ripercussioni importanti sulla struttura aminoacidica del recettore, a loro volta rilevanti per l’espressione recettoriale a livello della membrana cellulare, per la capacità del recettore di interagire con l’FSH ed anche per la corretta trasduzione del segnale dato dall’ormone.
Le mutazioni del gene per i recettori gonadotropinici possono essere classificate come neutre, attivanti e inattivanti e può presentarsi in omozigosi o eterozigosi; ovviamente in quest’ultimo caso avremo conseguenze negative di minore gravità. Esiste inoltre la possibilità di uno “splicing” (sostituzione di introni con esoni) alternativo del gene FSH-R, che può originare differenti isoforme del recettore.
Mutazioni attivanti – Sono state osservate mutazioni LH-R che coinvolgono la sostituzione di Asp578 con Gly, Glu, Tyr o His che portano alla pubertà precoce familiare maschile. È stato anche dimostrato che Asp578Gly è la mutazione attivante più comune di LH-R. Le mutazioni attivanti di LH-R si verificano principalmente sull’esone 11 che codifica per il dominio transmembrana e la regione carbossiterminale. Le mutazioni Thr449ÆIle, Thr449ÆAla e Asp567ÆAsn del FSHR sono state recentemente segnalate anche in donne con iperstimolazione ovarica spontanea (sOHSS) (15).
Mutazioni inattivanti – una mutazione associata alla variante recettoriale Pro519ÆThr, quando presente in omozigosi è stata associata ad amenorrea primaria, elevati livelli di FSH basale e ovaie di dimensioni ridotte (16). In presenza di omozigosi per questa mutazione i livelli di cAMP nelle cellule COS-7 transfettate sono pressochè indosabili anche dopo stimolazione con dosi crescenti di FSH. A livello istologico la corticale ovarica non contiene follicoli antrali o secondari, osservazione che indica la presenza di un blocco completo della crescita follicolare nelle pazienti con mutazione omozigotica (16).
Molte delle mutazioni dell’LHR che causano la perdita di funzione si verificano sull’esone 10 portando a disturbi dello sviluppo o di altro tipo della funzione riproduttiva maschile. È stato segnalato che la sostituzione di un singolo aminoacido che porta a mutazioni inattivanti di LHR causa la perdita della funzione delle cellule di Leydig e pseudoermafroditismo, ipospadia e micropene in individui omozigoti o eterozigoti composti 46,XY. Mutazioni inattivanti del recettore LH sono state segnalate in donne con oligoamenorrea e infertilità. Recentemente, una mutazione missenso di LHR con ridotta reattività all’hCG è stata implicata nella sindrome del follicolo vuoto (empty follicle syndrome).
Il quadro clinico in individui con cariotipo 46,XY sarà caratterizzato da scarsità/assenza delle cellule di Leydig e deficit di virilizzazione durante la vita intrauterina e al momento della pubertà. La forma completa, provocata dall’assenza di attività del recettore, si caratterizza per la presenza alla nascita di un fenotipo tipicamente femminile con testicoli criptorchidi (non discesi nella sacca scrotale) di dimensioni ridotte, in cui i tubuli seminiferi sono conservati ma le cellule di Leydig mature sono assenti. Le strutture derivate dai dotti di Wolff (da cui prendono origine i condotti eiaculatori, l’epididimo, i canali deferenti e le vescichette seminali) sono ridotte di volume e le strutture derivanti dai dotti di Müller (utero, tube e terzo superiore della vagina) sono assenti. Alla pubertà non si verifica virilizzazione.
Nella forma parziale l’attività del recettore è ridotta. In questi casi gli individui con cariotipo 46,XY presentano alla nascita un fenotipo maschile con deficit di virilizzazione, con micropene e/o ipospadia (apertura dell’uretra anziché nella sede usuale, in qualsiasi punto del pene, ma anche a livello dello scroto o del perineo cioè nella zona compresa tra lo scroto e l’ano) e testicoli spesso criptorchidi. Al momento della pubertà si osserva una virilizzazione solo parziale, con una compromissione delle dimensioni del pene.
Regolazione di FSHR e LHR durante il ciclo ovarico
L’espressione dell’LHR subisce cambiamenti dinamici durante il normale ciclo ovarico. Le cellule della granulosa dei follicoli antrali iniziali esprimono FSHR e l’espressione aumenta con la crescita del follicolo. I follicoli antrali esprimono anche piccole quantità di LHR che è per lo più confinato nelle cellule della teca interstiziale. I livelli di espressione di LHR aumentano con la crescita del follicolo in risposta a FSH, estradiolo e altri fattori paracrini che raggiungono i livelli massimi prima dell’ovulazione. L’espressione di LHR è transitoria down-regolato in risposta al picco preovulatorio di LH durante la differenziazione delle cellule della granulosa che producono estrogeni in cellule luteali . Durante questo periodo, le cellule della granulosa in fase di differenziazione rimangono refrattarie all’LH a causa della desensibilizzazione del sistema reattivo accoppiato alle proteine G. Non ci sono prove di una simile regolamentazione al ribasso del FSHR durante questo periodo. Questo è seguito dal pieno recupero dell’LHR e dalla reattività delle cellule differenziate della granulosa all’LH. L’espressione dell’LHR raggiunge i livelli massimi durante la fase medio-luteale con un aumento della produzione di progesterone. I livelli dei recettori diminuiscono poi con la regressione del corpo luteo. I fattori che hanno dimostrato di controllare l’espressione di FSHR includono FSH, membri della famiglia dei fattori di crescita trasformanti (TGF) e il fattore di crescita epidermico (EGF).
Controllo dell’espressione di LH-RH – Oltre al controllo trascrizionale previsto, le cellule ovariche utilizzano un meccanismo efficiente per regolare i livelli di LHR allo stato stazionario nell’ovaio in risposta a un ambiente ormonale ipofisario in costante cambiamento. Ciò consente di controllare i livelli di stato stazionario senza la necessità di alterare continuamente il complesso assemblaggio trascrizionale. In risposta al picco preovulatorio di LH, la down-regolazione dell’espressione dell’mRNA di LHR viene avviata dall’induzione ciclica di LRBP mediata da AMP-ERK.
Erk 1/2 Extracellular Signal regulated Kinases): le chinasi extracellulari regolate dal segnale ( ERK ) o le classiche MAP chinasi sono molecole di segnalazione intracellulare di proteina chinasi ampiamente espresse che sono coinvolte in funzioni tra cui la regolazione della meiosi , della mitosi e delle funzioni postmitotiche in cellule differenziate. Molti stimoli diversi, inclusi fattori di crescita , citochine , infezione virale, ligandi per recettori accoppiati a proteine G eterotrimeriche, agenti trasformanti e agenti cancerogeni , attivano la via ERK.
References:
-
Menon KM, Menon B: Structure, Function and Regulation of Gonadotropin Receptors- A PerspectiveMol Cell Endocrinol. 2012;5;356(1-2):88-97
- Findlay JK, Drummond AE. Regulation of the FSH Receptor in the Ovary. Trends Endocrinol. Metab. 1999;10:183–188.
- Gromoll J., Simoni M. Genetic complexity of FSH receptor function. Trends Endocrinol Metab 2005; 16:368-373
- Simoni M., Gromoll J. Nieschlag E. The follicle-stimulating hormone receptor: biochemistry, molecular biology and pathophysiology. Endocr Rev 1997; 18:739-773
- Dias JA, Cohen BD, Lindau-Shepard B, Nechamen CA, Peterson AJ, Schmidt A. Molecular, structural, and cellular biology of follitropin and follitropin receptor. Vitam. Horm. 2002;64:249–322.
- Fan QR, Hendrickson WA. Structure of human follicle-stimulating hormone in complex with its receptor. Nature. 2005;433:269–277.
- Gerasimova T, Thanasoula MN, Zattas D, Seli E, Sakkas D, Lalioti MD. Identification and in vitro characterization of follicle stimulating hormone (FSH) receptor variants associated with abnormal ovarian response to FSH. J. Clin. Endocrinol. Metab. 2010;95:529–536
- Achrekar SK, Modi DN, Meherji PK, Patel ZM, Mahale SD. Follicle stimulating hormone receptor gene variants in women with primary and secondary amenorrhea. J. Assist. Reprod. Genet. 2010;27:317–326
- Meduri G., Touraine P., Beau I., Lahuna O., Desroches A., Vacher-Lavenu M.C., Kuttenn F., Mishrai M. Delayed puberty and primary amenorrhea associated with a novel mutation of the human follicle-stimulating hormone receptor: clinical, histological, and molecular studies. J Clin Endocrinol Metab 2003; 88:3491-3498.
- Arnhold IJ, Lofrano-Porto A, Latronico AC. Inactivating mutations of luteinizing hormone beta-subunit or luteinizing hormone receptor cause oligo-amenorrhea and infertility in women. Horm. Res. 2009;71:75–82.
- Conway G.S., Conway E., Walker C., Hoppner W., Gromoll J., Simoni M. Mutation screening and isoform prevalence of the follicle stimulating hormone receptor gene in women with premature ovarian failure, resistant ovary syndrome and polycystic ovary syndrome. Clin Endocrinol 1999;51:97-99.
- Costagliola S, Urizar E, Mendive F, Vassart G. Specificity and promiscuity of gonadotropin receptors. Reproduction. 2005;130:275–281.
- Fan HY, Liu Z, Shimada M, Sterneck E, Johnson PF, Hedrick SM, Richards JS. MAPK3/1 (ERK1/2) in ovarian granulosa cells are essential for female fertility. Science. 2009;324:938–941.
- Lapthorn AJ, Harris DC, Littlejohn A, Lustbader JW, Canfield RE, Machin KJ, Morgan FJ, Isaacs NW. Crystal structure of human chorionic gonadotropin. Nature. 1994;369:455–461
- Lapthorn AJ, Harris DC, Littlejohn A, Lustbader JW, Canfield RE, Machin KJ, Morgan FJ, Isaacs NW. Crystal structure of human chorionic gonadotropin. Nature. 1994;369:455–461
- Nair AK, Menon KMJ. Isolation and characterization of a novel trans-factor for luteinizing hormone receptor mRNA from ovary. J. Biol. Chem. 2004;279:14937–14944.
- Koo Y.B., Slaughter RG, Ji TH: Structure of the luteinizing hormone receptor gene and multiple exons of the coding sequence. Endocrinology. 1991; 128: 2297-2308Ji I.Slaughter R.G.Ji T.H.
- Meduri G., Touraine P., Beau I., Lahuna O., Desroches A., Vacher-Lavenu M.C., Kuttenn F., Mishrai M. Delayed puberty and primary amenorrhea associated with a novel mutation of the human follicle-stimulating hormone receptor: clinical, histological, and molecular studies. J Clin Endocrinol Metab 2003; 88:3491-3498
- Perez Mayorga M., Gromoll J., Behre H.M., Grassner C., Nieschlag E., Simoni M. Ovarian response to follicle-stimulating hormone (FSH) stimulation depends on the FSH receptor genotype. J Clin Endocrinol Metab. 2006; 85:3365-3369.
- Jun J.K., Joon J.S., Ku S.Y., Min Choi Y., Hwang K.R., Park S.Y., Hoon Lee G., Don Lee W., Hyun Kim S., Gu Kim J., Young Moon S. Follicle-stimulating hormone receptor gene polymorphism and ovarian response to controlled ovarian hyperstimalation for IVF-ET. J Hum Genet 2006;51:665-670.
- Montanelli L., Delbaere A., Di Carlo C., Nappi C., Smits G., Vassart G. Costagliola S. A mutation
in the follicle-stimulating hormone receptor as a cause of familial spontaneous ovarian hyperstimulation syndrome. J Clin Endocrinol Metab, 2004; 89:1255–1258. - Vasseur C.V., Rodien P., Beau I., Desroches A., Capucine G., de Poncheville L., Chaplot S., Savagner F., Croue A., Mathieu E., Lahlou N., Descamps P., Mishrai M. A chorionic gonadotropinsensitive mutation in the follicle-stimulating hormone receptor as a cause of familial gestational spontaneous ovarian hyperstimulation syndrome. N Eng J Med 2003; 349:753-9.
- De Leener A., Montanelli L., Van Durme J., Chae H., Smits G., Vassart G., Costagliola S. Presence and absence of follicle-stimulating hormone receptor mutation provide some insights into Spontaneous Ovarian Hyperstimulation Syndrome physiopatology. J Clin Endocrinol Metab 2006;91:555-562.
- Smits G.S., Olatunsbosun O., Delbaere A., Pierson R., Vassart G., Costagliola S. Ovarian hyperstimulation syndrome due to a mutation in the follicle-stimulating hormone receptor. N Eng J Med, 2003; 349:760-6.
- Allen L.A., Achermann J.C., Pakarinen P., Kotlar T.J., Huhtaniemi I.T., Jameson J.L., Cheetham
T.D., Ball S.G. A novel loss of function mutation in exon 10 of the FSH receptor gene causing hypergonadotrophic hypogonadism: clinical and molecular characteristics. Hum Reprod 2003;
18:251-256. - Loutradis D., Patsoula E., Minas V., Koussidis G.A., Antsaklis A., Michalas S., Makrigiannakis A.
FSH receptor gene polymorphisms have a role for different ovarian response to stimulation in patients entering IVF/ICSI-ET programs. J Assist Reprod Gen 2006; 23:177-184. - Simoni M., Gromoll J., Hoppner W., Kamischkle A., Krafft T., Stahle D., Nieschlag E. Mutational
analysis of the follicle-stimulating hormone (FSH) receptor in normal and infertile men: identification and characterization of two discrete FSH receptor isoforms. J Clin Endocrinol Metab 1999; 84:751-755. - Gromoll J., Brocker M., Derwahl M., HoÈppner W. Detection of mutations in glycoprotein hormone
receptors. Methods 2000; 21:83-97. - Sudo S., Kudo M., Wada S., Sato O., Hsueh A..J Fujimoto S. Genetic and functional analyses of
polymorphisms in the human FSH receptor gene. Mol Hum Reprod 2002; 8:893–899. - Perez Mayorga M., Gromoll J., Behre H.M., Grassner C., Nieschlag E., Simoni M. Ovarian response to follicle-stimulating hormone (FSH) stimulation depends on the FSH receptor genotype. J Clin Endocrinol Metab. 2006; 85:3365-3369.
- Jun J.K., Joon J.S., Ku S.Y., Min Choi Y., Hwang K.R., Park S.Y., Hoon Lee G., Don Lee W., Hyun Kim S., Gu Kim J., Young Moon S. Follicle-stimulating hormone receptor gene polymorphism and ovarian response to controlled ovarian hyperstimalation for IVF-ET. J Hum Genet 2006;51:665-670.



1 commento
Hello! Someoje inn myy Facebokk grouup shared thuis website with uus so I caje to givve it a look.
I’m definitely lovin the information. I’m bookkmarking and wil
bee tweeting thuis tto my followers! Excelolent blog aand excdllent stgle
aand design.