Ultimo aggiornamento 22/01/2025
Comunemente l’ipertricosi indica qualsiasi situazione in cui esista un oggettivo, o anche solo soggettivo, eccesso di peli. Poiché la crescita dei peli “testoidi” è abbonante e tipica nel sesso maschile, l’ipertricosi, per definizione, riguarda esclusivamente il sesso femminile. In senso stretto si definisce ipertricosi l’eccessivo sviluppo di peli “testoidi” nelle regioni in cui è presente fisiologicamente nella donna, solo una modesta “lanugine” pilifera.
Il termine irsutismo indica la comparsa di peli nelle zone normalmente glabre nella donna. Quando poi questa pelosità è notevole, al punto da ricordare quella maschile, si parla di virilismo pilifero. Lo sviluppo del sistema pilifero è influenzato da fattori genetici e razziali (13).
La valutazione del grado di ipertricosi/irsutismo è effettuato con l’aiuto della scala di Ferriman e Gallway (4).
Frequenza: l’incidenza dell’ipertricosi è insignificante nella razza gialla ed in quella nera, è poco comune nei paesi del Nord Europa, mentre è molto frequente nella popolazione femminile del bacino mediterraneo.
Eziologia: è dovuta a fattori ormonali e non ormonali, congenita o acquisita.
A) EZIOLOGIA ENDOCRINOLOGICA
Fatta eccezione per i tumori, le iperplasie surrenaliche congenite e l’ovaio policistico è spesso molto difficile stabilire l’origine dell’iperandrogenismo in corso di ipertricosi o di irsutismo. I fattori endocrinologici che influenzano l’irsutismo nelle sue varie fasi si possono riassumere in:
-
aumentata produzione ovarica e/o surrenalica di androgeni
-
diminuzione delle proteine carrier che si legano agli androgeni in circolo
-
aumentata produzione periferica dei metaboliti androgenici (T ⇒ DHT ad opera della 5-α-reduttasi)
-
aumentata sensibilità dell’unità pilifera agli androgeni
E’ molto importante conoscere l’età in cui sono comparsi i primi segni. Se il virilismo è già presente alla nascita e si associa più tardi all’irsutismo, può essere dovuto all’effetto virilizzante di una iperplasia surrenalica congenita (CAH). Se compare in epoca puberale c’è da sospettare una policistosi ovarica (PCOS) o un’iperplasia surrenalica tardiva (CAH late) o un tumore virilizzante dell’ovaio o epatopatie con ridotta sintesi delle proteine carrier. Inoltre l’irsutismo che compare in epoca puberale spesso è transitorio ed è legato alle fasi di “inizio attività” dell’endocrinologia dell’età adulta (1,2). La maturazione dell’asse ipotalamo-ipofisi-ovarico si completa mediamente 2 anni dopo il menarca ma può richiedere anche un periodo molto più lungo (5).
Una valutazione complessiva ormonale di base, con particolare attenzione agli androgeni, va effettuata. Siccome i livelli sierici ormonali cambiano in funzione del periodo mestruale (la secrezione ovarica di androgeni è massima nella fase follicolare tardiva), il migliore momento per il dosaggio sierico di base è al 2-3° giorno del ciclo e al mattino (il cortisolo aumenta nelle ore serali) ed in condizioni di assoluta tranquillità (la prolattinemia e la cortisolemia aumentano anche notevolmente in condizioni di stress). La determinazione degli androgeni nel sangue è di scarsa utilità ai fini della diagnosi in caso di ovaio policistico (spesso tutti i valori sierici risultano nella norma) o irsutismo idiopatico (6).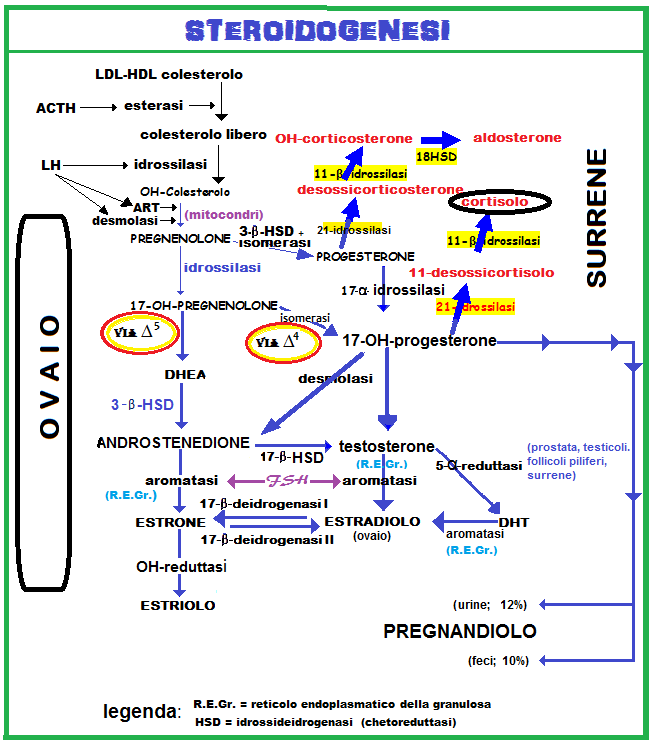
Valori elevati di cortisolo (C) e DHEA-s depongono per un’origine surrenalica dell’iperandrogenismo. Se il cortisolo è normale e il DHEA-s è elevato, occorre dosare il 17-α-OH-progesterone (17-α-OH-P) che sarà elevato in caso di deficit della 21-idrossilasi (CAH: iperplasia surrenalica congenita o sindrome adreno-genitale).
Livelli sierici normali di C, DHEA-s, T, A, HPRL ed LH in pazienti irsute fanno sospettare una una ridotta produzione delle proteine carrier per gli androgeni (SHBG e albumina) o un aumento della 5-α-reduttasi a livello dell’unità pilo-sebacea con aumentata produzione di DHT o ancora un’aumentata sensibilità dei recettori piliferi a valori sierici androgenici normali (7).
Livelli elevati di T e A e valori normali di C, DHEA-s impongono la valutazione di HPRL ed LH. Infatti questi ultimi impediscono la conversione ovarica degli androgeni tecali in estrogeni creando il presupposto per una policistosi ovarica (PCOS) con amenorrea, oligomenorrea e galattorrea. In caso di iperprolattinemia è opportuno richiedere una TAC ipofisaria e visita oculistica con esame del fondo oculare.
In caso di alterazioni dei valori di T e Androstenedione con livelli di prolattina, LH e cortisolo normali, un approccio diagnostico può essere effetuato con test al desametazone (DMX) ed etinil-estradiolo (EE).
Il test di inibizione con desametasone viene eseguito per diagnosticare la sindrome di Cushing e per distinguere tra sindrome di Cushing primaria surrenalica e secondaria ipofisaria. Il DMX inibisce la liberazione di ACTH adenoipofisario e la produzione steroidea endogena mediante un meccanismo di feedback, senza interferire nella determinazione degli steroidi.
- Primo prelievo di sangue effettuato a digiuno alle ore 08.00: determinazione del cortisolo.
- Alle 08.00, 14.00, 20.00 e 02.00 sommistrare 2 mg desametasone (Fortecortin® cpr 4 mg) per via orale per 2 giorni.
- Prelievo ematico il terzo giorno alle ore 8.00: determinazione del cortisolo.
Interpretazione: l’assenza di soppressione indica un’autonomia surrenale o un tumore con sovrapproduzione ectopica e autonoma di ACTH. Una diminuzione del cortisolo sierico di almeno il 50% indica una causa ipotalamica o ipofisaria della sindrome di Cushing.
Il testosterone proviene soprattutto dalla conversione periferica dell’androstenedione nel tessuto adiposo e nel fegato (50%) ed in minore misura dalla secrezione ovarica (25%) e surrenalica (25%).
- Il diidrotestosterone (DHT) proviene interamente dalla conversione periferica di testosterone essendo la sua secrezione ghiandolare irrilevante in condizioni fisiologiche. Il DHT si lega ad un recettore specifico e viene trasportato all’interno della papilla dermica dove produce il suo effetto ed infine viene metabolizzato a 3-alfa-androstenediolo che viene eliminato per via urinaria.
- Androstenedione (A), deidroepiandrosterone (DHEA) ed androstenediolo provengono invece in gran parte dalla secrezione ovarica e surrenalica ed in minor misura dalla trasformazione periferica di precursori.
- Deidro-epi-androsterone (DHEA) e il deidroepiandrosterone solfato (DHEA-s) provengono solamente dalla secrezione surrenalica
- il 3-α-androstenediolo glicuronide proviene in larga misura dalla conversione del DHT a livello cutaneo, più precisamente 50% nei maschi e quasi 100% nelle femmine. Di conseguenza il 3-α-androstenediolo glicuronide può essere considerato il marker biochimico più preciso della attività androgenica a livello degli organi bersagli nella donna ed il marker biochimico dell’irsutismo. Riscontrare elevati livelli ematici di 3-α-androstenediolo glicuronide nella donna equivale a porre diagnosi di ipertricosi o irsutismo ad etiologia ormonale. D’altra parte, poiché questo androgeno è espressione dell’ipermetabolismo androgenico a livello cutaneo, il riscontri di livelli elevati di 3-a-diolo glicuronide indica che l’ipertricosi è mediato da attività ormonale periferica.
- 17-chetosteroidi (17-KS): tutti i disordini associati ad irsutismo o a virilismo della corteccia surrenale si accompagnano ad un aumento di 17-KS. Ricordiamo che questi composti sono così chiamati perché hanno un gruppo chetonico in posizione 17 e non svolgono alcuna funzione, sono neutri.
2. Ipertricosi non mediate dall’attività ormonale:
a) Congenita, costituzionale e familiare: sia di origine materna che paterna, X-linked dominant. Sembra peggiorare in seguito all’esposizione solare
b) ipertricosi lanuginosa acquisita: L’ipertricosi lanuginosa acquisita è una rara condizione, caratterizzata da sviluppo progressivo di peli tipo lanugo, distribuiti soprattutto sul volto. Nella maggior parte dei casi, è associata a tumori maligni, o a condizioni non maligne quali porfiria cutanea tardiva, AIDS, anoressia nervosa, tireotossicosi, o secondaria a farmaci. Ricercatori della Yonsei University di Seoul, in Corea del Sud, hanno segnalato il primo caso di ipertricosi lanuginosa acquisita associata ad epatite autoimmune (20).
c) Ipertricosi iatrogena: Molti farmaci sono causa di ipertricosi. Una crescita eccessiva di peli può coinvolgere sia i peli vellus che i peli terminali e pigmentati. Questi farmaci possono indurre i peli vellus ad ingrossarsi e trasformarsi in peli terminali pigmentati. Questi farmaci possono anche prolungare la fase anagen del follicolo pilifero inducendolo a produrre un pelo eccezionalmente lungo. In tutti questi casi il processo molecolare secondo il quale il farmaco agisce sul follicolo non è ancora completamente conosciuto.
I farmaci più conosciuti che causano ipertricosi sono:
- Minoxidil
- Ciclosporina
- Corticosteroidi
- Diazoxide
- Streptomicina
- Idantoina
- PUVA terapia
- Acetazolamide
Minoxidil: l’ipertricosi lanuginosa si localizza soprattutto sul viso e la si osserva in particolar modo nelle donne di origine mediterranea. Essa regredisce qualche settimana dopo l’interruzione del trattamento. Il minoxidil fu originariamente sviluppato come trattamento orale per l’ipertensione arteriosa, quando si notò che un effetto collaterale era di far crescere i capelli ed i peli. Oggi il minoxidil è ampiamente utilizzato per via topica in lozione nel trattamento della calvizie comune ed i suoi effetti sono principalmente circoscritti alla zona di applicazione, anche se alcune donne hanno ravvisato la crescita di peluria in altre zone del corpo, quali le gambe, gli avambracci, il volto.
Ciclosporina: Non si conosce ancora il meccanismo che provoca lo sviluppo di una ipertricosi con la sua assunzione sistemica, tuttavia è possibile ipotizzare che l’agente immunosoppressivo provochi una depressione di geni “tricogeni”, con formazione di un ormone paracrino (HrGF ?). La ciclosporina è un farmaco immunosoppressivo usato sui pazienti che hanno subito un trapianto di organi per evitare il rigetto dell’organo trapiantato. E’ stato osservato come effetto collaterale l’aumento di peluria generalizzata o circoscritta a zone limitate del corpo, generalemente sugli avambracci.
Streptomicina: è stata rilevata una ipertricosi nei pazienti curati con la streptomicina per meningite tubercolare. Questo effetto viene osservato soprattutto nei bambini.
Idantoina: ipertricosi osservata frequentemente nei bambini epilettici inizia generalmente 2-3 mesi dall’inizio del trattamento. Si manifesta inizialmente sulla parte volare degli arti ed in seguito sul tronco e sul viso.
Diazossido: questo farmaco antipertensivo e antipoglicemico provoca ipertricosi generalizzata nel 50% dei bambini ma è molto rara negli adulti.
PUVA Terapia – Psoraleni: L’ipertricosi è piuttosto frequente ma rimane generalmente poco estesa e scompare con l’interruzione del trattamento.
TERAPIA: si basa sulla patogenesi.
-
Nelle forme ad etiologia surrenalica si utilizzeranno farmaci soppressori della secrezione surrenalica androgenica quali i corticosteroidi (desametazone, prednisone, betametasone). Solitamente sono sufficienti 1-2 mg/die per os per 3 mesi.
- Irsutismo idiopatico: desametazone 0.5 mg/notte per 3 mesi
-
Antiprolattinemici derivati dell’ergotamina ad azione dopaminergica: lisuride (Dopergin© cpr 5 mg), metergolina (Liserdol© cpr 4 mg) e la più recente cabergolina (Dostinex© cpr 2 mg: ½ cpr/w/2 mesi); intervento chirurgico in caso di macroprolattinoma (6-8).
-
L’iperandrogenismo di origine ovarica si giova della terapia con estro-progestinici combinati monofasici: bloccano l’ovulazione e la secrezione androgenica tecale. Ottima l’associazione con antiandrogeni come la flutamide (Eulexin© cpr 250 mg) inibitore recettoriale degli androgeni o capaci di inibire l’attività della 5-α-reduttasi come la finasteride (Finastid© cpr 5 mg). Il farmaco antiandrogeno più utilizzato e testato è il ciproterone acetato, antiandrogeno che agisce con meccanismo di competizione recettoriale, utilizzato da solo (Androcur © cpr 50 mg) o in associazione con etinil-estradiolo (Diane© 21 cpr: 2 mg + 0.035 mg). La terapia in genere dura 5-6 mesi; le compresse Diane seguono lo schema di somministrazione della comune pillola contraccettiva in confezione da 21 compresse mentre se si instaura una terapia personalizzata di associazioni antiandrogeni-l’EE, l’antiandrogeno è somministrato per soli 10-14 giorni/ciclo (9-15).
-
Cimetidina (Cimetidina TEV, Tagamet, Biomag cpr 400 mg) : H2-antagonista a lungo utilizzata nella terapia dell’ulcera peptica. E’ dotata di azione bloccante i recettori per gli androgeni e inibisce la traslocazione del complesso ormone-recettore al nucleo (23).
- Spironolattone (Spirolang® cpr 50 mg, Aldactone® cpr 100 mg, Uractone®): è un farmaco anti-androgeno/diuretico che si raccomanda di assumere per 3 mesi alla dose di 50-200 mg/dì per via orale, una volta al giorno o frazionando il dosaggio in due volte.
- Ketoconazolo (Nizoral® crema): applicare il prodotto sulla cute affetta da irsutismo, una o due volte al giorno, secondo quanto prescritto dal medico. Il chetoconazolo è comunque un farmaco di seconda linea per la cura dell’irsutismo; in genere, viene impiegato per trattare la dermatite seborroica. Non utilizzare il farmaco qualora si siano utilizzati cortisonici nelle due settimane antecedenti.
- Biorevolt® donna crema (inibisce a livello cutaneo la 5-α-reduttasi che trasforma il T nel più potente DHT)
- Eflornitina (Vaniqa® crema): crema per applicazione topica; si tratta di un farmaco antiprotozoario, in grado di inibire la produzione dell’enzima ornitina-decarbossilasi nei follicoli del pelo, implicato nel metabolismo della crescita pilifera. Effetti collaterali: acne, follicolite ed alopecia nel 10% dei casi. In tale caso associare
- Metformina (Metforal cpr 500 mg x2/die): anche in donne magre, favorisce il metabolismo glicidico, combatte l’insulino-resistenza e contrasta l’ipersecrezione androgenica.
- Stile di vita: dieta mediterranea, iposodica, ipocalorica, ipoglicidica ed ipolipidica, ricca di verdure. Esercizio fisico di tipo aerobico, possibilmente all’aria aperta come jogging ma anche step, salto con la fune, anelli.
- Elettrolisi: riveste un’importante alternativa per nascondere l’irsutismo: questa pratica agisce sul follicolo pilifero, distruggendolo grazie ad una fonte energetica in grado di generare calore all’interno del pelo.
Se l’irsutismo si accompagna a segni di virilizzazione ed il trattamento farmacologico è inefficace o sconsigliato, si ricorre alla rimozione chirurgica dell’organo iperproduttore di androgeni.
Enjoy this exciting new issue and stay tuned for more!
We value your opinion and are receptive to comments and suggestions.
Sicerely,
dr. Enzo Volpicelli
References list:
- Speroff L., Glass R.H., Kase N. G.: “Clinical gynecologie endocrinology and infertility”. Williams & Wilkins Co. USA 1993
- Andreoli C e Furbatto G.: “Manuale di endocrinologia ginecologica”. Ed. Minerva Medica, 1980.
- Cortet-Rudelli C. Et Dewally D.: “Hyperandrogènie de l’adolescente”. Encycl Méd Chir (Elsevier, Paris), Gynécologie, 802-A-36, 1996,3p.
- Ferriman D , Gallway JD: “Clinical assessment of body air in women”. J Clin Endocrinol Metab 1961,24:1440-1448.
- Peillon F. et al. ; J. Clin. Endocrinol. Metabol. 73:1008-1015, 1991.
- Volpicelli V, Lauda N, Maisto V. Renzi C., Ferrari A.A.: “Endocrinologia dell’allatamento; breve rassegna e contributo casistico”. Panorama Sanitario 1981;6, 23-37.
- Del Basso F., Volpicelli V., Maisto V., Tomasillo G., Nista L.A., Piedimonte A. e Stozzetti A.: “Prolattina ed oligomenoree secondarie”. (1980; Idelson Ediz., Napoli)
- Genazzani A.: “Endocrinologia Ginecologica”. Ediz. Editeam sas, Cento (Fe); 2004.
- Venturoli S, Marescalchi O, Colombo FM, Macrelli S, Ravaioli B, Bagnoli A, Paradisi R, Flamigni C: “A prospective randomized trial comparing low dose flutamide, finasteride, ketoconazole, and cyproterone acetate-estrogen regimens in the treatment of hirsutism”. J Clin Endocrinol Metab 1999 Apr;84(4):1304-10.
- Falsetti L, Gambera A: “Comparison of finasteride and flutamide in the treatment of idiopathic hirsutism”. Fertil Steril 1999 Jul;72(1):41-6.
- Sahin Y, Bayram F, Kelestimur F, Muderris I: “Comparison of cyproterone acetate plus ethinyl estradiol and finasteride in the treatment of hirsutism”. J. Endocrinol Invest 1998 Jun;21(6):348-52
- Venturoli S, Fabbri R, Dal Prato L, Mantovani B, Capelli M, Magrini O, Flamigni C: “Ketoconazole therapy for women with acne and/or hirsutism”. J Clin Endocrinol Metab 1990 Aug;71(2):335-9.
- Pazos F, Escobar-Morreale HF, Balsa J, Sancho JM, Varela C: “Prospective randomized study comparing the long-acting gonadotropin-releasing hormone agonist triptorelin, flutamide, and cyproterone acetate, used in combination with an oral contraceptive, in the treatment of hirsutism”. Fertil Steril 1999 Jan;71(1):122-8.
- Fruzzetti F, de Lorenzo D, Parrini D, Ricci C: “A comparison between two doses of flutamide (250 mg/d and 500 mg/d) in the treatment of hirsutism”. Fertil Steril 1997 Oct;68(4):644-647.
- Hordinsky, Maria K.; Amy J. McMichael (2008). Hair and Scalp Diseases: Medical, Surgical, and Cosmetic Treatments (Basic and Clinical Dermatology)
- Murata M., Hara K., Saku T. Dynamic distribution of basic fibroblast growth factor during epulis formation: an immunohistochemical study in an enhanced healing process of the gingiva. J. Oral Pathol Med 1997; 26 (5): 224-32
- Jafarzadeh H, Sanatkhani M, Mohtasham N. Oral pyogenic granuloma: a review. J Oral Sci 2006: 48(4): 167-75.
- Halliday H, Gordon S, Bhola M. Case report: an unusually large epulis on maxillary gingiva of a 24 year old woman. Gen Dent 2007; 55(3):232-5.
- Patrice SJ et al. Pyogenic Granuloma (Lobular capillary hemangioma): a clinicopathologic study of 178 cases. Pediatr Dermatol 1991;8(4):267-76.
- Epivatianos A., Antoniades D. et al. Pyogenic granuloma of the oral cavity: comparative study of its clinicopathological and immunohistochemical features. Pathol Int. 2005; 55(7): 391-7.
- Roh MR et al, J Dermatol 2006; 33: 574-576 Gastro2006 Dermo2006 Farma2006
- Katsikeris N. Et al. Pheriperal giant cell ganuloma: clinicopathology study of 244 new cases and review of 956 reported cases. Int J. Oral MaxilloFac Surg 1988; 17: 94-99.





13 commenti
I delight in, lead to I discovered exactly what I used to be taking a look for.
You have ended my four day long hunt! God Bless you man. Have a great day.
Bye
My brother suggested I might like this website.
He was entirely right. This post truly made my day.
You can not imagine just how much time I had spent for this information! Thanks!
I am regular reader, how are you everybody? This paragraph posted
at this site is really good.
Greetings! Very useful advice within this post!
It’s the little changes which will make the most significant changes.
Thanks for sharing!
Good blog post. I certainly love this website. Continue the good work!
Nice post. I was checking constantly this weblog and I am inspired!
Extremely useful info particularly the remaining section
I care for such information much. I was looking for this particular info for
a very long time. Thanks and best of luck.
Definitely believe that which you stated. Your favorite reason seemed
to be on the web the simplest thing to be aware of.
I say to you, I definitely get irked while people
consider worries that they plainly do not know about.
You managed to hit the nail upon the top and defined out
the whole thing without having side effect , people could take a signal.
Will probably be back to get more. Thanks
No matter if some one searches for his essential thing, thus
he/she needs to be available that in detail, so that thing is maintained over here.
This page truly has all of the information I wanted
about this subject and didn’t know who to ask.
Howdy! I’m at work browsing your blog from my new iphone 4!
Just wanted to say I love reading through your blog and look forward to all your posts!
Carry on the outstanding work!
I love your blog.. very nice colors & theme. Did you make this website yourself or did you
hire someone to do it for you? Plz respond as I’m looking to design my
own blog and would like to find out where u got this from.
appreciate it
Tremendous things here. I am very happy to look your post.
Thanks so much and I’m looking ahead to touch you.
Will you please drop me a e-mail?
Pretty part of content. I simply stumbled uponn your weblog andd iin accessin capittal
tto sayy that I geet actually lobed account youur wweblog posts.
Anny wway I’ll bbe subscrbing iin youjr feeds or evern I fulfillent you accews onsistently fast.