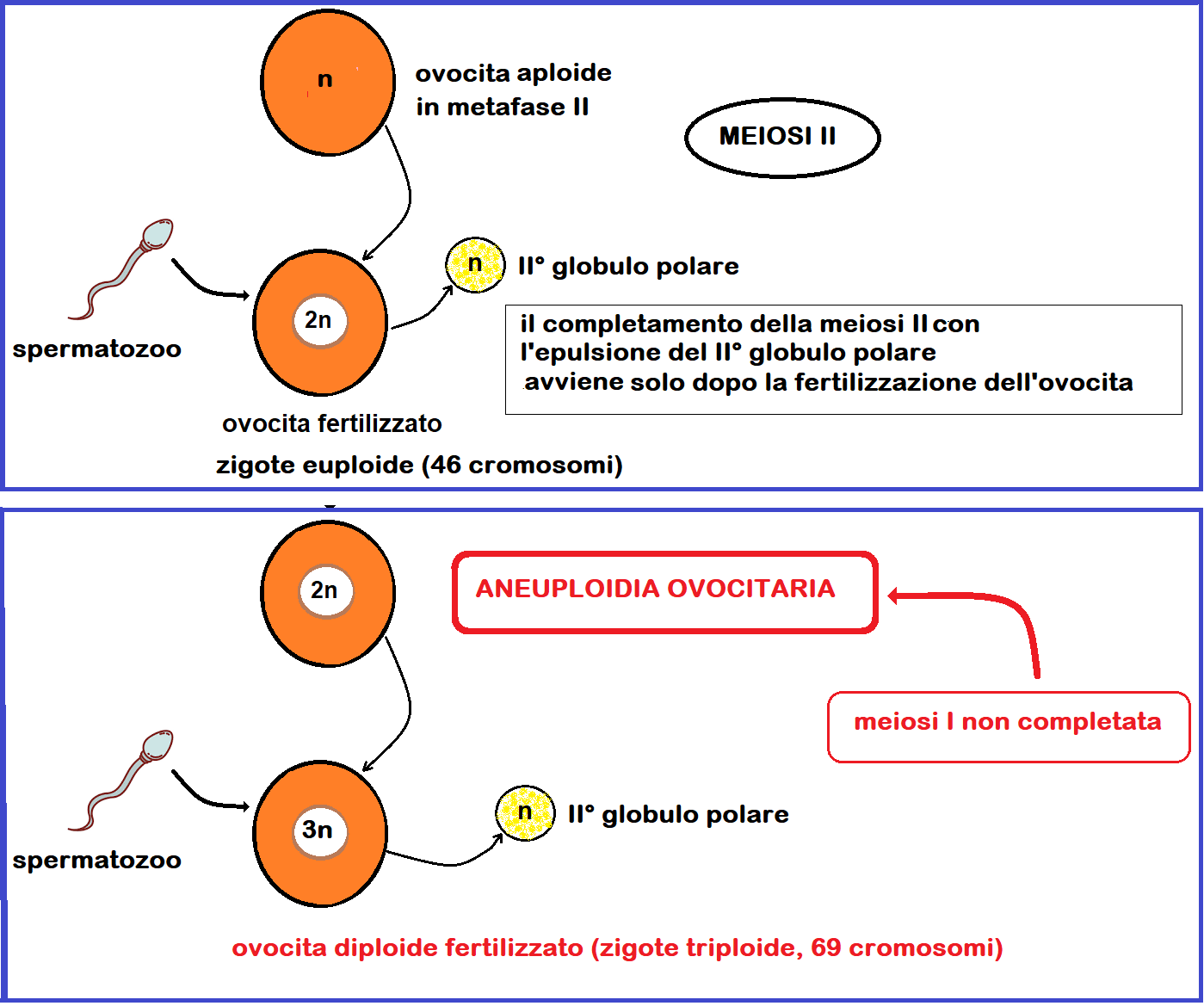
Aneuploidie ovocitarie: La percentuale di gravidanza è strettamente correlata al numero e alla qualità degli ovociti e, specialmente nelle >40, al numero degli ovociti recuperati ed entrambi decrescono bruscamente dopo i 35 anni. Il decremento del numero dei piccoli follicoli antrali (2-5 mm) è facilmente documentabile dall’osservazione ecografica effettuata al 3° giorno di un ciclo spontaneo. La scarsa qualità degli ovociti è da addebitare soprattutto alla mancata prima disgiunzione meiotica (1-3).
La prima divisione meiotica (detta anche meiosi riduzionale) avviene poche ore prima dell’ovulazione e divide l’ovocita primario in un ovocita secondario con corredo cromosomico aploide ed un globulo polare grazie ad una citodieresi asimmetrica. Dopodichè l’ovocita secondario inizia la meiosi II che però si arresta in metafase. Lo sblocco di queste due meiosi è dovuto alla neutralizzazione, da parte dell’ormone luteinizzante (LH), di un fattore inibente la meiosi prodotto dalle cellule del cumulo ooforo e reperibile nel liquido follicolare. Al momento della sua espulsione, l’oocita di 2° ordine è bloccato nella metafase della seconda divisione meiotica che potrà completarsi con la formazione dell’uovo maturo e l’emissione del II° globulo polare, solo se avrà luogo la fecondazione.
In caso di mancata prima divisione meiotica possiamo avere una mancata fertilizzazione dell’ovocita oppure embrioni con aneuploidie soggetti ad elevata probabilità di aborto nel I° trimestre.
La mancata prima divisione meiotica si osserva nel 25% di tutti gli ovociti apparentemente normali ma si osserva con aumentata frequenza nelle donne di età >35 anni (3-8). Si ritiene che i meccanismi alla base di questi processi includano disfunzione della coesione, accorciamento dei telomeri, instabilità del fuso, controllo aberrante del checkpoint, la metilazione del DNA e le modificazioni dell’istone nella cromatina. I radicali liberi provenienti da fonti endogene ed esogene sono maggiormente presenti nelle donne >35 vanni e possono essere fattori determinanti del danno molecolare agli apparati di segregazione cromosomica degli ovociti causando aneuploidie e altre manifestazioni di scarsa qualità degli ovociti.
Endometriosi e aneuploidie ovocitarie – Le mestruazioni retrograde si verificano nelle donne con endometriosi. Questo porta il sangue mestruale in prossimità delle tube di Falloppio e delle ovaie. Poiché il sangue rifluito subisce una degradazione naturale, il contenuto intracellulare viene rilasciato dai globuli rossi. Ciò aumenta notevolmente le concentrazioni locali di ferro che stimolano la formazione dei radicali liberi che possono danneggiare le strutture cellulari degli ovociti.
References:
- Meiotic spindle assembly checkpoint and aneuploidy in males versus females. Cell Mol Life Sci. 2019 Mar;76(6):1135-1150
- Angell R: “First meiotic-division nondisjunction in human oocytes”. Human Genet 1997;61:23-32.
- Battaglia DE, Goodwin P, Klein NA, Soules MR: “Influence of maternal age on meiotic spindle assembly in oocytes from naturally cycling women”. Hum Reprod 1996;11.2217-22.
- Mechanisms of oocyte aneuploidy associated with advanced maternal age. Mutat Res Jul-Sep 2020;785:108320.
- Why is oocyte aneuploidy increased with maternal aging? J Genet Genomics. 2020 Nov 20;47(11):659-671
- Pellestor F, Andreo B, Arnal F, Humeau C, Demaille J: “Materrnal aging and chromosal abnormalities: new data drawn from in vitro unfertilized human oocytes”. Hum Genet 2003;112:195-203.
- Lori R. Bernstein and Nathan R. Treff: Editorial: Causes of Oocyte Aneuploidy and Infertility in Advanced Maternal Age and Emerging Therapeutic Approaches. Front Endocrinol (Lausanne). 2021; 12: 652990
- Sasaki H, Hamatani T, Kamijo S, Iwai M, Kobanawa M, Ogawa S, et al.. Impact of oxidative stress on age-associated decline in oocyte developmental competence. Front Endocrinol (2019) 10:811.
- Neal SA, Morin SJ, Franasiak JM, Goodman LR, Juneau CR, Forman EJ, et al.. Preimplantation genetic testing for aneuploidy is cost-effective, shortens treatment time, and reduces the risk of failed embryo transfer and clinical miscarriage. Fertil Steril (2018) 110:11896–904.
- Ben-Meir A, Burstein E,A, Chong AJ, Wong E, Yavorska T, Naranian T, et al.. Coenzyme Q10 restores oocyte mitochondrial function and fertility during reproductive aging. Aging Cell (2015) 14:887–95.
- Ben-Meir A, Kim K, McQuaid R, Esfandiari N, Bentov Y, Casper RF, et al.. Co-Enzyme Q10 supplementation rescues cumulus cells dysfunction in a maternal aging model. Antioxida (Basel) (2019) 8:58.
- Bentov Y, Hannam T, Jurisicova A, Esfandiari N, Casper RF. Coenzyme Q10 supplementation and oocyte aneuploidy in women undergoing IVF–ICSI treatment. Clin Med Insights Reprod Health (2014) 8:31–6
- Xu Y, Nisenblat V, Lu C, Li R, Qiao J, Zhen X, et al.. Pretreatment with coenzyme Q10 improves ovarian response and embryo quality in low-prognosis young women with decreased ovarian reserve: a randomized controlled trial. Reprod Biol Endocrinol (2018) 16:29
- Løssl K, Freiesleben NLC, Wissing ML, Petersen KB, Holt MD, Mamsen LS, et al.. Biological and clinical rationale for androgen priming in ovarian stimulation. Front Endocrinol (Lausanne) (2020) 11:627.