I “soft markers” sono segni ecografici particolari dell’anatomia fetale che vanno ricercati alla 16-20a settimana di gravidanza perchè possono essere associati a cromosomopatie fetali come la sindrome di Down (trisomia 21), S. di Patau (trisomia 13), S. di Edwards (trisomia 18) ed altre cromosomopatie. Sono una decina i soft markers più noti e la loro presenza è correlata ad un aumentato rischio (likehood ratio) di cromosomopatie fetali; spesso però si osservano anche alla scansione ecografica di feti sani. Il riscontro isolato di un soft marker è piuttosto frequente è quasi sempre senza significato patologico (1-3).
- In presenza di un solo soft marker, occorre una valutazione dettagliata dell’anatomia fetale, per evidenziare eventuali altri markers o anomalie associate.
- In presenza di ≥2 soft markers occorre effettuare amniocentesi o villocentesi ed esame del cariotipo fetale.
E’ importante ricordare che la diagnosi di cromosompatia non viene effettuata ecograficamente, ma con l’esame del DNA fetale ricavato dall’amniocentesi o dal plasma materno (NIPD). Infatti circa metà dei feti Down non presenta alcun tipo di anomalia all’esame ecografico, compresi i soft markers (4-12).
——————————————————————————————————————–
Indice:
- Focus iperecogeno cardiaco (Golf ball)
- Dilatazione renale pelvica
- Intestino iperecogeno
- Cisti dei plessi corioidei
- Femore corto
- Omero corto
- Plica nucale inspessita
- Ossa nasali ipoplastiche
- Clinodattilia del 5° dito
- Brachicefalia
- Straberry-shaped skull
- Orecchie piccole
- Arteria ombelicale unica
——————————————————————————————–
Focus iperecogeno (golf ball)
Molto frequente, si riscontra nell’1-3% dei feti sani. Si evidenzia ecograficamente come una o più aree  iperecogene, solitamente posizionate all’interno del ventricolo sinistro del cuore (88%), nel 5% a carico del ventricolo destro e nel 7% a carico di entrambi i ventricoli. La localizzazione destra e la bilaterale sembrano associati ad un maggior rischio di malformazioni (13-16).
iperecogene, solitamente posizionate all’interno del ventricolo sinistro del cuore (88%), nel 5% a carico del ventricolo destro e nel 7% a carico di entrambi i ventricoli. La localizzazione destra e la bilaterale sembrano associati ad un maggior rischio di malformazioni (13-16).
La golf ball origina dalla calcificazione di uno dei muscoli papillari del cuore, che hanno la funzione di tenere ancorati i lembi della valvola atrio-ventricolare, come le corde di un paracadute. Il grading sonografico è valutato, come per l’intestino iperecogeno, in relazione all’ecogenicità dell’osso.
Il focus iperecogeno non è una malformazione del cuore e non compromette in alcun modo la funzionalità cardiaca. Sembra essere una normale variazione nello sviluppo del muscolo papillare. Se isolato, non modifica il rischio di sindrome di Down. In assenza di anomalie associate non è indicata l’esecuzione del cariotipo. Una metanalisi ha suggerito un likelihood ratio di 2.8.
Il focus iperecogeno non è un’indicazione per ecocardiografia fetale, poichè, se isolato, non si associa a malformazioni cardiache (17-24).
Dilatazione renale pelvica (pielectasia)
La dilatazione renale pelvica (o pielectasia) si riscontra nell’1% dei feti sani, soprattutto di sesso maschile. La RPD (Renal Pelvic Dilatation) consiste nella dilatazione della pelvi renale a causa del ristagno di urina da lieve ostacolo o stenosi ureterale a valle. Con il passare del tempo quasi sempre gli ureteri aumentano di calibro e la RPD scompare. All’osservazione USG la RPD appare come un’area ipo-anecogenza rotondeggiante o ellissoidale in corrispondenza della pelvi renale. La misurazione è effettuata su una sezione trasversa della pelvi renale; si prende in considerazione il diametro massimo antero-posteriore (25-28).
Una dilatazione <5 mm non è considerata patologica, mentre una dilatazione >5 mm pone l’indicazione per una valutazione dettagliata dell’anatomia fetale tramite USG morfostrutturale. Se questa è regolare e non ci sono altri markers, non è indicata l’esecuzione del cariotipo.
Quando la pielectasia è >10 mm, solitamente accompagnata da dilatazione dei calici (calicopielectasia) si parla di idronefrosi congenita. In questi casi sarà importante valutare lo spessore e l’aspetto del parenchima renale, che nei casi di ostruzione più importante (>15-20 mm) potrebbe essere alterato (assottigliamento della corteccia renale, aspetto iperecogeno, eventuale presenza di cisti corticali). Può essere opportuno richiedere una consulenza con l’urologo pediatra, al fine di programmare il management da intraprendere subito dopo la nascita. La likelihood ratio per cromosomopatie è del 2% in caso di dilatazione >5 mm.
La pelviectasia non è indicazione ad anticipare il parto. La pelviectasia richiede un controllo ecografico del neonato, e, talora, terapia antibiotica per impedire infezioni urinarie, favorite da eventuale reflusso urinario dalla vescica verso i reni (28-30).
———————————————————————————
Intestino iperecogeno
Si riscontra, preferibilmente nel quadrante addominale inferiore destro, con una frequenza di 0.2-1.8% delle gravidanze. Ecograficamente l’intestino in condizioni normali presenta un grading ecografico uguale a quello del fegato fetale. Si parla di “iperecogenicità intestinale”, quando il grading intestinale è maggiore di quello epatico. Nei casi più gravi l’ipercogenicità intestinale può raggiungere un grading della stessa intensità dell’osso (31).
L’eziologia non è conosciuta. Si è ipotizzato che l’intestino iperecogeno sia provocato dalla sottrazione di acqua dal meconio o dalla deglutizione da parte del feto di sangue presente nel liquido amniotico; in tal modo l’intestino appare iperecogeno. Altre possibili cause sono:
- sindrome di Down: la presenza di intestino iperecogeno aumenta il rischio Down di circa 3 volte
- fibrosi cistica: la FC interessa tutte le ghiandole esocrine e le conseguenze sono particolarmente gravi a livello di intestino e polmoni. E’ opportuno effettuare nei genitori il test del sudore (che misura la concentrazione di sali nel sudore) o la ricerca di mutazioni (31-200 mutazioni, alcune specifiche della popolazione italiana) del gene CFTR (Cystic Fibrosis Transmembrane Regulator), allocato sul cromosoma 7, sui genitori e sul feto (NIPD, villocentesi, amniocentesi). Negli individui malati entrambe le copie del gene per la FC sono entrambe alterate. Gli individui che possiedono una sola copia del gene alterato e una normale sono invece privi di ogni sintomo, ma sono portatori sani. Il risultato genetico negativo non esclude al 100% l’assenza della fibrosi cistica a causa dell’impossibilità di analizzare tutte le possibili 200 mutazioni del gene.
- ritardo di crescita fetale (IUGR)
- insufficienza placentare
- ostruzione o atresia intestinale
- emorragia intramniotica
- infezioni (soprattutto da Cytomegalovirus)
- post-amniocentesi
- distacco di placenta
- morte fetale
Accertamenti da eseguire:
- cariotipo
- ricerca delle mutazioni per la fibrosi cistica nei genitori
- controlli seriati della crescita
- esami per la ricerca di infezioni
L’osservazione dell’intestino iperecogeno si riscontra nel 70% delle gravidanze normali e, se si escludono le cause sopraelencate, la prognosi è solitamente positiva.
—————————————————————————
Cisti dei plessi corioidei
sono piccole formazioni cistiche rotondeggianti, costituite da raccolte di liquido cefalo-rachidiano e perciò transoniche o con modesti echi interni dovuti a detriti cellulari. Hanno un diametro di 3-10 mm e si  risolvono generalmente in 6-8 settimane prima della 28a settimana.
risolvono generalmente in 6-8 settimane prima della 28a settimana.
La loro eziologia è ignota.
Per una loro attenta osservazione ecografica occorre una scansione trasversale del cranio fetale all’altezza dei ventricoli cerebrali laterali.
Si osservano nell’1-3% dei feti sani (32-35).
La presenza delle cisti dei plessi corioidei non costituisce una malformazione e non ha alcun significato per il benessere e lo sviluppo fetale. Se isolata, non modifica il rischio di sindrome di Down.
In realtà, essa rappresenta un marker di trisomia 18, e, anche in questo caso, se non ci sono malformazioni associate, non è giustificata l’esecuzione del cariotipo (36-42).
 ———————————————————————————————
———————————————————————————————
Femore corto
Si riscontra nell’1% dei feti. Ecograficamente, il femore si presenta di una lunghezza del femore <5° percentile con circonferenza addominale e peso fetale >10° per l’epoca gestazionale.  La misurazione deve essere effettuata con l’osso perpendicolare al fascio di ultrasuoni e con cartilagini epifisarie visibili ma non incluse nella misurazione (42-46).
La misurazione deve essere effettuata con l’osso perpendicolare al fascio di ultrasuoni e con cartilagini epifisarie visibili ma non incluse nella misurazione (42-46).
Le cause di femore corto sono molteplici:
- costituzionale: se i genitori sono bassi, anche il feto avrà la misura del femore più piccola della norma. Si tratta dell’evenienza più frequente.
- sindrome di Down: la presenza di femore corto comporta un aumento del rischio Down di 1.6 volte.
- ritardo di crescita (IUGR)
- displasia scheletrica: patologia dello scheletro con problemi di accrescimento staturale anche in età postnatale.
In caso di femore corto si esegue una valutazione dettagliata dell’anatomia fetale tramite USG morfostrutturale alla ricerca di altre malformazioni soprattutto scheletriche (displasie) ed un attento monitoraggio della crescita fetale (rischio di IUGR). Le displasie  scheletriche sono patologie rarissime, e solitamente danno altri segni oltre al femore corto. Bisogna però ricordare che in alcune situazioni patologiche (ad esempio l’acondroplasia, che è una forma di nanismo) la diagnosi avviene nel terzo trimestre, mentre nel secondo trimestre le misure delle ossa lunghe possono essere nella norma. Il femore corto può essere il primo segno di insufficienza placentare ed è associato ad una triplicazione del rischio di IUGR (47-55).
scheletriche sono patologie rarissime, e solitamente danno altri segni oltre al femore corto. Bisogna però ricordare che in alcune situazioni patologiche (ad esempio l’acondroplasia, che è una forma di nanismo) la diagnosi avviene nel terzo trimestre, mentre nel secondo trimestre le misure delle ossa lunghe possono essere nella norma. Il femore corto può essere il primo segno di insufficienza placentare ed è associato ad una triplicazione del rischio di IUGR (47-55).
———————————————————————————
Un omero corto presenta una lunghezza <2.5° percentile per l’età gestazionale o come una misura <0,9% al diametro biparietale. I caliper vengono posizionati alle due estremità della diafisi dell’osso che deve essere perpendicolare al fascio di ultrasuoni e con cartilagini epifisarie visibili ma non incluse nella misurazione (48-52).
Associazione con aneuploidie fetali: l’omero corto possiede una sensibilità del 9% con un tasso di falsi positivi del 3%. Una meta-analisi ha mostrato un rapporto di verosimiglianza di 7,5 (95% CI 4,5-12) .
Associazione con anomalie non cromosomiali : l’omero corto può anche essere associato con displasie scheletriche o IUGR (52-55). 
—————————————————————————————————————————-
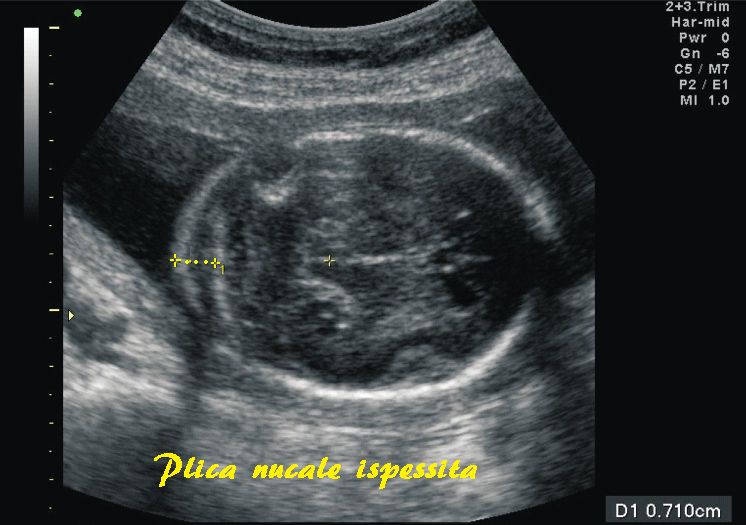
Plica nucale inspessita
La plica nucale inspessita (>6 mm) si osserva nell’1% dei feti. La valutazione ecografica si effettua misurando la cute dietro al collo del feto nel II° trimestre, fra la 14a e la 20a settimana di gestazione nella sezione utilizzata per misurare i diametri cerebellari. I caliper vanno posizionati sulla superficie esterna dell’osso occipitale e la superficie esterna della cute fetale a livello della midline cerebrale. La sua misurazione ha una sensibilità del 40% e una percentuale di falsi positivi dell’1%. Si considera patologica una rilevazione >6 mm. La sua presenza aumenta di 10 volte il rischio di sindrome di Down. La presenza di plica nucale ispessita, anche se isolata, è un’indicazione all’esecuzione dell’amniocentesi o villocentesi per l’esame del cariotipo fetale. (56-65)
Ossa nasali ipoplastiche
Anche l’osso nasale è un importante marker di sindrome di Down. Il riscontro di ossa nasali assenti o ipoplastiche rappresenta da solo una indicazione all’esecuzione dell’amniocentesi e del cariotipo fetale, e può essere indicativo di alcuni tipi di displasie scheletriche (66-73).
Associazione con aneuploidie fetali: la clinodattilia del 5° dito si trova nel 3,4% dei feti normalii e nel 18,8% dei feti con sindrome di Down. Questo suggerisce un rapporto di verosimiglianza di 5,6 (95% CI 2,5-11,9) . Come trovare marker isolato, la clinodattilia non è associata con anomalie non cromosomiali (74).
 non cromosomiali. ricordiamo che altri segni caratteristici della S. di Edwards sono il pugno chiuso (cleched hand) e la sovrapposizione (overlapping) del secondo dito della mano sul terzo e del quinto sul quarto (“segno delle corna”). Osservazioni queste che si protraggono immutate durante tutto la durata dell’esame ecografico.
non cromosomiali. ricordiamo che altri segni caratteristici della S. di Edwards sono il pugno chiuso (cleched hand) e la sovrapposizione (overlapping) del secondo dito della mano sul terzo e del quinto sul quarto (“segno delle corna”). Osservazioni queste che si protraggono immutate durante tutto la durata dell’esame ecografico. Associazione con anomalie non cromosomilai: le orecchie piccole e a bassa inserzione sono associatie con altre anomalie genetiche; tuttavia, il rilevamento prenatale e la valutazione sono difficili (94-98).
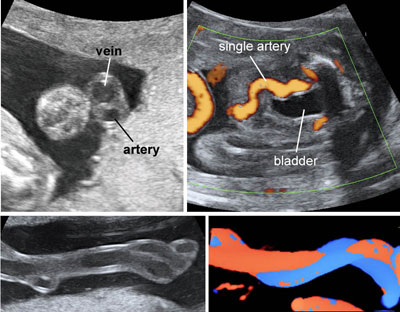
Arteria ombelicaleunica
Si riscontra nell’1-2% di tutti i feti. Può essere osservata in sezioni trasverse o longitudinale del cordone ombelicale. L’uso del color doppler ottimizza la visione.
L’arteria ombelicale unica può associarsi a:
- anomalie cromosomiche (trisomia 13, trisomia 18), ma solo se coesistono altre malformazioni
- agenesia renale unilaterale
- ritardo di crescita (IUGR) nel 15% dei casi
In caso di arteria ombelicale unica, in assenza di altre anomalie non si modifica il rischio di sindrome di Down e pertanto non è indicata l’esecuzione del cariotipo. E’ consigliabile monitorare la crescita fetale con controlli seriati fino a termine di gravidanza (99-105).
Conclusioni:
Se all’ecografia risultano due o più markers per la sindrome di Down, si può, tramite la consulenza genetica, accedere ad amniocentesi o villocentesi.
References:
- Bromley B, Lieberman E, Shipp TD, Benacerraf BR. The genetic sonogram: a method of risk assessment for Down syndrome in the second trimester. J Ultrasound Med 2002;21(10):1087–96; quiz 1097–8.
- Periodic health examination, 1992 update: 2. Routine prenatal ultrasound screening. Canadian Task Force on the Periodic Health Examination. Can Med J 1992;147(5):627–33.
- Society of Obstetricians and Gynaecologists of Canada. Guidelines for the performance of ultrasound examination in obstetrics and gynaecology. J Soc Obstet Gynaecol Can 1995;17:263–6.
- Michiel C. Van den Hof, MD, Halifax NS R. Douglas Wilson: Fetal Soft Markers in Obstetric Ultrasound. J Obstet Gynaecol Can 2005;27(6):592–612 Long G, Sprigg A. A comparative study of routine versus selective fetal anomaly ultrasound scanning. J Med Screen 1998;5(1):6–10.
- Nicolaides KH, Snijders RJ, Gosden CM, Berry C, Campbell S. Ultrasonographically detectable markers of fetal aneuploidy. Lancet 1992;340:704–7.
- Vintzileos A, Guzman ER, Smulian JC, Yeo L, Scorza WE, Knuppel RA. Second-trimester genetic sonography in patients with advanced maternal age and normal triple screen. Obstet Gynecol 2002;99(6):993–5.
- Snijders RJM, Nicolaides KH. Ultrasound Markers for Fetal Chromosome Defects. Carnforth: Parthenon Publishing, 1996.
- Epstein CJ (June 2006). “Down’s syndrome: critical genes in a critical region”. Nature 441 (7093): 582–83. doi:10.1038/441582a. PMID 16738647.
- Nelson, DL; Gibbs, RA (2004). “Genetics. The critical region in trisomy 21″. Science (journal) 306(5696): 619–21. doi:10.1126/science.1105226. PMID 15499000.
- Olson, LE; Richtsmeier, JT; Leszl, J; Reeves, RH (2004). “A chromosome 21 critical region does not cause specific Down syndrome phenotypes”. Science (journal) 306 (5696): 687–90.doi:10.1126/science.1098992. PMID 15499018.
- Anderson N, Jyoti R. Relationship of isolated fetal intracardiac echogenic focus to trisomy 21 at the mid-trimester sonogram in women younger than 35 years. Ultrasound Obstet Gynecol 2003;21:354–8.
- Smith-Bindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Second-trimester ultrasound to detect fetuses with Down syndrome–a meta-analysis. JAMA 2001;285(8):1044–55.
- Levy DW et al.: The left ventricular echogenic focus. A normal finding. AJR,150:85;1998
- Brown DL et al.: Left ventricular echogenic focus in the fetal heart: Pathologic correlation. J Ultras Med,13:613;1994
- Bromley B et al.: Echogenic intracardiac focus: a sonographic sign for fetal down syndrome. Obstet Gynecol,86(6):998;1995
- Winter TC et al.: Echogenic intracardiac focus in 2nd-trimester fetuses with trisomy 21: usefulness as aUS marker. Radiology,216(2):450;2000
- Significance of fetal intracardiac echogenic foci in relation to trisomy 21: a prospective sonographic study of high-risk pregnant women.
AJR Am J Roentgenol. 1998 Apr;170(4):1083-4.
- DeVore GR. The genetic sonogram: its use in the detection of aneuploidy in fetuses of women of advanced maternal age. Prenat Diagn 2001;21(1):40–5.sonogram: a method of risk assessment for Down syndrome in the secondtrimester. J Ultrasound Med 2002;21:1087–96.10.
- Sohl B, Scioscia A, Budorick, NE, Moore TR. Utility of minor ultrasonographic markers in the prediction of abnormal fetal karyotype at aprenatal diagnostic center. Am J Obstet Gynecol 1999;181:898–903.11.
- Verdin SM, Whitlow BJ, Lazanakis M, Kadir RA, Chatzipapas I,Economides DL. Ultrasonographic markers for aneuploidy in women with
- negative nuchal translucency and second trimester maternal serum biochemistry. Ultrasound Obstet Gynecol 2000;16(5):402–6.
- Bromley B, Lieberman E, Shipp TD, Benacerraf BR. The genetic Bettelheim D et al.: The Value of echogenic foci (golfball) in the fetal Heart as a marker of chromosomal abnormalities. Ultras Obstet Gynecol,14(2):98;1999
- Lehman CD et al.: Trisomy 13 syndrome. Prenatal US finding in a review of 33 cases. Radiology,194:217;1995
- Bromley B, Lieberman E, Laboda LA, Benacerraf BR.: ”Echogenic intracardiac focus, a sonographic sign for Down Syndrome?” Obstet Gynecol 1995; 86: 998-1001.
- Langer B, Simeoni U, Montoya Y, Casanova R, Schlaeder G. Antenatal diagnosis of upper urinary tract dilation by ultrasonography. Fetal Diagn Ther 1996;11:191–8.
- Wilson RD, Lynch S, Lessoway VA. Fetal pyelectasis: comparison of postnatal renal pathology with unilateral and bilateral pyelectasis. Prenat Diagn 1997;17:451–5.
- Chudleigh PM, Chitty LS, Pembrey M, Campbell S. The association of aneuploidy and mild fetal pyelectasis in an unselected population: the result of a multicenter study. Ultrasound Obstet Gynecol 2001;17:197–202.
- Devore, GR. Trisomy 21: 91% detection rate using second-trimester ultrasound markers. Ultrasound Obstet Gynecol 2000;16:133–41.
- Smith-Bindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Second-trimester ultrasound to detect fetuses with Down syndrome. A meta-analysis. JAMA 2001;285:1044–55.
- Van den Hof MC, Demianczuk NN. Content of a complete obstetrical ultrasound report. J Soc Obstet Gynaecol Can 2001;23(5):427–8.
- Aviram R, Pomeran A, Sharony R, Beyth Y, Rathaus V, Tepper R. The increase of renal pelvis dilatation in the fetus and its significance. Ultrasound Obstet Gynecol 2000; 16:60–2.
- Bromley B, Doubilet P, Frigoletto Fd Jr. Krauss C, Estroff JA, Benacerraf BR.: “Is fetal hyperechoic bowel on second trimester sonogram an indication for amniocentesis?”. Obstet Gynecol 1994; 83: 647-51.
- Gross SJ, Shulman LP, Tolley EA, Emerson DS, Felker RE, Simpson JL, Elias S. Isolated fetal choroid plexus cysts and trisomy 18: a review and meta-analysis. Am J Obstet Gynecol, 1995; 172: 83-7.
- Bromley B, Lieberman E, Benacerraf BR. Choroid plexus cysts: not associated with Down syndrome. Ultrasound Obstet Gynecol 1996; 8: 232-5.
- Ghidini A, Strobelt N, Locatelli A, et Al. Isolated fetal choroid plexus cystis: role of ultrasonography in establishement of the risk of trisomy 18. Am J Obstet Gynecol 2000; 182(4):972-7.
- Demasio K, Canterino J, Ananth C, et Al. Isolated choroid plexus cystis in low-risk women less than 5 years old. Am J Obstet Gynecol 2002;187:1246-9.
- Chitty LS, Chudleigh RP, Wright E, Campbell S, Pembrey M. The significant of choroid plexus cystis in an unselected population: result of a multiceneter study. Ultrasound Obstet Gynecol 1998;12(6):391-7.
- Ghidini A, Strobelt N, Locatelli A, et Al. Isolated fetal choroid plexus cystis: role of ultrasonography in establishement of the risk of trisomy 18. Am J Obstet Gynecol 2000; 182(4):972-7.
- Denis E, Dufour P, Valat AS, Subtil D, Bourgeot P et Al. Choroid plexus cystis and risk of chromosome anomalies. Review of the lieterature and proposed management. J Gynecol Obstet Biol Repod 1998;27(2):144-9.
- Luthy DA, Resta RG, Nyberg BC, Williams MA. Age-adjusted ultrasound risk assessment for fetal Down’s syndrome during the second trimester: description of the method and analysis of 142 cases. Ultrasound Obstet Gynecol 1998; 12: 8-14.
- Snijders RJM, Nicolaides KH. Ultrasound Markers for Fetal Chromosome Defects. Carnforth: Parthenon Publishing, 1996.
- Gonen R, Kar H, Degani S. The Kariotype of the fetuses with anomalies detected by the second trimester ultrasonography. Europ J Obstet Gynecol Reprod Biol 1995;58(2):153-55.
- Gonen R, Kar H, Degani S. The Kariotype of the fetuses with anomalies detected by the second trimester ultrasonography. Europ J Obstet Gynecol Reprod Biol 1995;58(2):153-55.
- . Nyberg DA, Resta RG, Luthy MA, Hickok DE, Williams MA. Humerus and femur length shortening in the detection of Down syndrome. Am J Obstet Gynecol 1993;168:534–8.2.
- Shipp TD, Bromley B, Mascola M, Benacerraf B. Variation in fetal femur length with respect to maternal race. J Ultrasound Med 2001;20:141–4.4.
- Kurtz AB, Needleman L, Wapner RJ, et al. Usefulness of a short femur in the in utero detection of skeletal dysplasias. Radiology. 1990;177:197–200.
-
Goetzinger KR et al: Isolated Short Femur Length on Mid-Trimester Ultrasound: A Marker for Fetal Growth Restriction and Other Adverse Perinatal Outcomes. J Ultrasound Med. 2012 Dec; 31(12): 1935–1941.
-
Zalel Y, Lehavi O, Schiff E, et al. Shortened fetal long bones: a possible in utero manifestation of placental function. Prenat Diagn. 2002;22:553–557.
-
Ventura W, Huaman J, Nazario CE, Ingar J, Huertas E, Lima OA. Perinatal outcomes after sonographic detection of isolated short femur in the second trimester. J Clin Ultrasound. 2012;40:63–67
-
Nyberg DA, Resta RG, Luthy DA, Hickok DE, Williams MA. Humerus and femur length shortening in the detection of Down’s syndrome. Am J Obstet Gynecol. 1993;168:534–538.
- Kurtz AB, Needleman L, Wapner RJ, Hilpert P, Kuhlman K, Burns PN, Feld RI, Mitchell DG, Segal S, Blum L Usefulness of a short femur in the in utero detection of skeletal dysplasias. Radiology. 1990 Oct; 177(1):197-200.
- Nyberg DA, Resta RG, Luthy DA, Hickok DE, Williams MA Humerus and femur length shortening in the detection of Down’s syndrome. [Am J Obstet Gynecol. 1993] Am J Obstet Gynecol. 1993 Feb; 168(2):534-8.
- Zalel Y, Lehavi O, Schiff E, Shalmon B, Cohen S, Schulman A, Achiron R Shortened fetal long bones: a possible in utero manifestation of placental function. [Prenat Diagn. 2002] Prenat Diagn. 2002 Jul; 22(7):553-7.
- Ventura W, Huaman J, Nazario CE, Ingar J, Huertas E, Antonio Limay O Perinatal outcomes after sonographic detection of isolated short femur in the second trimester. J Clin Ultrasound. 2012 Feb; 40(2):63-7.
- Todros T, Massarenti I, Gaglioti P, Biolcati M, Botta G, De Felice C Fetal short femur length in the second trimester and the outcome of pregnancy.[BJOG. 2004] BJOG. 2004 Jan; 111(1):83-5.
- Weisz B, David AL, Chitty L, Peebles D, Pandya P, Patel P, Rodeck CH Association of isolated short femur in the mid-trimester fetus with perinatal outcome.[Ultrasound Obstet Gynecol. 2008]
Ultrasound Obstet Gynecol. 2008 May; 31(5):512-6.
- Benacerraf BR, Frigoletto FD. Soft tissue nuchal fold in the second trimester fetus: standards for normal measurements compared with those with Down syndrome. Am J Obstet Gynecol 1987;157(5):1146–9.
- Smith-Blindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Second trimester ultrasound to detect fetuses with Down syndrome: a meta-analysis. JAMA 2001;285(8):1044–55.
- Gray DL, Crane JP. Optimal nuchal skin-fold thresholds based on gestational age for prenatal detection of Down syndrome. Am J Obstet Gynecol 1994;171:1282–6.
- Bahado-Singh RO, Oz UA, Kovanci E, Deren O, Feather M, Hsu CD, et al. Gestational age standardized nuchal thickness values for estimating mid-trimester Down syndrome risk. J Matern Fetal Med 1999;8(2):37–43.
- Locatelli A, Piccoli MG, Vergani P, Mariani E, Ghidini A, Mariana S, et al. Critical appraisal of the use of nuchal fold thickness measurements for the prediction of Down syndrome. Am J Obstet Gynecol 2000;82(1)192–8.
- Nyberg DA, Souter VL, El-Bastawissi A, Young S, Luthhardt F, Luthy DA. Isolated sonographic markers for detection of fetal Down syndrome in the second trimester of pregnancy. J Ultrasound Med 2001;20:1053–63.
- Pilu G, Nicolaides KH. Diagnosis of fetal abnormalities: the 18-23-week scan. London: The Parthenon Publishing Group Inc; 1999.
- Bahado-Singh RO, Oz AU, Kovanci E, Deren O, Copel J, Baumgarten A, et al. New Down syndrome screening algorithm: ultrasonographic biometry and multiple serum markers combined with maternal age. Am J Obstet Gynecol 1998;179:1627–31.
- Smith-Bindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Second-trimester ultrasound to detect fetuses with Down syndrome. JAMA 2001;285:1044–55.
- Down LJ. Observations on an ethnic classification of idiots. Clinical Lectures and Reports, London Hospital 1866;3:259–62.
- Minderer S, Gloning KP, Henrich W, Stoger H. The nasal bone in fetuses with trisomy 21: sonographic versus pathomorphological findings. Ultrasound Obstet Gynecol 2003;22:16–21.
- Sonek JD. Nasal bone evaluation with ultrasonography: a marker for fetal aneuploidy. Ultrasound Obstet Gynecol 2003;22:11–5.
- Cicero S, Curcio P, Papageorghiou A, Sonek J, Nicolaides K. Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation: an observational study. Lancet 2001;358:1665–7.
- Budorick NE, Kelly TE, Dunn JA, Scioscia AL. The single umbilical artery in a high-risk patient population. What should be offered? J Ultrasound Med 2001;20:619–27.
- Vintzileos A, Walters C, Yeo L. Absent nasal bone in the prenatal detection of fetuses with trisomy 21 in a high-risk population. Obstet Gynecol 2003;101(5 Part l):905–8.
- Cicero S, Sonek J, McKenna D, Croom C, Johnson L, Nicolaides K. Nasal bone hypoplasia in fetuses with trisomy 21. Ultrasound Obstet Gynecol 2003;21:15–8.
- Bromley B, Lieberman E, Shipp T, Benacerraf B. Fetal nasal bone length: a marker for Down syndrome in the second trimester. J Ultrasound Med 2002;21:1387–94.
- Van den Hof MC, Demianczuk NN. Content of a complete obstetrical ultrasound report. J Soc Obstet Gynaecol Can 2001;23(5):427–8.
- Benacerraf BR, Osathanondh R, Frigoletto FD. Sonographic demonstration of hypoplasia of the middle phalanx of the fifth digit: a finding associated with Down syndrome. Am J Obstet Gynecol 1988;159:181–4.
- Shah YG, Eckl CJ, Stinson SK, Woods JR. Biparietal diameter/femur length ratio, cephalic index, and femur length measurements: not reliable screening techniques for Down syndrome. Obstet Gynecol 1990;75:186
- Rosati P, Guariglia L. Early transvaginal measurement of cephalic index for the detection of Down syndrome fetuses. Fetal Diagn Ther 1999;14:38–40.
- Buttery B. Occipitofrontal-biparietal diameter ratio. An ultrasonic parameter for the antental evaluation of Down syndrome. Med J Aust 1979;2(12):662–4.
- Bahado-Singh RO, Wyse L, Dorr MA, Copel JA, O’Connor T, Hobbins JC. Fetuses with Down syndrome have disproportionately shortened frontal lobe dimensions on ultrasonographic examination. Am J Obstet Gynecol 1992;167:1009–14.
- Winter TC, Reichman JA, Luna JA, Cheng EY, Doll AM, Komarniski CA, et al. Frontal lobe shortening in second-trimester fetuses with trisomy 21: usefulness as an US marker. Radiology 1998;207(1):215–22.
- Winter TC, Ostrovksy AA, Komarniski CA, Uhrich SB. Cerebellar and frontal lobe hypoplasia in fetuses with trisomy 21: usefulness as combined US markers. Radiology 2000;214(2):533–8.
- Nicolaides KH, Salvesen DR, Snijders RJ, Gosden CM. Strawberry-shaped skull in fetal trisomy 18. Fetal Diagn Ther 1992;7(2):132–7.
- Borrell A, Costa D, Martinez JM, Puerto B, Carrio A, Ojuel J, Fortuny A. Brachycephaly is ineffective for detection of Down syndrome in early midtrimester fetuses. Early Human Dev 1997;47:57–61.
- Van den Hof MC, Nicolaides KH, Campbell J, Campbell S. Evaluation of the lemon and banana signs in one hundred thirty fetuses with open spina bifida. Am J Obstet Gynecol 1990;162(2):322–7.
- Geipel A, Germer U, Welp T, Schwinger E, Gembruch U. Prenatal diagnosis of single umbilical artery: determination of the absent side, associated anomalies, Doppler findings and perinatal outcome. Ultrasound Obstet Gynecol 2000;15:114–7.
- Murphy-Kaulbeck L, Van den Hof M. Single umbilical artery (SUA) and fetal aneuploidy. Ultrasound Obstet Gynecol 2002;20(Suppl1):67.
- Vintzileos AM, Campbell WA, Guzman ER, Smulian JC, McLean DA, Ananth CV. Second-trimester ultrasound markers for detection of trisomy 21: which markers are best? Obstet Gynecol 1997;89:941–4.
- Deren O, Mahoney MJ, Copel JA, Bahado-Singh RO. Subtle ultrasonographic anomalies: do they improve the Down syndrome detection rate? Am J Obstet Gynecol 1998;178:441–5.
- Hall B. Mongolism in newborn infants. Clin Pediatr 1966;5:4.
- Golden JA, Hyman BT. Development of the superior temporal neocortex is anomalous in trisomy 21. J Neuropath Experiment Neurol1994;53(5):513–20.
- Lockwood C, Benacerraf B, Krinsky A, Blakemore K, Belanger K, Mahoney M, Hobbins J. A sonographic screening method for Down syndrome. Am J Obstet Gynecol 1987;157(4 Pt 1):803–8.
- Perry TB, Benzie RJ, Cassar N, Hamilton EF, Stocker J, Toftager-Larse K, Lippman A. Fetal cephalometry by ultrasound as a screening procedure for the prenatal detection of Down syndrome. Br J Obstet Gynaecol 1984;91(2):138–43.
- Nicolaides KH, Salvesen DR, Snijeders RJ and Gosden CM: Strawberry-shaped skull in fetal trisomy 18. Fetal Diagn Ther. 1992;7(2):132-7.
-
Schmidt-Sidor B, Wisniewski KE, Shepart TH, Sersen EA. Brain growth in Down syndrome subjects 15 to 22 weeks of gestational age and birth to 60 months. Clin Neuropathol 1990;9(4):181–90.
- Aase JM, Wilson AC, Smith DW. Small ear in Down’s syndrome: a helpful diagnostic aid. J Pediatr 1973;82:845–7.
- Chitkara U, Lee L, Oehlert JW, Bloch DA, Holbrook RH Jr, El-Sayed YY, et al. Fetal ear length measurement: a useful predictor of aneuploidy? Ultrasound Obstet Gynecol 2002;19(2):131–5.
- Chitkara U, Lee L, El-Sayed Y, Holbrook RH, Bloch DA, Oehlert JW, et al. Sonographic ear length measurement in normal second-and third-trimester fetuses. Am J Obstet Gynecol 2000;183: 230–4.
- Shimizu T, Salvador L, Allanson J, Hughes-Benzie R, Nimrod C. Ultrasonographic measurements of fetal ear. Obstet Gynecol 1992;80:381–4.
- Birnholz JC, Farrell EE. Fetal ear length. Pediatrics 1988;81:555–8.
- 8. Persutte W, Hobbins J. Single umbilical artery: a clinical enigma in modern prenatal diagnosis. Ultrasound Obstet Gynecol 1995;6:216–29.
- 9. Van den Hof M, Murphy-Kaulbeck L. Single umbilical artery (SUA) and risk of congenital heart disease (CHD). Ultrasound Obstet Gynecol 2002;20(Suppl1):83.
- 10. Van den Hof MC, Demianczuk NN. Content of a complete obstetrical ultrasound report. J Soc Obstet Gynaecol Can 2001;23(5):427–8.
- Rinehart BK, Terrone DA, Taylor CW, Isler CM, Larmon JE, Roberts WE. Single umbilical artery is associated with an increased incidence of structural and chromosomal anomalies and growth restriction. Am J Perinatol 2000;17(5):229–32.
- 4. Pierce BT, Dance VD, Wagner RK, Apodaca CC, Nielsen PE, Calhoun BC. J Matern Fetal Med 2001;10:59–63.
- Farrell T, Leslie J, Owen P. Accuracy and significance of prenatal diagnosis of single umbilical artery. Ultrasound Obstet Gynecol 2000;16:667–8.
- Abuhamad AZ, Shaffer W, Mari G, Copel J, Hobbins J, Evans A. Single umbilical artery: does it matter which artery is missing? Am J Obstet Gynecol 1995;173:728–32.