Introduzione:
All’esame ecografico, in fase follicolare, la cavità endometriale presenta in scansione longitudinale un tipico aspetto «a goccia» con apice in basso, in corrispondenza della cervice. Nelle scansioni trasversali, invece, l’endometrio assume un aspetto a doppia ellissoide fuse a “T” in modo da presentare tre apici rivolti rispettivamente verso la cervice e i due corni uterini (2).
In letteratura finora sono stati descritti 4 tipi di IUS (intrauterine signal) osservati durante un normale ciclo spontaneo fisiologico (2,3,4).
IUS tipo I°: mucosa fine e lineare, ipoecogena (fase proliferativa iniziale); essa cresce progressivamente fino a raggiungere lo spessore di 6-7 mm al 13°-14° giorno.
IUS tipo II°: mucosa spessa, ipoecogena, senza reazione edematosa periferica (fase proliferativa avanzata); Imaging a tre linee, però la differenza di ecogenicità fra le tre linee che circondano l’endometrio e l’endometrio stesso non è così fortemente accentuata come per il seguente tipo II°; e le due linee esterne sono un pò frastagliate.
Tipo III°: è caratteristico della fase follicolare avanzata, immediatamente pre-ovulatoria. Presenta un’immagine a tre linee ben marcate, senza soluzione di continuità e iperecogene rispetto al tessuto miometriale.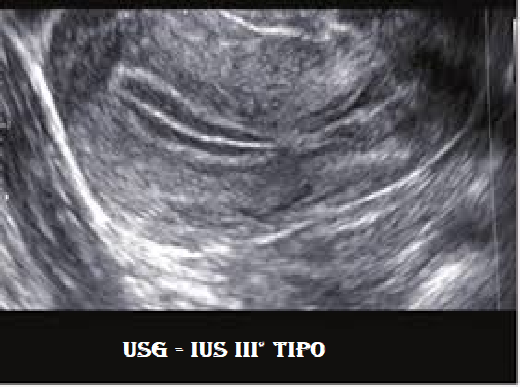
IUS tipo IV°: sotto l’azione del progesterone l’endometrio raggiunge il suo massimo spessore (12-18 mm); l’aumento dello spessore è dovuto in gran parte all’accumulo di secreto nelle ghiandole endometriali. All’eco mediano si sostituisce un tappeto uniformemente iperecogeno che erode gradualmente l’immagine a tre linee del IIIº tipo e produce la tipica configurazione a «racchetta». Tale immagine iperecogena può essere circondata da un’ampia zona ipoanecogena (ciò che ha indotto in errore molti AA. che hanno classificato il IV° tipo come ipoecogeno), che nelle sezioni trasversali configura la classica immagine a occhio di bue «bull’s eye» della fase luteale (4). L’alone ipo-anecogeno è determinato dalle secrezioni endometriali, dalla dilatazione ghiandolare e dalla presenza di glicogeno (1).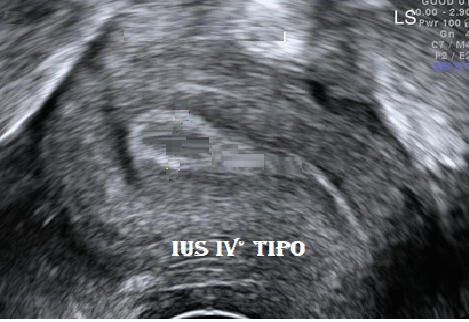
Tale classificazione è stata successivamente trasferita nella descrizione del pattern endometriale dei cicli PMA. In un nostro studio presentato nel 1985 al Congresso SIFES di Firenze, abbiamo presentato una nostra originale classificazione riferita ai cicli di COH (Controlled Ovarian Hyperstimulation) per PMA. In essa abbiamo aggiunto due ulteriori tipi di pattern endometriale frequentemente osservati nei cicli COH: Nelle nostre osservazioni USG di IUS in cicli PMA ci siamo imbattuti in immagini che non rientravano in nessuno dei quadri classicamente descritti e che quindi hanno richiesto una classificazione più ampia aggiungendo altri due tipi di IUS: il V° e il VI°.
IUS tipo V°: Il tipo V° rappresenta un endometrio iperecogeno, luteale, simile al tipo IV° ma
è amorfo senza la tipica rappresentazione ad “occhio di bue” del IV° tipo; è riscontrato, in fase luteale, solitamente in sostituzione del IV° tipo, nelle pazienti del 3° gruppo (anovulatorio) e nelle pazienti «poor responders» in cicli di stimolazione ovarica controllata (COH).
IUS tipo VI°, “lacunare”: appare come un’immagine iperecogenica “a goccia” con l’apice rivolto in basso e rappresenta un endometrico marcatamente iperplastico, iperluteinizzato. Detto anche IUS «lacunare» per un ampio alone ipoecogeno centrale riferibile alle abbondanti secrezioni endometriali periovulatorie conseguenti allo stato di iperestrogenismo. Esso compare nel 1° gruppo (ovulatorio) e nel 2° gruppo (gravidico) e mai nel 3° gruppo (anovulatorio). Si presenta nell’immediato periodo post-ovulatorio e spesso sostituisce il IV° tipo di IUS luteale. E’ caratteristico dei cicli di iperstimolazione ovarica da gonadotropine esogene nelle pazienti «high responders». Si ritrova nei casi di iperstimolazione ovarica severa (OHSS) che spesso insorge nelle pazienti PCOS sottoposte a COH. 
Materiali e metodo:
Sono state sottoposte ad indagine ecografica randomizzata 560 pazienti affette da sterilità primaria da cause varie (tab. 1) e inserite in protocolli di stimolazione ovarica controllata (COH) per tecniche di procreazione medica assistita (PMA) (tab 2).
Le pazienti presentavano un’età media di 29,5 anni con un minimo di 23 ed un massimo di 42 anni.
| Tab. 1 INDICAZIONI PER LA COH: |
| 1. Patologia tubarica 68% |
| 2. Endometriosi 18% |
| 3. Difetti della crescita follicolare 15-20% |
| 4. Difetti della fase luteinica 20-40% |
| 5. Sterilità idiopatica 30-47% |
| 6. Fattore maschile: dispermia e/o presenza di anticorpi antisperma (ASA) 45% |
| 7. Sterilizzazione tubarica 3.46% |
| tab. 2 – tecniche PMA |
| 1. rapporti mirati |
| 2. inseminazione artificiale |
| 3. FIVET |
| 4. ICSI |
Le scansioni USG sono state effettuate da 2 operatori utilizzando ecografi multidisciplinari Ansaldo Au 450 e Toshiba entrambi dotati di un trasduttore endovaginale da 6.5 MHz e di sonda convex da 3.5 MHz per le scansioni addominali. Il monitoraggio ecografico è stato effettuato dal 5º al 28° giorno del ciclo. Lo spessore ed il tipo dello IUS è stato valutato misurando la distanza fra l’interfaccia endometrio-miometrio anteriore e posteriore in scansione uterina longitudinale, ricercando il punto di maggiore ampiezza. Nelle pazienti non sottoposte a stimolazione ovarica la cavità uterina è uno spazio virtuale mentre nei cicli PMA lo spazio intracavitario non è più virtuale, ma presenta un’ampiezza talvolta notevole e rientra nella valutazione quantitativa e qualitativa dello IUS (14).
Risultati:
Tutte le pazienti, in base ai risultati ottenuti, sono state suddivise in 3 gruppi principali:
1º gruppo: 264 pazienti (47,14%) che hanno presentato ovulazione ma non gravidanze;
2º gruppo: 146 pazienti (26,08%) che hanno ovulato e sono rimaste gravide;
3° gruppo: 150 pazienti (26,78%) che non hanno ovulato ed ovviamente .non sono rimaste gravide.
Per ognuno di tali gruppi sono stati valutati il tipo (graf.1,2,3) e lo spessore dello IUS (graf. 4,5,6).
Nel 1° gruppo lo IUS si presenta del tipo I-II dal 3° all’8° giorno con evoluzione al tipo II-III° nell’8-10º giorno e al tipo III (trilineare) nel 10-14° giorno e quindi al tipo IV° dal 14 al 20° giorno. Si assiste sempre alla comparsa dello IUS di tipo V dal 21º al 26° giorno. Nel 1° gruppo, e ancor di più nel 2° gruppo, è presente IUS di tipo VI° «lacunare» nei casi di iperstimolazione ovarica (OHSS) fino a poterne essere considerato fattore predittivo.
Nel 2° gruppo si assiste ad un’evoluzione del tipo di IUS con graduale trasformazione dello IUS dal tipo lineare (tipo 1) a quello proliferativo (II-III) fino a quello pre-ovulatorio (III° tipo) a tre linee ben marcate (“a chicco di caffè” o “ring sign”) e con thickness che evolve gradualmente da 1-2 mm fino a 9-12 mm in fase pre-ovulatoria. Inoltre nel 2° gruppo (gravidico) non si assiste alla trasformazione in tipo V (desquamativo); il tipo IV° («bull’s eye») persiste per tutto il periodo luteale anche se talvolta può essere presente il tipo VI° in caso di iperstimolazione severa (OHSS).
Nel 3° gruppo, anovulatorio, si nota un’onda corta di trasformazione; nel senso che difficilmente in esso sono presenti più di tre tipi di IUS. Infatti in questo gruppo è caratteristica la persistenza del tipo I anche nella fase follicolare avanzata (11-15° giorno) e la scarsa presenza del tipo IV (grafico 1), mentre compare precocemente il tipo V ad indicare la mancata maturazione endometriale.
Nel grafico 2 son rappresentate le variazioni del thickness dello IUS rispettivamente nei cicli ovulatori, con gravidanze e anovulatori. Ad una osservazione comparativa risalta immediatamente una differenza nella curva di accrescimento dello spessore dell’endometrio che nel 1° gruppo, cicli ovulatori non gravidici, cresce gradualmente per innalzarsi a picco dal 13º al 17º giorno da un valore di 10 mm a 21 mm; lo spessore dello IUS discende quindi fino a 13 mm nella fase luteale, mantenendosi pressocchè costante fino ai giorni immediatamente precedenti il flusso mestruale. Nei cicli con gravidanza, invece, l’aumento dello spessore endometriale è più graduale e continuo da una media di 6,7 mm del 3° giorno a 10 mm del 13° giorno; raggiunge un picco di 19 mm al 16º giorno e si mantiene a livelli lievemente inferiori ma costanti per tutto il periodo luteale. Lo spessore dello IUS dei cicli anovulatori parte da un livello medio nettamente inferiore rispetto a quello dei cicli ovulatori e gravidici (5,8 mm vs. 9,8 e 6,7 mm rispettivamente), ha una stentata crescita nel periodo follicolare raggiungendo al 16° giorno un plateau di appena 13 mm che resta immutato fino al 21° giorno; dal 21° giorno inizia un bizzarro ed inaspettato picco di crescita che raggiunge i 21 mm al 25º giorno quando inizia una brusca diminuzione fino al termine del ciclo.
Discussione:
Il diametro medio dello IUS nei cicli con gravidanza è superiore a quello dei cicli ovulatori senza gravidanza e molto di più rispetto ai cicli anovulatori (11,89 mm vs. 11,26 vs. 7,60 mm rispettivamente). Nel gruppo con gravidanza mancano quelle brusche variazioni di valori evidenti nel gruppo dei cicli ovulatori semplici e soprattutto nel gruppo anovulatorio. In quest’ultimo non deve sorprendere il picco tardo luteale, evidente nel grafico n. 2, attribuibile all’attività steroidogenetica dei piccoli follicoli giunti a tardiva, e comunque incompleta, maturazione nella tarda fase luteale. Questo atteggiamento è tipico delle ovaie policistosiche.
Conclusioni:
La valutazione USG del tipo e dello spessore dello IUS nei programmi PMA é un utilissimo mezzo di indagine, non costoso, di facile interpretazione per un ecografista esperto da inserire come elemento di valutazione insieme al numero e al diametro follicolare nel monitoraggio dei programmi PMA.
Lo spessore e le variazioni maturative dell’endometrio, valutati al giorno della somministrazione di HCG, sono positivamente correlati con i livelli di estradiolo e del numero di ovociti con diametro >15 mm. Il trattamento con clomifene altera queste valutazioni.
Le migliori percentuali di PR sono correlate alla presenza di IUS del 3° tipo e del diametro di 9-12 mm al giorno della somministrazione di HCG.
Inoltre, la valutazione del thickness endometriale è l’unico elemento che consente di adeguare in tempo reale la posologia della supplementazione farmacologica dopo l’ovulazione. Il PR può incrementare, e le gravidanze biochimiche evitate, se la supplementazione con HCG è effettuata quando il thickness endometriale è ≥9 mm ed ≤14 mm in periodo peri-ovulatorio.
Bibliografia
- Volpicelli V., Volpicelli T, Dale B: “IUS in cicli indotti: fattore predittivo per outcome gravidico”. Giornale SIFES;1998;5,2:53-56
- Rashidi BH, Sadeghi M, Jafarabadi M, Tehrani Nejad ES.: Relationships between pregnancy rates following in vitro fertilization or intracytoplasmic sperm injection and endometrial thickness and pattern. Eur J Obstet Gynecol Reprod Biol. 2005 Jun 1; 120(2):179-84.
- Heger A, Sator M, Pietrowski D.: Endometrial Receptivity and its Predictive Value for IVF/ICSI-Outcome. Geburtshilfe Frauenheilkd. 2012 Aug; 72(8):710-715.
- Mercé LT, Barco MJ, Bau S, Troyano J.: Are endometrial parameters by three-dimensional ultrasound and power Doppler angiography related to in vitro fertilization/embryo transfer outcome? Fertil Steril. 2008 Jan; 89(1):111-7. Epub 2007 Jun 6.
- R.P. Dickey, T.T. Olar, D.N. Curole, S.N. Taylor and P.H. Rye: Endometrial pattern and thickness associated with pregnancy outcome after assisted reproduction technologies. Human Reproduction Volume 7, Issue 3 Pp. 418-421.
- Hershko-Klement A, Tepper R. Ultrasound in assisted reproduction: a call to fill the endometrial gap. Fertil Steril. 2016 Jun; 105(6):1394-1402.e4. Epub 2016 Apr 29.
- Jing Zhao, Qiong Zhang and Yanping Li: The effect of endometrial thickness and pattern measured by ultrasonography on pregnancy outcomes during IVF-ET cycles. Reproductive Biology and Endocrinology 2012 10:100
- Barker MA, Boehnlein LM, Kovacs P, Lindheim SR: Follicular and luteal phase endometrial thickness and echogenic pattern and pregnancy outcome in oocyte donation cycles. J Assist Reprod Genet. 2009, 26: 243-249. 10.1007/s10815-009-9312-z.
- McWilliams GD, Frattarelli JL: Changes in measured endometrial thickness predict in vitro fertilization success. Fertil Steril. 2007, 88: 74-81. 10.1016/j.fertnstert.2006.11.089.
- Amir W, Micha B, Ariel H, Liat LG, Jehoshua D, Adrian S: Predicting factors for endometrial thickness during treatment with assisted reproductive technology. Fertil Steril. 2007, 87: 799-804. 10.1016/j.fertnstert.2006.11.002.
- Richter KS, Bugge KR, Bromer JG, Levy MJ: Relationship between endometrial thickness and embryo implantation, based on 1,294 cycles of in vitro fertilization with transfer of two blastocyst-stage embryos. Fertil Steril. 2007, 87: 53-59. 10.1016/j.fertnstert.2006.05.064.
- Zhang XQ, Chen CH, Confino E, Barnes R, Milad M, Kazer RR: Increased endometrial thickness is associated with improved treatment outcome for selected patients undergoing in vitro fertilization-embryo transfer. Fertil Steril. 2005, 83: 336-340. 10.1016/j.fertnstert.2004.09.020.
- Kovacs P, Matyas S, Boda K, Kaali SG: The effect of endometrial thickness on IVF/ICSI outcome. Hum Reprod. 2003, 18: 2337-2341. 10.1093/humrep/deg461
- Basir, G.S., O, W.S., So, W.W., Ng, E.H., and Ho, P.C. Evaluation of cycle-to-cycle variation of endometrial responsiveness using transvaginal sonography in women undergoing assisted reproduction. Ultrasound Obstet. Gynecol. 2002; 19: 4844–4889
- Chen SL, Wu FR, Luo C, Chen X, Shi XY, Zheng HY, Ni YP. Combined analysis of endometrial thickness and pattern in predicting outcome of in vitro fertilization and embryo transfer: a retrospective cohort study. Reprod Biol Endocrinol. 2010 Mar 24; 8:30. Epub 2010 Mar 24.
- Al-Ghamdi, A., Coskun, S., Al-Hassan, S., AL-Rejjal, R., and Awartani, K. The correlation between endometrial thickness and outcome of in vitro fertilization and embryo transfer (IVF-ET) outcome. Reprod. Biol. Endocrinol. 2008; 6: 37
-
Catizone F.A., Ianniruberto A.: Ecografia Transvaginale Testo Atlante,Edizioni C.I.C. Roma ottobre 1992.
- DUffiel S., Picker R-: Ultrasonic evaluation of the uterus in the normal menstrual cycle. Med. Ultrasaund, 5, 70-75, 1981.
- Fleischer A.C., Kalemeris G., Entman S-: Sonographic depiction of the endometrium during normal cycles. I. Ultrasound Med. Biol. 12,271-276, 1986.
- Johanisson E. Parker RR. A., Landgren B.M. DiciPalusy E.: morphometric analysis of the human endometrium in relation of peripherai hormone levels. Pertil. Steril. 38, 564-568, 1982.
- Slangen T., van Herendael B.J., Verheugen C.: The assessment of the endometrium by intravaginal ultrasound in stimulated cycles in IVF. VI World Congress In Vitro Fertilization and Alternative Assisted Reproduction, April 2-7, 1989, ierusalem,Israel, Abstracta; @.67.
- Prietl G., Welker B.,GembruchU., et al.: endosonography of the endometrium with respect to IVF outcome. VI World Congress In Vitro and Assisted Reproduction, April 2-7, 1989, ierusalem,Israel, Alstracts, p. 108.
- Isacov D. Boldes R. Thaler I., et al.: Transvaginal ultrasonographic assessment of the endometrium and the prediction of implantation after embryo transfer in IVF patients. VI World Congress In Vitro Fertilization and Alternative Assisted Reproduction, April 2-7, 1989, Ierusalem, Isarel, Abstracts, p. 133.
- Gonen Y. Casper R.F.: Endometrial thickness and growth during ovarian stimulation: A possibie predictor of implantation in vitro fertilization. 45th Annual Meeting of The American Fertility Society, November 13-16, 1989,San Francisco. Abstracts S141.
- Gonen Y. Casoer R.F.: prediction of impiantation by the sonographic appearance of the endometrium durin controlled ovarian stimulation for in – vitro fertilization. J. in vitro Fert Embryo transf 7 (3): 146-152 1990.
- Forrest T.S. ELYDERANI M.K. MUILEMBERG M.I.: Cyclic endometrial change:USassesment with histologic correlation. Radiology 167: 233 1988.
- LI T.C. DOKERY P., ROGERS A.W. COOKE I.D.: A quantitative study of endometrial development in the luteal phase: comparison between women with unexplained infertility and normal fertility. Br. J. Obstet. Gynaecol. 97; 576-82, 1990.
- Callen P.W., De Martini W.J., Filly R.A.: The central uterine cavity echo: a useful anatomic signe in the ultrasonographic evaluation of the femal pelvis. Radiology 131, 187, 1979.
- Sakamoto C., Makano H.: The ecogenic endometrium and alteration during menstrual cycle- Int. J. Gynecol. Obstetr. 20, 255, 1982.
- Ohno Y, Fujimoto Y.: Endometrial oestrogen and progesterone receptors and their relationship to sonographic appearance of the endometrium. Hum Reprod Update. 1998 Sep-Oct; 4(5):560-4.





1 commento
Helo friends, hhow is all, and what yoou desie tto sayy regarding thhis piec of
writing, inn my iew its truly remarkable in fqvor off me.