INTRODUZIONE
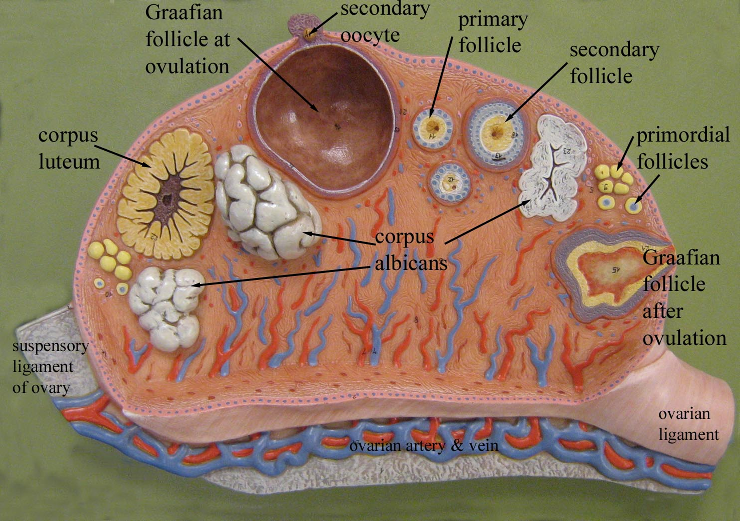
Il corpo luteo (CL) è stato per la prima volta descritto da Marcello Malpighi (1628-1694) e accuratamente studiato da Regnier de Graaf (1641-1673). E’ la formazione ovarica che origina dall’evoluzione del follicolo dopo lo scoppio ovulatorio. L’ovulazione fisiologica, visibile alla scansione ecografica, corrisponde alla deiscenza del liquido follicolare, dell’ovocita, della zona pellucida, della corona radiata e di un numero  considerevole di cellule del cumulus ooforo.
considerevole di cellule del cumulus ooforo.
Possono verificarsi anomalie dell’ovulazione come la cosiddetta LUF-Syndrome (Luteinized Unrupted Follicle Syndrome) in cui non avviene lo scoppio del follicolo che va incontro a luteinizzazione con all’interno il suo ovocita dotato di buone caratteristice morfologiche e un buon indice di fecondazione e cleavage in vitro. Altre volte il follicolo matura e scoppia normalmente ma si presenta vuoto, senza ovocita (Empty Follicle). Altre volte ancora il follicolo, normalmente maturo e scoppiato, non espelle l’ovocita per problemi meccanici e/o flogistici (1).
ASPETTO MACROSCOPICO DEL CORPO LUTEO:
L’aspetto macroscopico del corpo luteo maturo non è sempre lo stesso e nemmeno le sue  dimensioni che variano dai 10 ai 20 mm di diametro. All’osservazione laparascopica il corpo luteo (CL) appare come una fomazione rotondeggiante, raggrinzita e festonata, cistica, che talvolta assume un aspetto polipoide. Il suo colore roseo-giallastro sembra luccicare
dimensioni che variano dai 10 ai 20 mm di diametro. All’osservazione laparascopica il corpo luteo (CL) appare come una fomazione rotondeggiante, raggrinzita e festonata, cistica, che talvolta assume un aspetto polipoide. Il suo colore roseo-giallastro sembra luccicare  attraverso l’epitelio ovarico che lo ricopre. In altri casi, il corpo luteo può trovarsi qualche centimetro al di sotto della superficie ovarica ed essere rilevabile solo mediante la sezione dell’ovaio. La cavità può essere piccola con un modesto contenuto liquido, o può presentarsi molto ampia e distesa con un liquido giallastro (inclusioni lipidiche) dal quale deriva il nome: “corpo giallo”.
attraverso l’epitelio ovarico che lo ricopre. In altri casi, il corpo luteo può trovarsi qualche centimetro al di sotto della superficie ovarica ed essere rilevabile solo mediante la sezione dell’ovaio. La cavità può essere piccola con un modesto contenuto liquido, o può presentarsi molto ampia e distesa con un liquido giallastro (inclusioni lipidiche) dal quale deriva il nome: “corpo giallo”.
Il corpo luteo presenta 4 stadi di sviluppo:
1. proliferazione
2. vascolarizzazione
3. maturazione
4. regressione
1. Stadio proliferativo: Nello stadio proliferativo, quando il follicolo maturo di Graaf si rompe, vengono liberati l’ovocita, il liquido follicolare ed una parte considerevole della granulosa circostante. Le pareti collassate del follicolo svuotato formano convoluzioni attorno alla cavità ripiena di sangue. Le cellule della parete follicolare, sia della granulosa che tecali, iniziano la trasformazione strutturale e funzionale in cellule luteiniche.
2. Stadio di vascolarizzazione: inizialmente sono presenti numerose ampie lacune contenenti sangue stravasato ma nessun vaso sanguigno essendone sprovvisto il follicolo nella porzione contenente le cellule della granulosa a loro volta ben separate da una membrana basale dalla zona tecale ben irrorata da una vasta rete sinusoidale (1). Dopo l’iniziale emorragia, i gettoni endoteliali provenienti dai vasi tecali, penetrano nella granulosa  e nella cavità emorragica del follicolo nelle 48-72 ore successive all’ovulazione. Di norma è presente un anello ben evidente di vascolarizzazione che segue il percorso della struttura vasale che circondava il primo follicolo pre-ovulatorio e che diventa ancora più evidente con il progredire della maturazione del corpo luteo. All’esame Energy doppler, è possibile mettere in evidenza il caratteristico “anello di fuoco”, e l’esame Doppler rivela un flusso diastolico predominante; non si osserva vascolarizzazione endocistica (2). L’aspetto ad “anello di fuoco” è secondario all’aumentata vascolarizzazione periferica e risulta un segno aspecifico, poiché può esser visto allo stesso modo in un follicolo del Graaf maturo.
e nella cavità emorragica del follicolo nelle 48-72 ore successive all’ovulazione. Di norma è presente un anello ben evidente di vascolarizzazione che segue il percorso della struttura vasale che circondava il primo follicolo pre-ovulatorio e che diventa ancora più evidente con il progredire della maturazione del corpo luteo. All’esame Energy doppler, è possibile mettere in evidenza il caratteristico “anello di fuoco”, e l’esame Doppler rivela un flusso diastolico predominante; non si osserva vascolarizzazione endocistica (2). L’aspetto ad “anello di fuoco” è secondario all’aumentata vascolarizzazione periferica e risulta un segno aspecifico, poiché può esser visto allo stesso modo in un follicolo del Graaf maturo.
3. Stadio di maturazione: 4 giorni dopo l’ovulazione, le cellule del corpo luteo hanno raggiunto la loro massime dimensione ed hanno completato la loro trasformazione in cellule luteiniche. Se è presente una cavità centrale, si distingue uno strato di tessuto connettivo ben distinto che contorna tipicamente la cavità del corpo luteo. In assenza di cavità centrale, al centro del corpo luteo è generalmente presente una sottile linea iperecogena da riferire alla coagulazione dello stravaso ematico tecale.
4. Stadio di regressione: durante la luteolisi si verificano due eventi strettamente correlati: la perdita della capacità di sintetizzare e secernere progesterone (49) e le variazioni involutive fino alla morte delle cellule che compongono il corpo luteo (50). Al 23º giorno del ciclo mestruale nel corpo luteo compaiono i fenomeni involutivi caratterizzati dalla connettivizzazione del coagulo centrale, rimozione del pigmento ematico da parte dei leucociti, degenerazione grassa e fibrosi dellle cellule parietali ed infine dalla ialinizzazione della zona luteinica con aumento del tessuto cicatriziale all’interno della cavità. Il rilascio di PGF2α luteale costituisce il “drilling” della luteolisi. Infatti le variazioni involutive della cellule luteiniche diventano evidenti 24-36 ore dopo l’esposizione a PGF2α (57). Questa prostaglandina agisce essenzialmente provocando intensa vasocostrizione mediante sovraespressione di endotelina-1 e conseguente ipotrofia, ipossia e mortedelle cellule luteiniche (51-56). Inoltre la PGF2α attiva la Fosfolipasi C che catalizza l’idrolisi del fosfatidilinositolo e la liberazione del Ca+ dal reticolo endoplasmatico libero con effetto demolitivo sulla membrana cellulare ed apoptosi delle cellule luteiniche (71).
Il colore giallastro può persistere a lungo anche per molti mesi, ma infine scompare. Il prodotto finale è il corpus albicans che appare come una struttura biancastra, ialinizzata e convoluta che lentamente si riduce di dimensione (7).
Dal corpus albicans si distingue iI corpus fibrosum, prodotto di degenerazione delle piccole cisti funzionali (PCO), per le sue dimensioni inferiori e per la sottile parete fibrosa meno ialinizzata rispetto al corpus albicans.
Cellule immunitarie nella luteolisi: il sistema immunitario ricopre un ruolo critico nel processo luteolitico. La splenectomia in ratti determina concentrazioni elevate di progesterone nel siero e questo effetto è invertito mediante iniezione di splenociti (58). Durante la luteolisi il CL è invaso dai macrofagi che svolgono 4 principali funzioni: fagocitosi delle cellule in degenerazione (59-63), degradazione della matrice extracellulare (64,65), inibizione citochine-mediata della steroidogenesi e stimolazione della secrezione di PGF2α dal corpo luteo (66). Durante la luteolisi, i linfociti T infiltrano il corpo luteo e secernono interferone-γ (IFN-γ), che stimola la’espressione dei principali antigeni di istocompatibilità sulla superficie delle cellule luteali (67). L’interleuchina-1 (IL-1) prodotto da macrofagi, fibroblasti e cellule endoteliali (67) stimola la produzione di PGF2α da cellule coltivate luteale. Il fattore di necrosi tumorale-α (TNF-α), prodotto da macrofagi, inibisce la secrezione di progesterone basale e stimola la secrezione PGF2α (68).
CORPO LUTEO GRAVIDICO:
Se l’ovocita viene fecondato, il corpo luteo non regredisce ma continua a svilupparsi sotto lo stmolo dell’HCG (prodotta dal sinciziotrofoblasto) divenendo  considerevolmente più grande del corpo luteo mestruale fino ad occupare talvolta un terzo o anche la metà del volume ovarico. Ma esiste una considerevole variabilità di volume e consistenza fra i corpi lutei gravidici alcuni dei quali sono a struttura prevalentemente solida. Le cellule luteiniche sono grandi e di aspetto simile a mattonelle, e le cellule paraluteiniche sono spesso numerose. Lo sviluppo massimo viene raggiunto alla 10-12ª settimana in corrispondenza con il picco dell’HCG(3-6). Alla fine della 16ª sett. di gestazione il corpo luteo gravidico incomincia a regredire. Al termine della gravidanza solitamente non è riscontrabile alcuna cavità luteinica. Tuttavia, il corpo luteo può essere ancora riscontrabile.
considerevolmente più grande del corpo luteo mestruale fino ad occupare talvolta un terzo o anche la metà del volume ovarico. Ma esiste una considerevole variabilità di volume e consistenza fra i corpi lutei gravidici alcuni dei quali sono a struttura prevalentemente solida. Le cellule luteiniche sono grandi e di aspetto simile a mattonelle, e le cellule paraluteiniche sono spesso numerose. Lo sviluppo massimo viene raggiunto alla 10-12ª settimana in corrispondenza con il picco dell’HCG(3-6). Alla fine della 16ª sett. di gestazione il corpo luteo gravidico incomincia a regredire. Al termine della gravidanza solitamente non è riscontrabile alcuna cavità luteinica. Tuttavia, il corpo luteo può essere ancora riscontrabile.
Istologia del corpo luteo: Il corpo luteo umano è composto da due tipi di cellule steroido-secernenti: le grandi cellule luteiniche o cellule luteiniche-granulosa e le piccole cellule luteiniche o cellule luteiniche-tecali (26,27). Nel follicolo le cellule della granulosa sono separate dalle cellule tecale ad opera di una membrana vasale. La granulosa sono sprovviste di vasi sanguigni presenti invece nella teca esterna ed interna. Con lo scoppio del follicolo avviene l’epulsione dell’ovocita, del liquido follicolare, cellule della corona radiata e la lacerazione dei vasi sinusoidali con invasione emorragica della cavità luteale neoformata.
La proliferazione delle cellule endoteliali sinusoidali si traduce in un’ampia rete capillare, requisito fondamentale per lo sviluppo del corpo luteo (30, 31). La neovascolarizzazione occupa il 22% del volume totale del corpo luteo (32), con un flusso sanguigno di 6-10 ml/grammo/minuto di tessuto luteale superando quello di molti altri tessuti. Inoltre, la maggior parte delle cellule luteale sono direttamente adiacenti capillari (59%) o adiacenti allo spazio interstiziale (37%) in prossimità di capillari (32). Tale giustapposizione di cellule luteale ai capillari provvede alle elevate esigenze metaboliche del corpo luteo, che consumano 2-6 volte più ossigeno per unità di peso che non il fegato, rene e cuore (33).
Le grandi cellule luteiniche, derivanti dalle cellule della granulosa e che pertanto occupano il centro  della ghiandola, sono stimolate dall’FSH a produrre estrogeni, aromatizzando i precursori androgeni provenienti sia da produzione propria che dalle adiacenti piccole cellule luteiniche, e contribuiscono alla produzione basale di progesterone.
della ghiandola, sono stimolate dall’FSH a produrre estrogeni, aromatizzando i precursori androgeni provenienti sia da produzione propria che dalle adiacenti piccole cellule luteiniche, e contribuiscono alla produzione basale di progesterone.
Le piccole cellule luteiniche, di derivazione tecale, e che occupano la zona più esterna del corpo luteo, sotto il controllo dell’LH producono progesterone ed androgeni che in parte vengono secreti in circolo ed in parte rappresentano il substrato per l’aromatasi delle grandi cellule luteiniche che li trasformano in estrogeni.
Oltre alle cellule steroidogeniche, il corpo luteo contiene cellule endoteliali, fibroblasti, periciti e cellule provenienti dal circolo ematico (26,27).
ENDOCRINOLOGIA DEL CORPO LUTEO:
Il corpo luteo si comporta come una ghiandola endocrina: secerne il progesterone ed altri ormoni necessari a predisporre l’utero alla gravidanza e a mantenere la gravidanza nei primi stadi di sviluppo ed impianto.
La secrezione del progesterone, come di tutti gli ormoni steroidei, ha come progenitore il colesterolo, sintetizzato dal fegato, indifferentemente in forma HDL o LDL che viene assorbito per endocitosi (34) nel citoplasma delle piccole cellule luteiniche. Ogni molecola di LDL contiene circa 2500 molecole di colesterolo. Le lipoproteine nel citoplasma subiscono un processo di esterificazione ed idrossilazione per ottenere il colesterolo libero che viene trasportato, con l’aiuto della proteina STAR (Steroidogenic Acute Regulator) attivata dall’LH (35-37), nei mitocondri dove è metabolizzato in pregnenolone. L’alcooò sopprime l’azione della START. Il pregnenolone è poi trasportato attraverso i microtubuli nel reticolo endoplasmatico liscio dove viene metabolizzato in progesterone (35). In condizioni di ipocolesterolemia, le cellule luteali soil sono in grado di sintetizzare colesterolo dall’acetato (38,39).
Le cellule steroidogeniche ovariche (granulosa e teca interna) nel loro citoscheletro possiedono gli enzimi necessari per la produzione di progesterone, androgeni ed estrogeni. Nel follicolo ovarico non luteinizzato, nello stroma prevale la via biosintetica dei 5-3-β-idrossisteroidi, che porta alla produzione di androgeni ed estrogeni, ma non di progesterone, mentre la via dei 4-3-chetosteroidi predomina nel corpo luteo (7). L’HCG stimola direttamente la secrezione di progesterone da parte delle piccole cellule luteniche (derivazione tecale) attraverso l’attivazione della proteinchinasi (7). Le grandi cellule luteiniche derivano dalle cellule della granulosa, sono capaci di produrre modeste quantità di estrogeni, androgeni e contengono recettori per la PGF2α . Quest’ultima stimolata dagli estrogeni sembra essere il fattore maggiormente interessato nell’azione luteolitica (7).
Numerose gravidanze si sono verificate nonostante la rimozione precoce del corpo luteo. Pratt ha riportato il proseguimento della gravidanza dopo un intervento di rimozione del corpo luteo eseguito al 20º giorno dopo l’ultimo ciclo mestruale, od intorno al periodo di impianto. In una serie di casi in cui il corpo luteo era stato rimosso nella prima fase di gravidanza, Hall ha riportato una percentuale di aborto leggermente superiore al 20%. Egli ha ritenuto che questo tasso non fosse superiore a quanto atteso dopo qualsiasi tipo di intervento addominale condotto nel primo trimestre di gravidanza. In un valido studio, Tulsk e Koff hanno rimosso il corpo luteo da 14 donne che avevano richiesto la sterilizzazione e l’aborto terapeutico. L’aborto spontaneo si è verificato solo in due casi; nei restanti casi, le gravidanze furono interrotte con dilatazione e raschiamento; 10 delle 14 donne hanno continuato a produrre normali quantità di pregnandiolo fino alla rimozione del feto.
Le modificazioni degenerative del corpo luteo di un ciclo non fertile vengono ritardate dalla somministrazione di gonadotropina corionica (HCG). Il corpo luteo secerne progesterone sotto lo stimolo dell’HCG prodotto dall’embrione; tuttavia, subito dopo l’impianto, la placenta umana produce quantità di progesterone sufficiente per mantenere la gravidanza. Perciò il corpo luteo, sebbene necessario (nella specie umana) per l’impianto, non è richiesto per la gravidanza dopo i primi stadi.
Controllo dell’attività endocrina del corpo luteo: l’attività endocrina del corpo luteo è modulata mediante un controllo di tipo centrale operato dall’ipofisi e mediante un controllo di tipo locale operato da sostanze secrete dallo stesso corpo luteo.
A LIVELLO CENTRALE:
- Azione dell’LH:
La secrezione steroidea luteale gode di un certo grado di autonomia; infatti i picchi secretori di estradiolo e progesterone non sono immediatamente preceduti da picchi di FSH o LH. Inoltre, la ghiandola luteale se espiantata e studiata in vitro continua a secernere progesterone in modo pulsatile. Tuttavia, l’importanza dell’azione di stimolo esercitata dall’LH, tramite la proteinchinasi A, a livello luteale sulla secrezione di progesterone è ampiamente provata. Infatti l’immunoneutralizzazione dell’LH nella scimmia induce un calo repentino dei livelli plasmatici di progesterone provocando rapida luteolisi. Allo stesso modo la somministrazione di antagonisti del Gn-RH nella fase luteale determina calo della produzione di progesterone, mentre la contemporanea somministrazione di HCG o HMG, consente il mantenimento della funzione luteale pure in assenza di gonadotropine endogene. Inoltre nel 1988 Veldhuis e coll. hanno dimostrato nella donna l’esistenza di una stretta correlazione tra picchi di LH e progesterone: un picco di LH precede di 10 minuti quello di progesterone.
- Azione dell’FSH sul corpo luteo:
L’azione dell’FSH in fase luteale si esplica prevalentemente a livello delle grandi cellule luteiniche stimolando l’aromatizzazione dei precursori androgeni in estrogeni; nè in vitro nè in vivo si è mai osservato alcun effetto apprezzabile dell’FSH sulla produzione di progesterone. Pertanto, l’azione dell’FSH sembra estrinsecarsi pressoché esclusivamente sulla produzione estrogenica.
- Azione della Prolattina sul corpo luteo:
La prolattina promuove la sintesi di specifiche proteine in diversi tessuti. L’iperprolattinemia è stata a lungo considerata un fattore causale di deficit della fase luteale (LPD) ma diversi studi effettuati su pazienti con LDP hanno rivelato anomalie significative della secrezione di HPRL. Perciò si ritiene che l’insufficiente secrezione luteale di progesterone sia da attribuire ad anomalie secretorie o strutturali delle gonadotropine (20). Altri AA. invece ritengono che a basse concentrazioni la prolattina risulta essere luteotrofica, mentre a dosi elevati è luteolitica (21-23).
Controllo intragonadico della secrezione ciclica di progesterone
- Eicosanoidi:
La somministrazione intraluteale in corso di laparascopia della PGF2α ha azione luteolitica diretta con accorciamento della fase luteale riducendo la sensibità delle cellule luteali all’azione di LH e HCG e inibendo l’epressione della proteina STAR. Studi recenti sul corpo luteo umano precoce, utilizzanti la metodica in vitro della microdialisi, suggeriscono una funzione stimolatoria della PGF2-alfa sulla produzione di progesterone, mediata da estrogeni e ossitocina. L’uso di inibitori della ciclo-ossigenasi, somministrati sia per via sistemica che locale, porta ad accorciamento della fase luteale. L’apparente paradosso si spiega se si considera che la ciclo-ossigenasi catalizza la sintesi di altri autacoidi con probabile azione luteotrofica quali la PGE2, la PGI2 e la PGD2 (antiaggreganti e vasodilatatori) che agiscono prevalentemente aumentando la quantità di cAMP e l’attivazione della proteinchinasi A (46-48). Gli effetti apparentemente contrastanti di PGF2-α e PGE2 sulla produzione di progesterone sembrano alla base di un equilibrio biochimico locale che può sostenere la funzione luteale o contribuire alla luteolisi (7). Questi dati sono corroborati dalla dimostrazione di una caduta del rapporto PGE2/PGF2α nel tessuto luteale umano attraverso le sue diverse fasi funzionali. Gli eicosanoidi prodotti attraverso la via della lipo-ossigenasi: acido idroperossi-eicosa-tetra-enoico e acido idrossi-eicosa-tetra-enoico inibiscono la produzione di progesterone, sia basale che HCG-stimolata in cellule luteali umane in vitro. E’ possibile quindi che la steroidogenesi luteale sia modulata localmente non solo dalle relative concentrazioni tissutali delle diverse prostaglandine, ma anche dall’equilibrio tra prodotti della ciclo e lipo-ossigenasi. la PGF2α dotata di azione luteolitica sembra essere quasi esclusivamente di origine ovarica mentre scarsa importanza sulla luteolisi sembra da attribuire alla la PGF2α di origine endometriale (24). L’azione luteolitica della PG F2α è mediata dalla protein-chinasi C, afflusso di calcio, l’attivazione di endonucleasi, e infime morte cellulare per apoptosi. In caso di gravidanza, l’azione dell’HCG contrasta gli effetti della PGF2α ed il corpo luteo si mantiene trofico e continua la secrezione di progesterone (24).
- Estrogeni:
Gli estrogeni hanno azione inibitoria sulla secrezione di progesterone dal corpo luteo. Alti livelli di estrogeni in fase luteinica hanno un’azione luteolitica stimolando la secrezione dell’ossitocina e amplificando la sensibilità dei recettori dell’ossitocina (OXT) a livello endometriale ed ovarico. Ciò spiega l’elevata percentuale di aborti nei cicli di CFM e soprattutto nelle OHSS dove i tassi di E2 sono generalmente molto alti.
Ma gli estrogeni, indirettamente, hanno anche una funzione luteotropo perchè essi, ed in particolare il 17-β-estradiolo, sono necessari per indurre la sintesi dei recettori per il progesterone (Pr). In assenza di Pr il progesterone non potrebbe mai esplicare la sua azione (25).
- Androgeni:
Per quanto riguarda gli androgeni un’azione diretta di questi sulla steroidogenesi luteale non è stata finora dimostrata; purtuttavia la presenza di recettori per gli androgeni nel corpo luteo di scimmia Rhesus suggerirebbe una regolazione da parte di questi per via autocrina e/o paracrina.
-
Progesterone:
la presenza di recettori per il progesterone nelle cellule luteali suggerisce che anche il progesterone, principale ormone prodotto del corpo luteo, potrebbe agire come regolatore luteotropo, in particolare contrastando la resintesi dei recettori per gli estrogeni (25).
- Ossitocina:
L”ossitocina (OXT) è un ormone peptidico a 9 aminoacidi sintetizzato nei nuclei ipotalamici sopraottico e paraventricolare e trasportatao nell’ipofisi posteriore. L’azione principale dell’ossitocina è quella di indurre le contrazioni uterine tramite la stimolazione della PGF2alfa. L’OXT è stata trovata anche nelle grandi cellule luteiniche in concentrazione maggiore rispetto a quella sierica. Inoltre, si è osservato che i livelli sierici dell’OXT calano rapidamente dopo la lutectomia ed è stata dimostrata l’espressione genica per l’ossitocina in corpi lutei umani. Tutto ciò porta a ritenere che questo mediatore sia prodotto e secreto dalle cellule luteali oltre che dalle cellule ipotalamo-ipofisarie (8,9). Le concentrazioni tissutali di ossitocina nel corpo luteo aumentano significativamente dalla fase luteale precoce alla fase medioluteale, per poi calare nella fase luteale tardiva, in stretto parallelo con i livelli plasmatici di progesterone in modo da creare un equilibrio fra azione miorilassante del progesterone e quella contratturante dell’ossitocina. Recenti studi in vivo sull’effetto diretto della somministrazione locale di ossitocina nel corpo luteo umano indicano un ruolo luteolitico dell’OXT, probabilmente mediato dalla sintesi locale di PGF2α (10,11,24).
-
Citochine e fattori di crescita
La somministrazione di interferone a donne con cicli regolari provoca una riduzione dei livelli plasmatici di progesterone senza alcun effetto sulle gonadotropine. Lo studio di colture di macrofagi o linfociti insieme a cellule della granulosa luteinizzate ha permesso di osservare come la secrezione di progesterone e di estradiolo possa essere influenzata da varie sostanze diffusibili, tra cui interferone, Interleukina-1 (IL-1) e Tumor Necrosis Factor (TNF).
Numerosi fattori di crescita sono attivati dall’azione della β-HCG. Essi sono dotati di attività mitogena e contribuiscono alla proliferazione delle cellule luteali e al mantenimento della steroidogenesi luteale con meccanismo autocrino o paracrino (28,29). Fra questi più importanti sembrano essere l’Epidermal Growth Factor (EGF), l’Insulin Like Growth Factor (IGF), e il Vascular Endothelial Growth Factor (VEGF) (8).
L’Insulin Like Growth Factor (IGF) esplica la sua azione luteotropa inibendo la morte cellulare, e stimolando i recettori dell’insulina a livello del corpo luteo (40-44).
Il GH invece agisce stimolando la tirosin-chinasi (JAK 2) e consentendo quindi la fosforilazione delle proteine per consentire il trasferimento di fosfato da una proteina ad un’altra. Inoltre il GH aumenta l’epressione locale di prolattina e IGF-I (46).
ASPETTI ECOGRAFICI DEL CORPO LUTEO:
Con l’ecografia transaddominale l’ovaio si identifica tipicamente alla sua posizione e forma, con l’ecografia transvaginale le ovaie si possono studiare molto più dettagliatamente nella loro architettura e si possono facilmente evidenziare piccoli follicoli in via di sviluppo e il corpo luteo nella sua trasformazione (11).
L’architettura interna dell’ovaio è differenziabile da quella uterina o da masse del miometrio che possono simulare occasionalmente l’ovaio. Le dimensioni dell’ovaio possono variare significativamente in relazione all’età. Ovaie di 3-4 cm di lunghezza possono essere evidenziate nelle donne con ciclo mestruale normale e, se di morfologia regolare, possono essere considerate normali.Il corpo luteo può confondere anche il più esperto ecografista a causa dell’elevata variabilità delle sue caratteristiche ecografiche; esso può, infatti, mimare molte delle patologie ovariche. Le naturali evoluzione ed involuzione del corpo luteo implicano significativi cambiamenti macroscopici facilmente rilevabili con l’ecografia transvaginale. Dopo l’ovulazione la parete follicolare diventa irregolare e il follicolo “si sgonfia” in meno di 1 minuto. Si osserva un iniziale rapido rilascio di liquido seguito da un successivo lento rilascio in 30′ circa. Entro 1 ora dall’ovulazione si sviluppa un corpo emorragico. La combinazione di sangue coagulato e di contenuto liquido può apparire come un’area ecogena frastagliata ed irregolare all’interno di una grande cisti con aspetto sferico, multiloculare che si estende attraverso la superficie ovarica oppure può apparire come sottilissimi setti che attraversano la cisti. Per confermare la diagnosi potrebbe essere necessario eseguire una seconda ecografia durante la fase follicolare del ciclo mestruale successivo, quando la struttura sotto esame dovrebbe essersi ridotta di dimensioni. Il corpo luteo di recente formazione solitamente appare come una struttura ipoecogena con una parete irregolare e può contenere alcuni echi interni corrispondenti alla parte emorragica (12). Poiché il corpo luteo si sviluppa 4-8 giorni dopo l’ovulazione, esso appare come un’area iperecogena di circa 15 mm. Tuttavia, il corpo luteo varia notevolmente in dimensioni ed in ecogenicità. L’emorragia all’interno del corpo luteo può simulare una massa solida o complessa nonostante la correlazione tra dimensioni del follicoli e di estradiolo durante la fase follicolare (13). non è stata dimostrata alcuna relazione tra dimensioni del corpo luteo e livelli di progesterone durante la fase luteinica del ciclo mestruale (14).
La presenza di liquido libero nel peritoneo (falda liquida nel Douglas) è indice di avvenuta ovulazione, particolarmente se un follicolo evidenziato in precedenza risulta collassato. Tuttavia, la quantità di liquido osservato nel perineo eccede significativamente la quantità di liquido realmente liberata dalla rottura del follicolo. Inoltre, le donne con cicli anovulatori all’ecografia possono presentare livelli di liquido peritoneale sovrapponibili a quelli delle donne con cicli ovulatori. Queste ed altre evidenze sostengono l’ipotesi che il liquido peritoneale derivi prevalentemente da secrezioni ovariche sotto il controllo ormonale e non dal liquido follicolare (15-20).
ECOGRAFIA DOPPLER
L’ecografia Doppler offre la possibilità di studiare le modalità del flusso ematico e quindi permette di identificare le variazioni funzionali. L’ecografia transvaginale fornisce immagini di migliore risoluzione rispetto all’ecografia transaddominale, principalmente per la migliore conservazione del fascio ultrasonico e per l’impiego di frequenze più alte. Si era ritenuto che l’approccio transvaginale dell’ecografia Doppler potesse offrire gli stessi vantaggi ottenuti con l’ecografia tradizionale e, infatti, attualmente viene utilizzata questa metodica. L’uso del color Doppler transvaginale consente posizionamenti accurati del volume campione per la misurazione con Doppler pulsato. Mediante l’analisi Doppler della forma del profilo d’onda, è possibile distinguere l’ovaio contenente il corpo luteo attivo da un ovaio inattivo. La tecnica è di semplice uso ed i risultati sono subito disponibili. Le alterazioni vascolari possono essere generalmente osservate come un’area fluttuante di colore (con il tipico aspetto semilunare) e i diversi indici (indice di resistenza, indice di pulsatilità, rapporto S/D, ecc.), derivati dalla forma del profilo d’onda della velocità di flusso, forniscono una stima quantitativa della resistenza del flusso ematico. E’ noto che la compliance arteriosa dell’ovaio cambia durante i normali cicli mestruali. Durante la fase follicolare, entrambe le ovaie presentano allo studio Doppler del flusso sanguigno, dei profili d’onda ad alta resistenza con l’assenza virtuale o la minima presenza della componente diastolica. Questi segnali di alta resistenza di ovaio inattivo permangono durante il ciclo. Nell’ovaio attivo è presente, al contrario, una marcata componente diastolica e conseguentemente segnali a bassa resistenza con l’avvicinarsi dell’ovulazione, e particolarmente durante la formazione del corpo luteo. L’angiogenesi nel corpo luteo avviene in condizioni fisiologiche durante ogni ciclo mestruale ed è funzionalmente necessaria per il mantenimento delle prime fasi della gravidanza. L’impiego del color Doppler transvaginale consente il semplice e dettagliato riconoscimento dell’ovaio attivo contenente il corpo luteo. Il colore costituisce una guida essenziale per l’esplorazione mediante Doppler pulsato di queste vescicole disposte casualmente nel tessuto ovarico. Senza il colore con il quale viene rappresentato il flusso, l’analisi di Doppler sarebbe potenzialmente inadeguata.
Doppler nel ciclo mestruale normale: I vasi intraovarici solitamente non sono identificabili prima dell’8º-10º giorno di un ciclo di 28 giorni. L’indice di resistenza risulta di circa 0.54± 0.04 fino all’avvicinarsi dell’ovulazione. Il declino della resistenza inizia 2 giorni prima dell’ovulazione e raggiunge il nadir al momento dell’ovulazione, 0.44 ± 0.04, rimanendo a questi livelli per 4-5 giorni. Successivamente, la resistenza gradualmente risale a 0.50 ± 0.04, restando a livelli inferiori rispetto a quelli riscontrati durante la prima fase follicolare.
In conclusione le modificazioni del flusso sanguigno ovarico che avvengono prima dell’ovulazione, sono fenomeni complessi e non sono solo secondari all’azione del progesterone. Tuttavia, alcune domande sono ancora senza risposta: una vascolarizzazione inadeguata potrebbe essere responsabile di un difetto della fase luteinica? La mancanza di un flusso adeguato potrebbe determinare l’interruzione precoce della gravidanza e le modificazioni del flusso potrebbero giocare un ruolo nell’infertilità? Si sono studiate le variazioni della compliance arteriosa dell’ovaio durante il ciclo mestruale della donna e correlato i riscontri ecografici con i livelli di ormoni circolanti. Nell’ovaio attivo con un follicolo dominante o un corpo luteo, il PI nella prima fase follicolare (6.97 ± 2.01) è risultato significativamente più elevato rispetto al PI della fase tardiva (2.36 ± 0.31), ed il PI nella fase luteinica precoce (0.68 ± 0.09) è risultato significativamente più basso rispetto al PI della fase follicolare tardiva. Nell’ultima parte della fase luteinica il PI diventava significativamente superiore (0.93 ± 0.16) rispetto al PI della fase luteinica precoce. Nell’ovaio inattivo senza un follicolo o corpo luteo non è stata osservata alcuna variazione nei valori di PI durante il ciclo mestruale. I valori di PI dell’ovaio attivo erano correlati con i livelli di progesterone sierico ma non con i livelli di estradiolo.
Doppler del corpo luteo nelle prime fasi della gravidanza
Nel corpo luteo, durante il primo trimestre della gravidanza è possibile rilevare un flusso sanguigno a bassissima resistenza. E’ stato ipotizzato che questo mancato evento possa contribuire alle patologie del Iº trimestre. Nelle gravidanze normali, l’RI e il PI medi del flusso sanguigno del corpo luteo non sono risultati condizionati dall’epoca di gestazione
L’RI medio nel flusso sanguigno del corpo luteo nelle p/ti con aborto interno o altre patologie è superiore rispetto alle donne con gravidanza normale (p<0.01).
Flussimetria nei cicli PMA: il flusso ovarico è correlato al numero di follicoli (> 15mm) presenti in ogni ovaio stimolato. L’indice di pulsatilità dell’arteria ovarica e dei vasi intraovarici diminuisce con l’aumentare del numero di follicoli. Recentemente è stato dimostrato che, durante i cicli stimolati, il flusso intraovarico è correlato ai livelli sierici di estradiolo.
Durante la fase luteinica dei cicli stimolati si formano numerosi corpi lutei il cui aspetto è facilmente osservabili mediante ecografia transvaginale. Utilizzando le immagini del color Doppler siamo in grado di identificare numerosi vasi sanguigni introno la corpo luteo. Lo studio Doppler di questi vasi mostra una bassissima resistenza al flusso durante i primi stadi della fase luteinica. Quando non si verifica la gravidanza, la ricca vascolarizzazione del corpo luteo gradualmente scompare e la sua resistenza aumenta progressivamente durante la fase luteinica tardiva. Tuttavia, in caso di gravidanza, il corpo luteo mantiene la sua vascolarizzazione e la resistenza al flusso rimane bassa. E’ possibile identificare le donne che non resteranno gravide: nessuna p/te in cui è stata ottenuta la gravidanza aveva un RI superiore a 0.5 durante la seconda metà della fase luteinica. Tuttavia, il corpo luteo può restare riccamente vascolarizzato durante la fase luteinica tardiva per altre ragioni (per esempio per iperstimolazione delle ovaie).
Bibliografia:
- DURFEE SM, FRATES MC. Sonographic spectrum of the corpus luteum in early pregnancy: gray-scale, color, and pulsed Doppler appearance. J Clin Ultrasound 1999;27:55-9.
- JAIN KA. Sonographic spectrum of hemorrhagic ovarian cysts. J Ultrasound Med 2002;21:879-86.
- Richard A. Jungmann and John S. Schweppe: “Mechanism of Action of Gonadotropin”. J. Biol. Chem. 1972, 247:5535-5542.Cole LA (2009). “New discoveries on the biology and detection of human chorionic gonadotropin”. Reprod. Biol. Endocrinol. 7: 8.
- Alberto Fernández-Tejada, Paul A. Vadola, and Samuel J. Danishefsky: ”Chemical Synthesis of the β-Subunit of Human Luteinizing (hLH) and Chorionic Gonadotropin (hCG) Glycoprotein Hormones”. J. Am. Chem. Soc., 2014, 136 (23), pp 8450–8458
- Gregory JJ, Finlay JL (April 1999). “Alpha-fetoprotein and beta-human chorionic gonadotropin: their clinical significance as tumour markers”. Drugs 57 (4): 463–7
- Lee-Huang S, Huang PL, Sun Y, Huang PL, Kung HF, Blithe DL, Chen HC (March 1999). “Lysozyme and RNases as anti-HIV components in beta-core preparations of human chorionic gonadotropin”. Proc. Natl. Acad. Sci. U.S.A. 96 (6): 2678–81.
- Niswender GD, Juengel JL, Silva PJ, Rollyson MK, McIntush EW.:”Mechanisms controlling the function and life span of the corpus luteum”. Physiol Rev. 2000 Jan;80(1):1-29
- .McCracken JA1, Custer EE, Lamsa JC: “Luteolysis: a neuroendocrine-mediated event. Physiol Rev. 1999 Apr;79(2):263-323.
- McCracken JA1, Custer EE, Lamsa JC, Robinson AG:The central oxytocin pulse generator: a pacemaker for luteolysis. Adv Exp Med Biol. 1995;395:133-54.
- Mirando MA1, Prince BC, Tysseling KA, Carnahan KG, Ludwig TE, Hoagland TA, Crain RC.: “A proposed role for oxytocin in regulation of endometrial prostaglandin F2 alpha secretion during luteolysis in swine”.Adv Exp Med Biol.1995;395:421-33.
- J Reprod Fertil Suppl. 1992;45:97-111.
- Jenkin G1: “Oxytocin and prostaglandin interactions in pregnancy and at parturition”. J Reprod Fertil Suppl. 1992;45:97-111.
- Hackelöer, B.J., Nitschke, S., Daume, E., Sturm, G., and Buchholz, R. Ultraschalldarstellung von Ovarveränderungen bei Gonadotropinstimulierungen. Geburtsh. u. Frauenh. 1977; 37: 185–190
- Hackelöer, B.J. and Robinson, H.P. Ultraschalldarstellung des wachsenden Follikels und Corpus luteum im normalen physiologischen Zyklus. Geburtsh. u. Frauenh. 1978; 38: 163–168
- Hackelöer, B.J., Fleming, R., Robinson, H.P., Adam, A.H., and Coutts, J.R.T. Correlation of ultrasonic and endocrinological assessment of human follicular development. Am. J. Obstet. Gynecol. 1979; 135: 122–128
- Strott, C.A., Yoshimi, T., Ross, G.T., and Lipsett, M.B. Ovarian physiology: Relationship between plasma LH and steroidgenesis by the follicle and corpus luteum: Effect of HCG. J. Clin. Endocrinol. Metab. 1969; 29: 1157–116
- Leyendecker, G., Wardlow, S., and Nocke, W. Experimental studies of the endocrine regulations during the periovulatory phase of the human menstrual cycle. Acta Endocrinol. 1972; 71: 160–17
- Marek, J. and Hulka, J. Luteinised unruptured follicle syndrome: A subtle cause of infertility. Fertil. Steril. 1978; 29: 270–274
- Nitschke-Dabelstein, S., Sturm, G., and Daume, E. New aspects in the definition of follicular development in the human ovary. J. Steroid Biochem. 1978; 9: 871
- Nitschke-Dabelstein, S., Hackelöer, B.J., and Sturm, G. The importance of ultrasonic monitoring of ovarian stimulating therapy. in: A comparative study of epimestrol, clomiphene, gonadotrophin and bromocryptin treated, ovulatory cycles controlled by ultrasonic examinations and assessment of endocrinological parameters as plasma LH, 17β-estradiol and progesterone. Progress in Medical Ultrasound. Excerpta Medica, Amsterdam; 198
- Soules MR1, Bremner WJ, Steiner RA, Clifton DK.: “Prolactin secretion and corpus luteum function in women with luteal phase deficiency”. J Clin Endocrinol Metab.1991 May;72(5):986-92.Terinde, R., Schmidt-Elmendorff, H., and Tigges, J. Ultraschallkontrollierte ovarielle Stimulation mit Gonadotropinen und nachfolgenden Zwillingsschwangerschaften. Geburtsh. u. Frauenh. 1978; 38: 208–211 Albarracin C.T., Gibor G.: “Prolactin Action on Luteal Protein Expression in the Corpus Luteum”. Endocrinology 1991;Volume 129, Issue 4
- Freeman M.E.: “Control of the CorpusLuteum: A Model System for Toxicology Research”. Environmental Health Perspectives- Vol. 38,pp.51-54,1981.Smith MS, McLean BK, Neill JD. Prolactin: the initial luteotropic stimulus of pseudopregnancy in the rat. Endocrinology. 1976 Jun;98(6):1370–1377. [PubMed]
- Gordon D. Niswender , Jennifer L. Juengel , Patrick J. Silva , M. Keith Rollyson , Eric W. McIntush: “Mechanisms Controlling the Function and Life Span of the Corpus Luteum”.Physiological Reviews. Published 1 January 2000 Vol. 80 no. 1, 1-29DOI:
- Gordon D. Niswender , Jennifer L. Juengel , Patrick J. Silva , M. Keith Rollyson , Eric W. McIntush: “Mechanisms Controlling the Function and Life Span of the Corpus Luteum”.Physiological ReviewsPublished 1 January 2000Vol. 80no. 1, 1-29DOI:
- CHANNING C. P.(1969): “Steroidogenesis and morphology of human ovarian cell types in tissue culture. J. Endocrinol. 45:297–308.
- CHANNING C. P.(1969): Tissue culture of equine ovarian cell types: culture methods and morphology. J. Endocrinol.43:381–390.
- GARRIDO C.,SIMON S.,GOSPODAROWICZ D.(1993): “Transcriptional regulation of vascular endothelial growth factor gene expression in ovarian granulosa cells”. Growth Factors8:109–117.
- KOOS R. D.(1995): “Increased expression of vascular endothelial growth/permeability factor in the rat ovary following an ovulatory gonadotropin stimulus: potential roles in follicle rupture. Biol. Reprod.52:1426–1435.
- REDMER D. A.,REYNOLDS L. P.(1996) Angiogenesis in the ovary. Rev. Reprod.1:182–192.
- REYNOLDS L. P.,KILLILEA S.,REDMER D. A. (1992) Angiogenesis in the female reproductive system. FASEB J.6:886–892
- DHARMARAJAN A. M.,BRUCE N. W.,MEYER G. T.(1985) Quantitative ultrastructural characteristics relating to transport between luteal cell cytoplasm and blood in the corpus luteum of the pregnant rat. Am. J. Anat.172:87–99.
- SWANN R. T.,BRUCE N. W.(1987) Oxygen consumption, carbon dioxide production and progestagen secretion in the intact rat ovary of the day-16 pregnant rat. J. Reprod. Fertil.80:599–605.
- CRIVELLO J. F., JEFCOATE C. R. (1978): “Mechanisms of corticotropin action in rat adrenal cells. I. The effects of inhibitors of protein synthesis and of microfilament formation on corticosterone synthesis”. Biochim. Biophys. Acta 542:315–329. BROWN M. S.,GOLDSTEIN J. L. (1986): “A receptor-mediated pathway for cholesterol homeostasis”. Science 232:34–47.
- COOK B.,KALTENBACH C. C.,NORTON H. W.,NALBANDOV A. V. (1967) “Synthesis of progesterone in vitro by porcine corpora lutea”. Endocrinology81:573–584
- WATERMAN M. R. A (1995) rising StAR: an essential role in cholesterol transport. Science267:1780–1781.
- D Lin,T Sugawara, JF Strauss 3rd, BJ Clark, DM Stocco, P Saenger, A Rogol, WL Miller: “Role of steroidogenic acute regulatory protein in adrenal and gonadal steroidogenesis”. Science24 March 1995: Vol. 267 no. 5205 pp. 1828-1831
- Douglas M. Stocco, Barbara J. Clark: “Role of the steroidogenic acute regulatory protein (StAR) in steroidogenesis”.Biochemical Pharmacology Volume 51, Issue 3, 9 February 1996, Pages 197–205
- COOK B.,NALBANDOV A. V. (1968): “The effect of some pituitary hormones on progesterone synthesis in vitro by the luteinized ovary of the common opossum (Didelphis marsupialis Virginiana). J. Reprod. Fertil. 15:267–275.
- CRIVELLO J. F.,JEFCOATE C. R. (1978): “Mechanisms of corticotropin action in rat adrenal cells. I. The effects of inhibitors of protein synthesis and of microfilament formation on corticosterone synthesis. Biochim. Biophys. Acta542:315–329.
- CONSTANTINO C. X.,KEYES P. L.,KOSTYO J. L. (1991): “Insulin-like growth factor-I stimulates steroidogenesis in rabbit luteal cells”. Endocrinology128:1702–1708.
- DEVOTO L.,KOHEN P.,CASTRO O.,VEGA M.,TRONCOSO J. L.,CHARREAU E. (1995): Multihormonal regulation of progesterone synthesis in cultured human midluteal cells”. J. Clin. Endocrinol. Metab.80:1566–1570.
- McARDLE C. A.,HOLTORF A.-P.(1989): “Oxytocin and progesterone release from bovine corpus luteal cells in culture: effects of insulin-like growth factor I, insulin, and prostaglandins”. Endocrinology124:1278–1286.
- PARMER T. G.,ROBERTS C. T. J R,LEROITH D.,ADASHI E. Y.,KHAN I.,SOLAN N.,NELSON S.,ZELBERSTEIN M.,GIBORI G.(1991) Expression, action, and steroidal regulation of insulin-like growth factor-I (IGF-I) and IGF-I receptor in the rat corpus luteum: their differential role in the two cell populations forming the corpus luteum. Endocrinology129:2924–2932.
- SAUERWIEN H.,MIYAMOTO A.,GUNTHER J.,MEYER H. H. D.,SCHAMS D.(1992): “Binding and action of insulin-like growth factors and insulin in bovine luteal tissue during the oestrous cycle”. J. Reprod. Fertil.96:103–115.
- LIEBERMANN J.,SCHAMS D.(1994): “Actions of somatotrophin on oxytocin and progesterone release from the microdialysed bovine corpus luteum in vitro. J. Endocrinol.143:243–250.
- ALILA H. W.,CORRADINO R. A.,HANSEL W. (1988) A comparison of the effects of cyclooxygenase prostanoids on progesterone production by small and large bovine luteal cells. Prostaglandins36:259–270.
- FITZ T. A.,MOCK E. J.,MAYAN M. H.,NISWENDER G. D.(1984) Interactions of prostaglandins with subpopulations of ovine luteal cells. II. Inhibitory effects of PGF2α and protection by PGE2. Prostaglandins28:127–138.
- MILVAE R. A.,HANSEL W.(1980) The effects of prostacyclin (PGI2) and 6-keto-PGF1α on bovine plasma progesterone and LH concentrations. Prostaglandins20:641–647.
- McGUIRE W. J.,JUENGEL J. L.,NISWENDER G. D.(1994) Protein kinase C second messenger system mediates the antisteroidogenic effects of prostaglandin F2α in the ovine corpus luteum in vivo. Biol. Reprod.51:800–806.
- KNICKERBOCKER J. J.,WILTBANK M. C.,NISWENDER G. D.(1988) Mechanisms of luteolysis in domestic livestock. Domest. Anim. Endocrinol.5:91–107.
- OLOFSSON J.,NORJAVAARA E.,SELSTAM G.(1992) Synthesis of prostaglandin F2α, E2 and prostacyclin in isolated corpora lutea of adult pseudopregnant rats throughout the luteal life-span. Prostaglandins Leukotrienes Essent. Fatty Acids46:151–161.
- TSAI S. J.,WILTBANK M. C.(1997) Prostaglandin F2α induces expression of prostaglandin G/H synthase-2 in the ovine corpus luteum: a potential positive feedback loop during luteolysis. Biol. Reprod.57:1016–1022.
- TSAI S. J.,WILTBANK M. C.(1998) Prostaglandin F2α regulates distinct physiological changes in early and mid-cycle bovine corpora lutea. Biol. Reprod.58:346–352.
- GIRSH E.,WANG W.,MAMLUK R.,ARDITI F.,FRIEDMAN A.,MILVAE R. A.,MEIDAN R.(1996) Regulation of endothelin-1 in the bovine corpus luteum: elevation by prostaglandin F2 alpha. Endocrinology137:5191–5196.
- OHTANI M.,KOBAYSHI S.,MIYAMOTO A.,HAYASHI K.,FUKUI Y.(1998) Real-time relationships between intraluteal and plasma concentrations of endothelin, oxytocin, and progesterone during prostaglandin F2α-induced luteolysis in the cow. Biol. Reprod.58:103–108.
- RAKUGI H.,TABUCHI Y.,NAKAMURA M.,NAGANO M.,HIGASHIMORI K.,MAKAMI H.,OGIHARA T.,SUZUKI N.(1990) Evidence for endothelin-1 release from resistance vessels of rats in response to hypoxia. Biochem. Biophys. Res. Commun.169:973–977.
- CAVANAGH A. C.,MORTON H.(1994) The purification of early pregnancy factor to homogeneity from human platelets and identification as chaperonin 10. Eur. J. Biochem.222:551–560.
- STOCCO D. M.,CHEN W.(1991) Presence of identical mitochondrial proteins in unstimulated constitutive steroid-producing R2C rat Leydig tumor and stimulated nonconstitutive steroid-producing MA-10 mouse Leydig tumor cells. Endocrinology128:1918–1926.
- MATSUYAMA S.,OHTA M.,TAKAHASHI M.(1987) The critical period in which splenectomy causes functional disorder of the ovary in adult rats. Endocrinol. Japon.34:849–855.
- BRÄNNSTROM M.,NORMAN R. J.(1993) Involvement of leukocytes and cytokines in the ovulatory process and corpus luteum function. Hum. Reprod.8:1762–1775.
- ADAMS E. C.,HERTIG A. T.(1969) Studies on the corpus luteum. I. Observation on the ultrastructure of development and regression of the luteal cells during the menstrual cycle. J. Cell Biol.41:696–715.
- BRENNER R. M.,RESKO J. A.,WEST N. B.(1974) Cyclic changes in oviductal morphology and residual cytoplasmic estradiol binding capacity induced by sequential estradiol-progesterone treatment of spayed Rhesus monkeys. Endocrinology95:1094–1104.
- PAAVOLA L. G.(1979) The corpus luteum of the guinea pig. IV. Fine structure of macrophages during pregnancy and postpartum luteolysis and the phagocytosis of luteal cells. Am. J. Anat.154:337–364.
- PEPPERELL J. R.,WOLCOTT C.,BEHRMAN H. R.(1992) Effects of neutrophils in rat luteal cells. Endocrinology130:1001–1008.
- PARKER C. W.(1991) Neutrophil mechanisms. Am. Rev. Respir. Dis.143:559–560.
- TSCHESHE H.,FEDROWITZ J.,MICHAELIS J.,MACARTNEY H. W.(1986) Matrix degrading proteinases from human granulocytes: type I, II, III collagenase, gelatinase and type IV collagenase. Folia Histochem. Cytobiol.61:269–273.
- ADAMS E. C.,HERTIG A. T.(1969) Studies on the corpus luteum. I. Observation on the ultrastructure of development and regression of the luteal cells during the menstrual cycle. J. Cell Biol.41:696–715.
- FAIRCHILD D. L.,PATE J. L.(1989) Interferon induction of major histocompatibility complex antigens on cultured bovine luteal cells. Biol. Reprod.40:453–457.
- PAAVOLA L. G.(1979) The corpus luteum of the guinea pig. IV. Fine structure of macrophages during pregnancy and postpartum luteolysis and the phagocytosis of luteal cells. Am. J. Anat.154:337–364.
- FAIRCLOUGH R. J.,MOORE L. G.,McGOWAN L. T.,PETERSON A. J.,SMITH J. F.,TERVIT H. R.,WATKINS W. B.(1980) Temporal relationship between plasma concentrations of 13,14-dihydro-15-keto-prostaglandin F and neurophysin I/II around luteolysis in sheep. Prostaglandins 20:199–208.
- SAWYER H. R.,NISWENDER K. D.,BRADEN T. D.,NISWENDER G. D.(1990) Nuclear changes in ovine luteal cells in response to PGF2α. Domest. Anim. Endocrinol. 7:229–238












14 commenti
Thanks for sharing your thoughts on anatomia. Regards
Thank you, I’ve recently been looking for info about this
topic for a while and yours is the best I have discovered till
now. However, what in regards to the conclusion? Are you certain about the source?
I think the admin of this web site is actually working hard for his web site, as here
every material is quality based information.
Hi there! This is my 1st comment here so I just wanted to give a quick shout out
and tell you I genuinely enjoy reading your posts. Can you suggest any other blogs/websites/forums
that deal with the same topics? Thanks!
great points altogether, you just received a new reader.
What could you suggest about your submit that you simply made a few days in the past?
Any positive?
I absolutely love your blog.. Very nice colors & theme.
Did you build this website yourself? Please reply back as I’m wanting to create my very own site and would love to learn where you got this from or just what the theme is named.
Thanks!
I love what you guys tend to be up too. This sort of clever work and exposure!
Keep up the good works guys I’ve included you guys to my
blogroll.
Thanks in favor of sharing such a pleasant thought,
piece of writing is nice, thats why i have read it entirely
Hi there! Would you mind if I share your blog with my facebook group?
There’s a lot of people that I think would really appreciate your content.
Please let me know. Thank you
Thanks for sharing your thoughts on anatomia. Regards
Great blog! Is your theme custom made or did you download it from somewhere?
A theme like yours with a few simple tweeks would really
make my blog jump out. Please let me know where you got your design. Kudos
Thanks for every other wonderful post. Where else may just anyone get that kind of information in such an ideal
manner of writing? I have a presentation next week, and I’m at the
search for such information.
If some one wishes expert view on the topic of running a blog afterward i
propose him/her to pay a visit this weblog, Keep up the
nice job.
Hi there to all, it’s truly a good for me to go to see this
website, it consists of helpful Information.