Ultimo aggiornamento: 2023-03-21
La scansione ecografica dell’ovaio è una componente importante della consulenza ginecologica di base e soprattutto in caso di indagine sulla infertilità e monitoraggio follicolare ecografico in corso di PMA, studio delle amenorree, disturbi del ciclo e, ovviamente, per sospetta neoplasia ovarica benigna (cisti, PCOS, fibroma) o maligna.
Il fattore ovarico è coinvolto nel 10-20% dei casi di sterilità; l’esame ecografico consente di individuare alterazioni della normale funzionalità ovarica: anovulazione, insufficienza della fase luteale, sindrome del follicolo luteinizzato non rotto (LUF-Syndrome), cisti ovariche o paraovariche, endometriosi ovarica, ovaie multifollicolari e micropolicistosi ovarica (PCOS).
PRESSIONE DELLA SONDA – una pressione eccessiva sulla sonda può dare risultati negativi come ad esempio nel monitoraggio follicolare in cui una pressione eccessiva, comprimendo il follicolo, fornisce dati alterati sulla volumetria. Un’insufficiente pressione comporta il rischio di includere nell’esame tessuti adiacenti alle strutture bersaglio.
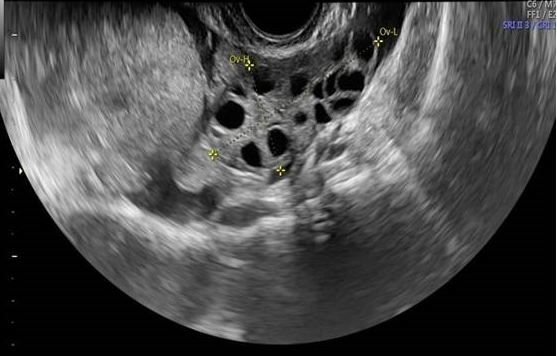
Le ovaie, in condizioni di normalità, topograficamente si visualizzano su entrambi i lati dell’utero, anche se posizioni superiori o posteriori all’utero non sono infrequenti. Talvolta, in cicli non stimolati, si può avere difficoltà a individuare le ovaie; in tal caso una ricerca lungo l’arteria iliaca interna può rivelarsi utile. L’ovaio è spesso situato anteriormente alla biforcazione dell’a. iliaca comune (7-10).
Durante l’età fertile, le ovaie subiscono variazioni morfovolumetriche correlate allo sviluppo ciclico ed atresia dei follicoli (8). Le normali dimensioni di un ovaio in età fertile sono 2,2-2,9 cm di lunghezza, 1,52,0 cm di larghezza e 1,5-3,0 cm di spessore (dimensione antero-posteriore) (11-14).
Le dimensioni follicolari medie variano da un minimo di 1-2 mm al 3° giorno del ciclo a 18-22 mm in periodo pre-ovulatorio con un range di 17-27 mm. Le dimensioni follicolari sono calcolate effettuando la media dei due diametri massimi (17,18). Dall’8-9° giorno inizia la selezione del follicolo dominante che in tali giorni misura 8-10 mm. L’ovulazione ha una cadenza variabile per cui dal momento in cui si individua un follicolo di 15-16 mm, è necessario un monitoraggio follicolare quotidiano per individuare esattamente il giorno dell’ovulazione che in genere avviene al 14° giorno di un ciclo spontaneo di 28 giorni con espulsione dell’ovocita e del liquido follicolare. L’avvenuta ovulazione è testimoniata dalla trasformazione del profilo follicolare che da rotondo diventa irregolare e dalla presenza nel cavo del Douglas di una falda liquida (fluido follicolare) che è massima 4-5 giorni dopo l’ovulazione.
Nei cicli di procreazione medica assistita a bassa tecnologia, che non prevedono il pick-up ovocitario, lo scopo del monitoraggio follicolare è l’adeguamento della stimolazione in base alla risposta ovarica o la sospensione della stessa in caso di risposta ovarica inadeguata (<3 follicoli con diametro medio >16 mm) o eccessiva (>15 follicoli di diametro >16 mm) ed il timing della somministrazione dell’hCG per indurre l’ovulazione.
Nei programmi FIV/ICSI, che prevedono il prelievo ovocitario, il monitoraggio oltre che ecografico è anche endocrino, attraverso la valutazione dei livelli di 17-β-estradiolo. ed LH. Lo sviluppo follicolare viene monitorato dal 6-8° giorno del ciclo individuando il momento più idoneo alla somministrazione dell’hCG che in genere è individuato nel giorno in cui almeno 2-3 follicoli raggiungono 16-18 mm di diametro e i livelli di 17-β-estradiolo sono di 250 pg/ml per il primo follicolo maturo più 150 pg/ml per ogni ulteriore follicolo con diametro >14 mm. Calcolare il diametro medio di tutti i follicoli può risultare difficoltoso data la loro molteplicità e la compressione reciproca che distorce i contorni follicolari. Tale problema potrebbe essere superato con l’utilizzo dell’ecografia 3D e con la tecnica VOCAL (Virtual Organ Computer-Aided analysis) in grado di misurare in tempo reale i diametri ed il volume follicolare. Il volume ovarico al giorno dell’HCG e la conta dei follicoli antrali al 3° giorno del ciclo sono fattori predittivi importanti per l’otcome ovocitario. Infatti ovaie di piccole dimensioni (<8 cm3) e un ridotto numero di follicoli antrali al 3° giorno (<5,7±1,0) sono associati a scarsa risposta all’hCG e ad un’alta percentuale di sospensione del ciclo mentre un volume follicolare medio di 5-7 ml o un diametro medio di 18-20 mm sono predittivi di un buon outcome ovocitario (21).
Con il color-power Doppler è possibile studiare la vascolarizzazione perifollicolare che appare più marcata attorno al follicolo dominante sì da configurare un frame noto come “ring of fire”. Alla scansione con Doppler pulsato le arteriole spirali perifollicolari mostrano un’alta impedenza e bassa velocità.
Gli indici di vascolarizzazione dell’ovaio dominante, del follicolo dominante e del corpo luteo, valutati con il 3D power Doppler, aumentano durante la fase follicolare restando alti anche dopo la rottura del follicolo e la formazione del corpo luteo. Ciò è dovuto alla formazione di nuovi vasi e all’aumento di fattori angiogenetici.
Il follicolo rotto si trasforma in corpo luteo il cui scopo principale è quello di fornire progesterone per la decidualizzazione endometriale e il mantenimento di un’eventuale gravidanza (19-22). L’ovulazione multipla è un evento che si verifica in circa il 5% per cento dei cicli non stimolati (19). Il corpo luteo persiste e si ipertrofizza in caso di gravidanza mentre degrada a corpus albicans in assenza di gravidanza (23). Il corpo luteo può simulare un endometrioma, un ascesso, una neoplasia o una gravidanza extrauterina (24). Il Color Doppler è in grado di dimostrare la neovascolarizzazione all’interno della parete del corpo luteo (21-24). 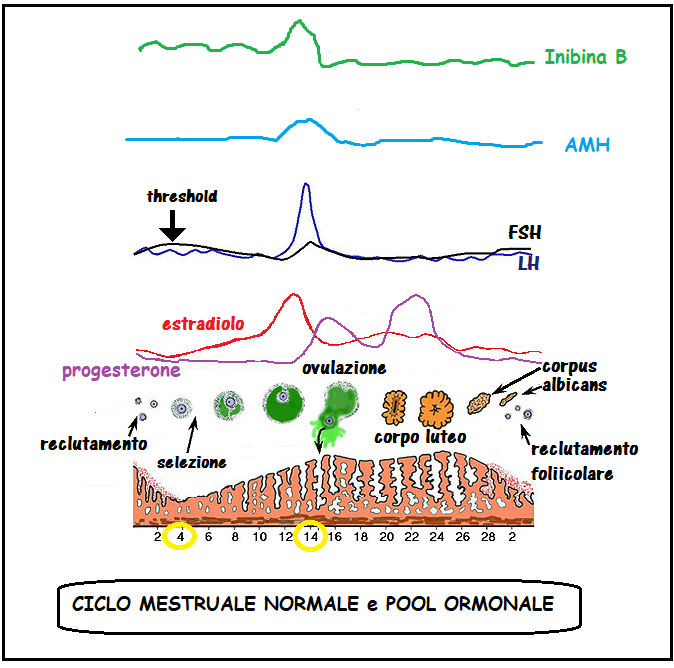
L’irrorazione arteriosa è fornita dall’arteria ovarica che origina dall’aorta addominale, appena caudalmente alle arterie renali, ed entra nel bacino attraverso il legamento infundibulo-pelvico. Raggiunge l’ilo ovarico e penetra nell’ovaio attraverso il mesovario. Da ognuna delle due arterie ovariche provengono rami primari e secondari. Questi ultimi sono disposti a spirale in modo da seguire l’estensione dei follicoli in crescita. L’irrorazione ovarica si avvale anche di un ramo arterioso per ciascun lato proveniente dall’a. uterina. e che si anastomizza con i rami terminali dell’a. ovarica omolaterale (11-15).
La flussimetria dell’a. ovarica presenta variazioni durante le fasi di un ciclo mestruale normale. In generale, i valori di indice di pulsatilità (PI) di questa arteria sono relativamente elevati durante la fase follicolare iniziale. Essi diminuiscono progressivamente nella fase pre-ovulatoria e luteale precoce per aumentare di nuovo durante la fase luteale tardiva (25-27). L’indice di resistenza (IR) medio presenta un diagramma simile al PI. Infatti in periodo follicolare precoce l’IR è 0,54+/- 0,04 e quindi inizia a diminuire fino a raggiungere il nadir di 0,44+/-0,04 in fase luteale precoce per risalire a 0,50+/-0,04 nel periodo luteale tardivo. Differenze statisticamente significative sono state dimostrate fra ovaio ovulatorio e non ovulatorio perchè quest’ultimo presenta minori oscillazioni cicliche e valori di impedenza arteriosa più elevati (25-27).
REFERENCES:
- Darwish A.M. · Youssef A.A. Screening Sonohysterography in Infertility Gynecol Obstet Invest 1999;48:43–47
- Mendelson EB, Bohm-Velez M, Joseph N, Neiman HL. Gynecologic imaging: Comparison of transabdominal and transvaginal sonography. Radiology 1988;166:321-324.
- Coleman BG, Arger PH, Grumbach K, et al. Transvaginal and transabdominal sonography: Prospective comparison. Radiology 1988;168:639-643.
- Tessler FN, Schiller VL, Perrella RR, Sutherlan ML, Grant EG. Transabdominal versus endovaginal pelvic sonography: prospective study. Radiology 1989;170:553-556.
- Scanlan KA, Pozniak MA, Fagerholm M, Shapiro S. Value of transperineal sonography in the assessment of vaginal atresia. AJR Am J Roentgenol 1990;154:545-548.
- Graham D, Nelson MW. Combined perineal-abdominal sonography in the assessment of vaginal atresia. J Clin Ultrasound 1986;14:735-738.
- Jeanty P, d’Alton M, Romero R, Hobbins JC. Perineal scanning. Am J Perinatol 1986;13:289-295.
- Lyons EA, Gratton D, Harrington C. Transvaginal sonography of normal pelvic anatomy. Radiol Clin North Am 1992;30:663-675.
- Fleischer AC, McKee MS, Gordon AN, et al. Transvaginal sonography of postmenopausal ovaries with pathologic correlation. J Ultrasound Med 1990;9:637-644.
- Wolf SI, Gosink BB, Feldesman MR, et al. Prevalence of simple adnexal cysts in postmenopausal women. Radiology 1991;180:65-71.
- International Commission on Radiological Protection. Task Group on Reference Man. Report of the Task Group on Reference Man. Prepared by the Task Group Committee no. 2, International Commission on Radiological Protection, Snyder WS (chairperson). New York:Pergamon Press, 1975.
- Sample WF, Lippe BM, Gyepes MT. Gray-scale ultrasonography of the normal female pelvis. Radiology 1977;125:477-483.
- Edwards RG. Conception in the Human Female. London;New York:Academic Press, 1980.
- Yeh HC, Futterweit W, Thornton JC. Polycystic ovarian disease: US features in 104 patients. Radiology 1987;163:111-116.
- Hackeloer B.-J., Nitschke-Dabelstein S. Ovarian imaging by ultrasound: An attempt to define a reference plane. J Clin Ultrasound 1980;8:497-500.
- Fleischer AC, Daniell JF, Rodier J, Lindsay AM, James AE Jr. Sonographic monitoring of ovarian follicular development. J Clin Ultrasound 1981;9:275-280.
- Bomsel-Helmreich O, Gougeon A, Thebault A, et al. Healthy and atretic human follicles in the preovulatory phase: Differences in evolution of follicular morphology and steroid content of the follicular fluid. J Clin Endocrinol Metab 1979;48:686-694.
- Nitschke-Dabelstein S, Hackeloer BJ, Sturm G. Ovulation and corpus luteum formation observed by ultrasonography. Ultrasound Med Biol 1981;7:33-39.
- O’Herlihy C, de Crespigny LJ Ch, Robinson HP. Monitoring ovarian follicular development with real-time ultrasound. Br J Obstet Gynaecol 1980;87:613-618.
- Renaud R, Macler J, Dervain I. Echographic study of follicular maturation and ovulation during the normal menstrual cycle. Fertil Steril 1980;33:272-276.
- Fleischer AC, Kepple DM, Vasquez J. Conventional and color Doppler transvaginal sonography in gynecologic infertility. Radiol Clin North Am 1992;30:693-702.
- Hall DA, Hann LE, Ferrucci JT Jr, et al. Sonographic morphology of the normal menstrual cycle. Radiology 1979;133;185-188.
- Dillon EH, Taylor KJW: Doppler ultrasound in the female pelvis and first trimester pregnancy. Clin Diagn Ultrasound 1990;26:93-117.
- Coleman BG: Transvaginal sonography of adnexal masses. In: Coleman BG, ed. The Radiologic Clinics of North America. Philadelphia, W.B. Saunders, 1992;30:677-691.
- Hata K, Hata T, Senoh D, et al. Change in ovarian arterial compliance during the human menstrual cycle assessed by Doppler ultrasound. Br J Obstet Gynaecol 1990;97:163-166.
- Scholtes MCW, Wladimiroff JW, van Rijen HJM, Hop WC. Uterine and ovarian flow velocity waveforms in the normal menstrual cycle: A transvaginal Doppler study. Fertil Steril 1989;52:981-985.
- Taylor KJW, Burns PN, Wells PNT, Conway DI, Hull MGR. Ultrasound Doppler flow studies of the ovarian and uterine arteries. Br J Obstet Gynaecol 1985;92:240-246.