- IUGR asimmetrico (o sproporzionato o late flattening): il feto è sottopeso e dirige la maggior parte della sua energia a mantenere la crescita di organi vitali, come il cervello e il cuore, a discapito del fegato, del tessuto muscolare e del grasso. Presenta una biometria cranica normale per l’epoca gestazionale ma sproporzionatamente grande (“head sparing”) rispetto ad altri parametri come la circonferenza addominale ridotta (a causa della ridotta dimensione del fegato), arti sottili (a causa della diminuzione della massa muscolare) e uno scarso pannicolo adiposo con cute sottile. Se l’insulto che causa la restrizione asimmetrica della crescita è sostenuto abbastanza a lungo o è abbastanza grave, il feto può perdere la capacità di compensare e la restrizione di crescita interesserà tutti gli organi, anche il cervello ed il cranio con gravissime conseguenze per il feto. L’IUGR asimmetrico si manifesta dopo la 26a settimana, è ingravescente con il progredire delle settimane ed è dovuto ad insufficienza placentare secondaria a patologie materne (ipertensione arteriosa, cardiopatie, diabete, trombofilia, talassemia, etc). In caso di IUGR asimmetrico si osserva un aumento dell’indice di resistenza (IR) e una diminuzione della velocità di flusso nei distretti splancnici e muscolari; il contrario avviene nei distretti encefalici, cardiaci e surrenalici. (12-14)
- IUGR simmetrico (o proporzionato o low profile): il feto è proporzionalmente piccolo, risultante da un ritmo di crescita costantemente al di sotto del range di normalità. E’ associato a patologie congenite (malformazioni o alterazioni genetiche come trisomia 13, 18 e 21), gravidanze gemellari o multiple, o ad infezioni contratte in epoca precoce di gravidanza (TORCH), s. antifosfolipidi, fenilchetonuria, abuso di alcool, fumo, droghe, scarsa alimentazione, condizioni economiche disagiate, alterazioni placentari . Le sequele post-natali possono essere molto serie specialmente a carico del SNC (15-17).
- IUGR simmetrico non patologico: se la causa rientra fra fattori costituzionali ereditari, la prognosi neonatale è buona (18-20).
- Anomalie morfologiche
- Variazioni di volume della placenta
- Anomalie di inserzione del cordone
- Patologie di inserzione della placenta
- Placenta nelle gravidanze multiple
- Placenta nell’eritroblastosi fetale
- Flogosi placentari
- Disordini vascolari della placenta
- Patologie del cordone ombelicale
- Patologie delle membrane fetali
- Senescenza placentare
- Alterazioni funzionali
Fumo in gravidanza e IUGR: nonostante la consapevolezza degli effetti nocivi del fumo in gravidanza e non, il 25% delle gravide non riesce a smettere di fumare in gravidanza. Il fumo di sigaretta (e generalmente di  tabacco), è una miscela di gas (87%), vapori (5%) e particelle solide sospese (8%). La maggior parte delle sostanze potenzialmente cancerogene è contenuta nel “catrame”, ovvero nel residuo del fumo ottenuto per allontanamento dell’acqua e della nicotina. Il fumo derivante dalla combustione di una sigaretta contiene oltre 4.000 composti, alcuni dei quali possono danneggiare direttamente l’apparato respiratorio, ma anche indirettamente gli altri organi interni. Queste sostanze sono essenzialmente:
tabacco), è una miscela di gas (87%), vapori (5%) e particelle solide sospese (8%). La maggior parte delle sostanze potenzialmente cancerogene è contenuta nel “catrame”, ovvero nel residuo del fumo ottenuto per allontanamento dell’acqua e della nicotina. Il fumo derivante dalla combustione di una sigaretta contiene oltre 4.000 composti, alcuni dei quali possono danneggiare direttamente l’apparato respiratorio, ma anche indirettamente gli altri organi interni. Queste sostanze sono essenzialmente:
- nicotina, contenuta nelle foglie della pianta del tabacco
- monossido di carbonio, prodotto dalla combustione, che interferisce con il trasporto di O2 a livello dell’emoglobina e determina, nonostante la sua minima quantità, leggera ipossiemia.
- idrocarburi policiclici aromatici (IPA), provenienti dalla combustione sia della carta sia del tabacco.
- sostanze irritanti (acroleina, acetaldeide), che bloccano l’epitelio ciliato a tutti i livelli dell’apparato respiratorio.
- sostanze ossidanti.
 La nicotina pura è un liquido incolore, che all’aria imbrunisce, acquisendo l’odore del tabacco.
La nicotina pura è un liquido incolore, che all’aria imbrunisce, acquisendo l’odore del tabacco.Conferisce aroma e sapore; viene per la maggior parte eliminata nell’aria, mentre una piccola quantità arriva ai polmoni, dai quali viene parzialmente assorbita, generalmente in una percentuale del 15-20% della quantità di nicotina presente nel fumo inspirato, per un totale di 1-2 mg per ogni sigaretta fumata. È un veleno fra i più potenti esistenti in natura, con particolare tropismo per i tessuti nervosi; iniettando in un uomo per via endovenosa la quantità di nicotina contenuta in 2-3 sigarette, se ne provoca la morte. L’effetto della nicotina, mediato dalla liberazione di catecolamine, endorfine, cortisolo e acidi grassi non esterificati, consiste in una percezione soggettiva di benessere e vivacità intellettuale. Aumenta il livello di dopamina nei circuiti cerebrali del piacere mediante inibizione della monoammino-ossidasi (MAO), responsabile della degradazione della dopamina. Aumenta inoltre la frequenza cardiaca, la pressione arteriosa e riduce l’appetito. La nicotina induce un incremento del 15% della secrezione di HCl (acido cloridrico) da parte della mucosa gastrica. Questa potrebbe essere la ragione per cui il desiderio di sigaretta aumenta dopo i pasti, specie se abbondanti.In dosi elevate provoca nausea e vomito.
Gravidanze multiple e IUGR
Gestazioni multiple hanno un rischio del 25% di IUGR in gravidanze gemelle e un rischio del 60% per le gravidanze multiple. Inoltre, le gravidanze monocoriali costituiscon un ulteriore rischio di restrizione della crescita fetale (IUGR asimmetrico) a causa della twin transfusion syndrome (207-212).
Gestosi, Preclampsia e IUGR:
Il flusso ematico utero-placentare aumenta in gravidanza soprattutto mediante dilatazione dei vasi interessati. La mancata dilatazione dei vasi utero-placentari è il punto cruciale sia del ridotto accrescimento fetale (IUGR) che della gestosi, nonostante il fatto che esse siano due distinte entità patologiche. Normalmente, in gravidanza, le arterie uteroplacentari sono invase dal trofoblasto, rimodellate e dilatate al di fuori di ogni controllo vasomotorio materno. I di sturbi di questo rimodellamento sono associate con alto Indice di resistenza (IR) delle aa. utero-placentari, IUGR e pre-eclampsia. I dati riesaminati suggeriscono che l’invasione trofoblastica endovascolare comporta una via laterale di invasione interstiziale che precede e prepara l’invasione trofoblastica endovascolare (213-237).
 Sindrome di Russell-Silver (RSS):è un raro disordine che si presenta alla nascita. E’ caratterizzata da uno scarso accrescimento dimostrato da un basso peso alla nascita e da una bassa statura. Poco si sa circa la causa di questa condizione e sul perchè alcuni bambini con IUGR abbiano caratteristiche specifiche della RSS ed altri non le abbiano. Le caratteristiche fisiche sono spesso non chiare finchè non venga raggiunto il primo anno di vita. Durante una visita, possono essere rilevate alcune delle seguenti caratteristiche:
Sindrome di Russell-Silver (RSS):è un raro disordine che si presenta alla nascita. E’ caratterizzata da uno scarso accrescimento dimostrato da un basso peso alla nascita e da una bassa statura. Poco si sa circa la causa di questa condizione e sul perchè alcuni bambini con IUGR abbiano caratteristiche specifiche della RSS ed altri non le abbiano. Le caratteristiche fisiche sono spesso non chiare finchè non venga raggiunto il primo anno di vita. Durante una visita, possono essere rilevate alcune delle seguenti caratteristiche:
- Volto piccolo di forma triangolare con mascella piccola e mento a punta.
- Bocca che tende ad incurvarsi verso il basso.
- Sfumatura blu nelle sclere (la parte bianca degli occhi).
- Testa di grandezza normale, che però appare troppo grande se comparata alla grandezza del
- corpo.
- Il mignolo di tutte e due le mani può essere corto ed incurvato verso l’interno.
- Asimmetria corporea.
La pubertà in questi bambini tende a cominciare nel periodo normale, ma talvolta può cominciare in anticipo. Lo scatto di crescita puberale può essere meno anticipato, con il risultato che l’altezza adulta finale può essere inferiore rispetto a quanto ci si sarebbe aspettato. Se la pubertà comincia troppo presto (meno di 9 anni nelle femmine e meno di 10 anni nei maschi), rallentarla con un trattamento ormonale può aiutare i bambini a crescere di più (307,308).
- esame obiettivo della gravida,
- calcolo del peso fetale (a suo volta ricavato dalla misura del DBP, circonferenza addominale e lunghezza femore -con riferimento a CRL o DTC del 1° trimestre-),
- Volumetria placentare
- flussimetria a. ombelicale, a. cerebrale media, aorta e dotto venoso di Aranzio
- quantità di liquido amniotico
- HPL
La cardiotocografia e il profilo biofisico fetale hanno una limitata accuratezza diagnostica (88-90).
1. Esame obiettivo: la palpazione addominale, come per la II manovra di Leopold, per valutare il peso fetale ha un’accuratezza diagnostica limitata con una percentuale  di falsi negativi del 50-70% a seconda dell’esperienza del ginecologo.
di falsi negativi del 50-70% a seconda dell’esperienza del ginecologo.
La misurazione della distanza sinfisi pubica-fondo uterino, effettuata su paziente sdraiata in posizione supina, con il metro dalla faccia superiore della sinfisi al polo superiore del globo uterino seguendo la curvatura dell’addome gravido. Il fondo dell’utero sale di circa 1 cm a settimana. Alla 22a settimana la distanza sinfisi-fondo misura 20-24 cm, alla 25a w (6° mese) il fondo dell’utero raggiunge la linea ombelicale trasversa mentre alla 38a w raggiunge l’apofisi xifoidea. Questa misura diagnostica ha una sensibilità del 27% ed una specificità dell’88% nel predire il peso fetale (91-95).
2. Peso fetale: costituisce il parametro fondamentale per la valutazione della crescita  fetale. il peso fetale è il parametro che per primo si manifesta come deficitario insieme alla circonferenza addominale (CA); solo in un secondo momento si manifesta deficit della lunghezza fetale e solo per ultimo si manifesta deficit di crescita della circonferenza cranica.
fetale. il peso fetale è il parametro che per primo si manifesta come deficitario insieme alla circonferenza addominale (CA); solo in un secondo momento si manifesta deficit della lunghezza fetale e solo per ultimo si manifesta deficit di crescita della circonferenza cranica.
Un feto con peso <10° percentile si definisce SGA (Small for Gestational Age) ma non sempre un feto SGA è IUGR. Infatti solo il 30% dei feti SCA è IUGR mentre il restante 70% dei feti SGA sono costituzionalmente piccoli. Per l’OMS si definisce SGA un neonato con peso <2.500 gr.
Il calcolo del peso fetale è ricavato secondo formule che utilizzano diversi parametri fetali ricordando che l’uso della combinazione di 2 parametri migliora l’accuratezza di circa il 5% rispetto al parametro singolo mentre l’ulteriore aggiunta di uno o più parametri apporta un miglioramento dell’1% circa. Tutte le formule, infine, tendono a sovrastimare i pesi bassi e a sottostimare quelli più elevati (96-113).
- formula di Campbell e Wilkin: utilizza la sola circonferenza addominale (CA) per calcolare il peso fetale
- formula di Shepard prevede l’utilizzo della circonferenza addominale (CA) e Diametro Biparietale (DBP)
- formula di Hadlock preferibile per i feti SGA; si avvale della misura di CA, circonferenza cranica (CC) e lunghezza del femore.
Tuttavia la somma degli errori casuali delle misure elevati al quadrato o al cubo dalle formule introducono un errore medio di circa il 10% per cui la stima del peso fetale dovrà essere sempre valutato con un range di variabilità di ± 150 gr. La corrispondenza della biometria succitata con l’epoca gestazionale deve essere confortata dalla misurazione del CRL a 10-12 w che in quest’epoca si correla perfettamente con l’epoca gestazionale e costituisce un punto fermo di riferimento per la valutazione dell’epoca gestazionale. Infatti dalla 8a alla 12a settimana la lunghezza del feto aumenta molto rapidamente, con grandi differenze di valori tra una settimana e la successiva e un range di normalità molto stretto per ciascuna settimana. La misurazione del diametro trasverso del cervelletto (DTC) può supplire egregiamente la misura del CRL in caso di difficoltà a misurare in modo soddisfacente il CRL. La valutazione di DBP, CA, e CRL prima delle 10 settimane come pure il diametro medio della camera gestazionale possono essere di aiuto, completano e rafforzano l’indagine ma non sono sufficientemente accurate come il CRL a 10-12 w.
Il calcolo del peso fetale in genere è effettuato da un apposito software installato sull’ecografo. Importante è stabilire una curva di crescita, basata su almeno 4 misurazioni effettuate nel I° trimestre e alla 22a, 32a e 36a settimana.
La normale evoluzione della curva di crescita del peso fetale e non l’analisi puntiforme di una valutazione ecografica, può condurre ad una diagnosi di normale o patologica crescita fetale. Il termine difetto di crescita intrauterino (“Intra Uterine Growth Restriction” IUGR) deve quindi essere riservato a quei feti nei quali è dimostrata l’evidenza di una anomala riduzione di crescita rispetto ai valori osservati in precedenti scansioni ecografiche eseguite almeno 21 giorni prima. In tal modo è possibile escludere i feti costituzionalmente piccoli per razza o familiarità (98-111). Ci sono ovviamente alcune situazioni, come la minaccia di parto pretermine, la presentazione podalica, la paziente diabetica o la pregressa cesarizzata, nelle quali il clinico può giovarsi del dato singolo del peso da utilizzare estemporaneamente.
Per lungo tempo il feto IUGR è stato identificato basandosi sul peso alla nascita, classificando i neonati come piccoli per l’epoca gestazionale (SGA <10° centile), appropriati per l’epoca gestazionale (AGA 10°-90° centile) e grandi per l’epoca gestazionale (LGA >90° centile). Questo concetto di equivalenza fra IUGR e SGA si è rivelato errato perchè, come già detto, alcuni bambini SGA sono costituzionalmente piccoli ma esenti da patologie e, di contro, molti problemi neurologici, a lungo e breve termine, si verificano in bambini anche con peso appropriato (111).
Circonferenza Cranica (CC) viene misurata in scansione trans-talamica sull’estremo cefalico fetale, usando come punti di repere la linea mediana, il cavo del setto pellucido e il talamo.
La circonferenza cranica può essere misurata nella stessa scansione del DBP e DOF seguendo il contorno dell’ ellissoide individuato dai due diametri o calcolato a partire da queste due misure lineari secondo la formula degli ellissoidi: CC= (DBP + OF) x 3.14/2.
Il vantaggio di misurare la circonferenza cranica rispetto al solo diametro biparietale deriva dall’evidenza che le variazioni della forma della testa fetale (brachicefalia, dolicocefalia) possono inficiare la misura di un singolo diametro, ma non incidono significativamente sulla misura della circonferenza ottenuta da entrambi i diametri.
CA, Circonferenza Addominale: si misura su un piano esattamente perpendicolare all’asse longitudinale del feto subito al di sopra dell’inserzione ombelicale. Essa deve comprendere stomaco, vertebra e vena ombelicale all’ingresso del sistema portale nel fegato (31-36). Anche in questo caso la misura può essere effettuata seguendo il contorno circolare della sezione dell’addome fetale o secondo la formula che integra il diametro trasverso e il diametro posteriore: CA= (D1 + D2) x 3,14/2.
La circonferenza addominale, insieme al peso fetale, è il parametro che più precocemente si discosta dalla norma in caso di ridotta crescita fetale in quanto espressione di fegato ipotrofico, pannicolo adiposo scarsamente sviluppato mentre la crescita cefalica rimane lungamente invariata in quanto privilegiata dagli adattamenti circolatori e metabolici (112-118).
CC/CA: Il rapporto tra circonferenza cranica e circonferenza addominale (CC/CA) serve a definire lo sviluppo armonico del feto, a distinguere i difetti di crescita in simmetrici e asimmetrici, costituisce inoltre uno dei parametri nella valutazione delle patologie malformative a carico dell’estremo cefalico (microcefalia, idrocefalia, etc.). Fino alla 36a settimana la crescita fetale seppure armonica, privilegia la testa e le ossa lunghe; da tal epoca in poi invece sarà la circonferenza addominale che in proporzione crescerà maggiormente (112-118).
Femore: si misura posizionando i caliper sulle estremità diafisarie, a margini netti, possibilmente in posizione leggermente obliqua rispetto al trasduttore. Anche la misura del femore contribuisce ad una valutazione della 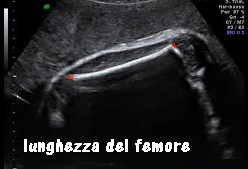 crescita armonica del feto; rapportata alla circonferenza cranica rappresenta uno dei parametri per la valutazione delle patologie malformative della testa e delle displasie scheletriche. La lunghezza del femore è utilizzata nella formula di Hadlock che si avvale della CA, CC e FL per calcolare il peso fetale nei feti SGA molto piccoli. (112-118).
crescita armonica del feto; rapportata alla circonferenza cranica rappresenta uno dei parametri per la valutazione delle patologie malformative della testa e delle displasie scheletriche. La lunghezza del femore è utilizzata nella formula di Hadlock che si avvale della CA, CC e FL per calcolare il peso fetale nei feti SGA molto piccoli. (112-118).
La lunghezza fetale si calcola in genere moltiplicando x 6 la lunghezza del femore in cm ed aggiungendo quattro.
Qualora si abbia la necessità o si sia nella possibilità di eseguire altri esami si tenga presente che l’errore della biometria ecografica è stato stimato nell’ordine del 3% pertanto sarà inutile ripetere le misure ecografiche entro 12-5 giorni, che rappresentano l’intervallo di crescita che consente di apprezzare i caratteri della crescita stessa, nonostante l’errore random delle misure.
3. Stima del Volume placentare (EPV): il volume placentare può essere ecograficamente misurato dalla 7a alla 36a settimana; a fine gravidanza la misurazione del volume placentare (EPV) è difficoltosa a causa dell’eccessiva larghezza di impianto della placenta. L’EPV dipende in gran parte dalla sua irrorazione, HPL e PIGF. Un ridotto volume placentare equivale a scarsa irrorazione e è predittivo di IUGR specialmente nel II° trimestre mentre nel I° trimestre si è riscontrata una stretta correlazione fra volume placentare e concentrazione sierica materna di vitamina D, proteina PAPP-A , fattore di crescita placentare (PIGF) e crescita fetale. La larghezza massima è misurata da punta a punta (giallo). L’altezza e la spessore (arancio) sono gli stessi e vengono misurati una volta per ottenere entrambi i valori. Il volume è uguale a base x spessore x altezza (114-136).
4. Flussimetria aa. ombelicali: La flussimetria del versante fetale si avvale dello studio delle arterie ombelicali, dell’aorta fetale, delle arterie cerebrali medie e del dotto venoso e deve essere effettuata con feto in stato di quiete.
Lo studio della elasticità delle arterie ombelicali deve essere effettuato ponendo il volume campione ad alcuni centimetri di distanza dall’inserzione placentare. I dati derivanti da distretti iuxta-placentari risultano più stabili e riproducibili giacché la placenta va incontro a modificazioni lenti, basate prevalentemente su fattori strutturali più che umorali e nervosi. Al contrario il segnale derivante da un distretto iuxta fetale è estremamente variabile in conseguenza dei fattori umorali ed endocrini del feto stesso e delle sue condizioni emodinamiche del momento (164,165). Anche per questo distretto arterioso come per ogni altro dato flussimetrico si deve porre molta attenzione nell’eseguire una rilevazione con un angolo di insonazione favorevole e quindi preferibilmente al di sotto dei 60º. In particolare bisogna evitare di registrare il segnale durante l’attività respiratoria giacché in tali condizioni il profilo del’onda diventa irregolare (164-170).
I parametri comunemente utilizzati per la flussimetria fetale sono:
- umbilical arterial S/D ratio (SDR): systolic velocity / diastolic velocity
- pulsatility index (PI) (Gosling index): (PSV – EDV) / TAV
- resistive index (RI) (Pourcelot index): (PSV – EDV) / PSV
- PSV: peak systolic velocity
- EDV: end diastolic velocity
- TAV: time averaged velocity
- IR (Index Resistance): L’indice di resistenza è quello con la migliore capacità predittiva di esito negativo. Abbastanza alto inizialmente (circa 0,80) subisce con il proseguire della gravidanza una graduale riduzione, indice di benessere fetale, raggiungendo verso il termine valori di circa 0.60 o anche meno. La diminuzione dell’indice di resistenza indica una diminuzione delle resistenze placentari favorendo così il flusso ematico. IR e PI dell’a. ombelicale alla 28ª settimana, in gravidanze a rischio per il ritardo di crescita intrauterina (IUGR), presentano una specificità e sensibilità piuttosto limitate con una accuratezza del 57.6%.
- PI (Pulsatility Index): valori normali nel III° trimestre si attestano su 0.9 mentre indici più bassi sono espressione del “brain sparing effect” finalizzata ad un adeguamento della ossigenazione dei tessuti cerebrali, surrenalici e cardiaci fetali in risposta allo stimolo ipossico cronico.
AED, REDF: L’osservazione di flusso tele-diastolico assente (Absent end Diastolic Flow, AED) o invertito (Reversed end Diastolic Flow, REDF) in arteria ombelicale costituisce un fattore di rischio elevato per mortalità prenatale. Occorre però ricordare che le alterazioni flussimetriche dell’a.ombelicale compaiono solo in una fase tardiva di sofferenza fetale e centralizzazione del circolo. Il tempo che intercorre tra la la comparsa di decelerazioni tardive all’esame cardiotocografico e l’osservazione di flusso diastolico assente o invertito è variabile da uno a sei giorni (171-176).
Classificazione della gravità: nei feti IUGR la forma d’onda della velocità del sangue dell’arteria ombelicale cambia di norma in modo progressivo come segue:
- Riduzione del flusso diastolico finale: aumento dei valori RI, dei valori PI e del rapporto S / D
- Flusso diastolico finale assente (AEDF): RI = 1
- Inversione del flusso diastolico finale (REDF)
5. Dotto venoso di Aranzio: Questa struttura, anche se poco studiata, rappresenta uno dei distretti vascolari di maggiore importanza sia per la fisiologica crescita fetale sia per il meccanismo di compenso nei casi di ipossia. Esso è localizzato alla curvatura della vena ombelicale prima che questa pieghi a destra dell’addome fetale per congiungersi con il ramo sinistro della vena porta. Il suo diametro varia con l’età gestazionale e allo stesso modo la possibilità che venga reperito in una scansione standard dell’addome fetale si riduce man mano che l’età gestazionale avanza. Oltre la 30ª settimana la struttura presenta delle notevoli variazioni di dimensioni nel corso del periodo di osservazione. In altri termini tende a rilasciarsi e a restringersi, contraendosi in seguito a stimoli di varia natura. Di certo sappiamo che esso è ben innervato, è sensibile alle variazioni di ossigeno.
La valutazione ecografica del flusso del dotto venoso può essere di ausilio in una serie di situazioni critiche fetali; le più comuni sono:
- Screening del I° trimestre per anomalie aneuploidiche
- Screening del II° trimestre per sospetto IUGR o SGA
- Patologie cardiache fetali
Di tutte le vene pre-cardiali, il ductus venosus permette l’interpretazione più accurata della funzione cardiaca fetale e dell’emodinamica del miocardio. Il dotto venoso rappresenta il primo e più importante meccanismo messo in atto dal feto in condizioni di deprivazione. Qualora incontrasse un periodo di riduzione ossigenativa durante il IIº trimestre di gravidanza il feto tenderebbe ad aprire stabilmente il dotto venoso e shuntare la circolazione epatica tendendo ridurre drasticamente il passaggio di sangue nel ramo sinistro della vena porta. Questo meccansimo è alla base del profilo disauxologico noto come IUGR asimmetrico (o sproporzionato o late flattening).
Enorme importanza di tale meccanismo è che esso avviene prima che si instauri la centralizzazione del circolo. Si può pertanto facilmente comprendere che nel periodo della riapertura del dotto ci troviamo ancora in una fase di assoluto compenso in cui abbiamo tempo per organizzare e predisporre tutto quanto riteniamo opportuno per l’ottimare svolgersi della gravidanza. (190-193). La maggiore limitazione risiede nella scarsa riproducibilità dei dati tra operatore ed operatore, apparecchiatura e momento; si è infatti già detto che il dotto venoso non è una struttura statica ma è caratterizzata da continue variazioni di calibro in diverse condizioni fisiologiche.
Tecnica
Il feto dovrebbe essere il più possibile in stato di quiete
La sonda è idealmente focalizzata in modo che il campionamento sia fatto in prossimità della confluenza della vena ombelicale nel dotto venoso
Si dovrebbe ottenere una scansione sagittale destra in cui si visualizzi la vena ombelicale, il ductus venosus e il cuore fetale
La sonda è idealmente angolata per consentire un piano medio sagittale o un piano trasversale obliquo attraverso l’addome fetale
L’immagine dovrebbe essere ingrandita il più possibile in modo da occupare l’intero schermo
Non contaminare il flusso del dotto con il flusso dalla vena cava inferiore fetale
L’angolo di insonazione dovrebbe essere di 30°
La velocità di spazzamento deve essere alta (2-3 cm / s) in modo che le forme d’onda siano diffuse permettendo una migliore valutazione dell’onda a
Su ultrasuoni Doppler il flusso nel dotto ha una forma d’onda trifasica caratteristica dove in una normale situazione fisiologica il flusso deve sempre essere nella direzione avanzata (cioè verso il cuore fetale).
Questa forma d’onda trifasica comprende:
Onda S: corrisponde alla contrazione sistolica ventricolare/rilasciamento atriale fetale ed è il picco più alto
Onda D: corrisponde alla diastole ventricolare fetale ed è il secondo picco più alto. Cresce progressivamente fino a termine di gravidanza e, in questo periodo, uguaglia e talvolta supera per durata l’onda S.
Onda A: corrisponde alla contrazione atriale fetale ed è il punto più basso dell’onda trifasica; è una breve e profonda incisura dovuta al brusco rallentamento della direzione anterograda del flusso (177-185).
La velocità media e la velocità di picco tendono a salire nel corso della gravidanza in relazione inversa a quanto accade per le dimensioni del dotto.
6. Arterie uterine: La valutazione del flusso delle aa. uterine è una parte importante della valutazione del benessere del feto e della sua crescita normale.
In uno stato non gravido e all’inizio della gravidanza il flusso nell’arteria uterina è di elevata pulsatilità con un elevato flusso sistolico e basso flusso diastolico.
In gravidanza la resistenza al flusso sanguigno diminuisce gradualmente con l’epoca gestazionale in quanto si verifica una maggiore invasione trofoblastica del miometrio. Una resistenza anormalmente elevata può persistere nella preeclampsia e nell’IUGR. Se la resistenza è bassa, ha un eccellente valore predittivo negativo con una probabilità inferiore all’1% di sviluppare la preeclampsia o avere IUGR. Un’alta resistenza spesso equivale ad una probabilità del 70% di pre-eclampsia e del 30% di IUGR (186-189).
7. Arteria cerebrale media: in caso di ritardo di crescita il feto ridistribuisce il flusso di sangue verso quegli organi che necessitano maggiormente di ossigeno e nutrienti per svilupparsi correttamente, come il cuore ed il sistema nervoso centrale. Tale processo è chiamato centralizzazione del circolo (brain sparring effect). Per questo motivo si assiste ad una dilatazione dell’arteria cerebrale media con aumento del flusso diastolico al fine di aumentare l’apporto di ossigeno e nutrienti. Da un punto di vista clinico la modificazione dell’arteria cerebrale media dimostra che il feto sta cercando di compensare il ridotto apporto di ossigeno (194-197). Tuttavia, questo dato è un segno molto tardivo della compromiaaione del benessere fetale ed è significativamente associato al rischio di sviluppare gravi complicazioni del SNC fetale.
8. Liquido amniotico: Altro criterio di valutazione funzionale è la stima della quantità di liquido amniotico. Il liquido amniotico è prodotto al 90% dalla diuresi fetale; il meccanismo che porta alla “centralizzazione del circolo” può comportare, in modi e tempi diversi per ciascun feto, una riduzione della diuresi fetale e oligoamnios (198-200).
Amniotic Fluid Index (AFI): è il parametro più comunemente utilizzato per valutare la quantità di liquido amniotico. Si misura il diametro massimo delle falde liquide nei quattro quadranti uterini e la somma che ne consegue forma un indice di riferimento (valori normali ≥ 50 mm); AFI < 5 cm o tasca massima <2 cm sono frequentemente associati a forme medio-gravi di IUGR (201-205) .
9. HPL (Human Placental Lactogen): ormone glicoproteico composto da 190 aminoacidi prodotto quasi esclusivamente dal sincizio-trofoblasto. L’HPL esercita un’importante ruolo nel metabolismo glicidico, lipidico e proteico materno e fetale e quindi è direttamente interessato nella crescita fetale. A digiuno esplica un effetto diabetogeno (neo-glucogenesi) ed esalta la lipolis. Dopo i pasti esalta l’azione dell’insulina e inibisce la lipolisi e la neoglucogenesi. I geni per la sua sintesi sono tre e sono allocati nel braccio lungo del cromosoma 17. Il numero di alterazioni di tali geni si riflettono sul deficit della produzione di HPL. Un produzione di HPl <10% prevede una prognosi fetale infausta (“Fetal Danger Zone” di Spellancy). Oltre che dall’integrità genica, la produzione di HPL è correlata alla massa di trofoblasto attivo e all’irrorazione ottimale della placenta.
10. Dosaggio sierico della vitamina D – Numerosi studi hanno confermato che il 75% delle donne gravide ha una concentrazione sub-ottimale della vitamina D (238-243). La diminuita concentrazione plasmatica della vitamina D (v.n. 9.4-10.5 mg/dl) in gravidanza è associata con il rischio di alterato sviluppo della crescita fetale. parto pretermine e preeclampsia (244-252). La vitamina D è correlata alla crescita fetale attraverso il metabolismo del calcio, la crescita ossea e la funzionalità placentare (253-260).
L’ipocalcemia: c’è un’alta diffusione di ipocalcemia asintomatica nelle gravide di bassa estrazione sociale e condizioni economiche disagiate (279-283). L’ipocalcemia (v.n. 9.4-10.5 mg/dl) provoca un aumento dell’eccitabilità muscolare con sintomatologia correlata alla gravità dell’ipocalcemia. Tra i più precoci sintomi di ipocalcemia ricordiamo la sensazione di intorpidimento o formicolio attorno alla bocca, e di pizzicore e torpore delle dita; se l’ipocalcemia è più severa i formicolii si trasformano in crampi tetanici (mano da ostetrico, segno di Trosseau), fino alle convulsioni. Nelle condizioni più gravi insorgono tachicardia ed aritmie cardiache severe che, insieme al laringospasmo, possono mettere in pericolo la vita stessa della paziente. I sintomi di una lieve ipocalcemia cronica possono precipitare in condizioni quali gravidanza, stress emotivo o fisico ed allattamento (284-287).
11. TORCH
12. Equilibrio acido-base
MANAGEMENT e TERAPIA: l’aumentato rischio di ipossia fetale richiede attento e continuo monitoraggio clinico, strumentale e di laboratorio (30,31). Prevede una serie di misure terapeutiche ad esito incerto. Occorre predisporre il parto in ambiente protetto appena raggiunta la maturità polmonare fetale.
Vitamina D supplementazione – La carenza di vitamina D è prevalente nelle gravide nonostante la diffusa somministrazione in gravidanza di preparati multivitaminici (261), poiché questi contengono dosi di vitamina D troppo basse per aumentare significativamente le concentrazioni di 25-idrossivitamina D [25 (OH) D] (262). Le assunzioni dietetiche di vitamina D in gravidanza sono anch’esse inadeguate (263). Più della metà delle donne statunitensi riferiscono di adottare per la maggior parte del tempo precauzioni protettive dal sole, inclusi l’utilizzo di protezione solare o rimanere in luoghi non soleggiati o all’ombra (264), con evidente limitazione della sintesi di vitamina D.
E’ quindi giustificato il monitoraggio e la somministrazione supplementare di vitamina D nel III° trimestre (4.000 UI/die) escludendo le gravide con emorragie, abuso di droga o abuso di alcol, insufficienza renale, epatite attiva, ipertensione incontrollabile, idropsia fetale (m. di Gaucher) e anomalie fetali incompatibili con la vita (265-275). Recenti studi inoltre hanno dimostrato che la somministrazione di 4.000 UI di vitamina D nel III° trimestre di gravidanza riduce significativamente (30%) gli episodi di asma pediatrico o di respiro sibilante (wheezing) per il neonato (288-294).
Aspirina – Il trattamento di IUGR con aspirina a bassi dosaggi (100 mg/die) è stato valutato con risultati contraddittori, nonostante i numerosissimi studi siano stati condotti in proposito. La somministrazione precoce (dalla 13a settimana) sembra migliorare il processo di placentazione e quindi aver un benefico effetto sulla crescita fetale (295-303).
- Discussa è anche l’iperossigenazione materna
- Eparina a basso peso molecolare s.c. sembra efficace nel favorire l’irrorazione e la crescita del volume placentare (305)
- Resta terapeuticamente efficace il riposo assoluto a letto e l’ottimizzazione alimentare. con diete ricche di ac. grassi polinsaturi (Omega 3 e Omega 6) e scarsa di carboidrati semplici.
Assiduo controllo della gravidanza mediante:
- USG: biometria fetale, grading placentare, EPV, AFI
- Flussimetria aa. ombelicali, a. cerebrale media, dotto venoso di Aranzio, aorta addominale fetale, aa. uterine
- CTG e NST
- Controllo PA (Gestosi ipertensiva, pre-eclampsia)
- esami ematochimici di base con particolare riferimento alla funzione emocoagulatoria e renale.
- In caso di IUGR grave occorre programmare il parto appena raggiunta la piena maturità polmonare (che può essere accelerata mediante somministrazione di betametasone (12 mg/die x 3 volte ad intervalli di 3 giorni).
Bibliografia
- Manning FA, Hohler C. Intrauterine growth retardation: diagnosis, prognostication, and management based on ultrasound methods. In: Fleischer AC, et al., eds. The principles and practice of ultrasonography in obstetrics and gynecology. 4th ed. Norwalk, Conn.: Appleton & Lange, 1991:331–48.
- Bernstein I, Gabbe SG. Intrauterine growth restriction. In: Gabbe SG, Niebyl JR, Simpson JL, Annas GJ, et al., eds. Obstetrics: normal and problem pregnancies. 3d ed. New York: Churchill Livingstone, 1996:863–86
- Fetal growth restriction. In: Cunningham FG, et al., eds. Williams Obstetrics. 20th ed. Stamford, Conn.: Appleton & Lange, 1997:839–54.
- Miller J, Turan S, Baschat AA. Fetal growth restriction. Semin Perinatol 2008;32:274-80.
- Bracalente G., D’Ottavio G., Periti E., Ferrazzi E., Torcia F., Valensise H. e Viora E.: Risultati del Gruppo di Studio SIEOG: Screening del ritardo di crescita intrauterino. ECO ’94. Atti Congresso Nazionale SIEOG. CIC Edizioni Internazionali, Roma 1994.
- Manara L.R.: Intrapartum fetal morbidity and mortality in intra uterine growth retarded infants. J. Am. Osteopath. Assoc. 80: 101, 1980.
- Anne-Karen von Beckerath; Martina Kollmann, Christa Rotky-Fast, Eva Karpf, Uwe Lang, PhD; Philipp Klaritsch: “Perinatal complications and long-term neurodevelopmental outcome of infants with intrauterine growth restriction”. Am J Obstet Gynecol 2013;208:130.e1-6.
- Resnik R. Intrauterine growth restriction. Obstet Gynecol 2002;99:490-6
- Arcangeli T, Thilaganathan B, Hooper R, Khan KS, Bhide A. Neurodevelopmental delay in small babies at term. A systematic review. Ultrasound Obstet Gynecol 2012; 40:267-75.
- Resnik R. Intrauterine growth restriction. Obstetr Gynecol 2002;99:490-6.
- RK Creasy, R Resnik. Maternal-fetal medicine. Saunders 2005. 26:465-481.
- Creasy RK, Resnik R. Intrauterine growth restriction. In: Creasy RK, Resnik R, eds. Maternal-fetal medicine: principles and practice. 3d ed. Philadelphia: Saunders, 1994:558–74.
- Battaglia F.C. and Lubchenco L.O.: A practical classification of newborn infants by weight and gestational age. J. Pediatr., 71: 159, 1967.
- Brar HS, Rutherford SE: Classification of intrauterine growth retardation. Semin Perinatol. 1988 Jan;12(1):2-10.
- Pollack RN, Divon MY. Intrauterine growth retardation: definition, classification, and etiology.
Clin Obstet Gynecol. 1992 Mar; 35(1):99-107.- Holtorff J. [Retarded fetal growth. Attempt at an etiological-pathogenetic and clinical classification]. Zentralbl Gynakol. 1983; 105(13):817-30.
- Cheng, Y., Leung, T., Lao, T., Chan, Y., and Sahota, D. Impact of replacing Chinese ethnicity-specific fetal biometry charts with the INTERGROWTH-21st standard. BJOG Int J Obstet Gynaecol. 2016; 123: 48–55
- Balcazar H, Haas J Classification schemes of small-for-gestational age and type of intrauterine growth retardation and its implications to early neonatal mortality. Early Hum Dev. 1990 Dec;24(3):219-30.
- Larsen T., Larsen J.F., Petersen S. et al: Detection of small-for-gestational-age fetuses by ultrasound screening in a high risk population: a randomized controlled study. Br. J. Obstet. Gynecol., 99: 469, 1992.
- Anderson, N., Sadler, L., Stewart, A., and McCowan, L. Maternal and pathological pregnancy characteristics in customised birthweight centiles and identification of at-risk small-for-gestational-age infants: a retrospective cohort study: maternal characteristics in customised birthweight centiles. BJOG Int J Obstet Gynaecol. 2012; 119: 848–856
- Anderson, N., Sadler, L., Stewart, A., and McCowan, L. Maternal and pathological pregnancy characteristics in customised birthweight centiles and identification of at-risk small-for-gestational-age infants: a retrospective cohort study: maternal characteristics in customised birthweight centiles. BJOG Int J Obstet Gynaecol. 2012; 119: 848–856
- Ghi, T., Cariello, L., Rizzo, L. et al. Customized fetal growth charts for parents characteristics, race, and parity by quantile regression analysis: a cross-sectional multicenter Italian study. J Ultrasound Med. 2016; 35: 83–92
- Neerhof MG. Causes of intrauterine growth restriction. Clin Perinatol. 1995;22:375–85.
- Kanaka-Gantenbein C, Mastorakos G, Chrousos GP. Endocrine-related causes and consequences of intrauterine growth retardation. Ann N Y Acad Sci 2003;997:150-7.
- Ergaz Z, Avgil M, Ornoy A. Intrauterine growth restriction-etiology and consequences: what do we know about the human situation and experimental animal models? Reprod Toxicol 2005;20:301-22
- Robinson JS, Moore VM, Owens JA et al. Origins of fetal growth restriction. Eur J Obstet Gynecol Reprod Biol 2000;92:13-9.
- De Sanctis L, Memo L, Pichini S et al. Fetal alcohol syndrome:new perspectives for an ancient and underestimated problem. J Matern Fetal Neonatal Med 2011;1:34-7
- Jones KL, Smith DW. Recognition of the fetal alcohol syndrome in early infancy. Lancet 1973;2:999-1001.
- Donnelly EH, Smith JM, Farfán EB et al. Prenatal radiation exposure: background material for counseling pregnant patients following exposure to radiation. Disaster Med Public Health Prep 2011;5:62-8.
- Goel P, Radotra A, Singh I et al. Effects of passive smoking on outcome in pregnancy. J Postgrad Med 2004;50:12-16
- Kharrazi M, DeLorenze GN, Kaufman FL et al. Environmental tobacco smoke and pregnancy outcome. Epidemiology 2004;15:660-70
- Lieberman E, Gremy I, Lang JM et al. Low birthweight at term and the timing of fetal exposure to maternal smoking. Am J Public Health 1994;84:1127-31.
- Shaima M,Almasry,Amr K. Elfayomy.Morphometric analysis of terminal villi and gross morphological changes in the placentae of term idiopathic intrauterine growth restriction..Tissue and Cell.2012.44:214-219.
- Samantha Benton et al: “Low maternal placental growth factor is associated with abnormal placental morphology in fetuses with suspected intrauterine growth restriction”. September 2014Volume 35, Issue 9, Page A44
- Neil M. Gude, Claire T. Roberts, Bill Kalionis, Roger G. King: “Growth and function of the normal human placenta” Thrombosis Research. Volume 114, Issues 5–6, 2004, Pages 397–407
- Gude NM1, Roberts CT, Growth and function of the normal human placenta. Kalionis B, King RG. Thromb Res. 2004;114(5-6):397-407.
- Lal Baksh Khaskhelli, Samreen Memon, Pushpa Goswami, Shamshad Bano Change in Normal Morphology of Placenta and Its Possible Effects on Fetal Outcome in Diabetic Mothers as Compared to Non-Diabetic Mothers JLUMHS JANUARY-APRIL 2013; Vol 12: No. 01
- Romero-Gutiérrez G, González-Ramos R, Valadez-Ortega MA, Bribiesca-López JA: “Perinatal morbimortality associated with placental senescence”. Ginecologia y Obstetricia de Mexico [1997, 65:8-12]
- Faye-Petersen, O. M. , D. S. Heller , and V. V. Joshi . Handbook of Placental Pathology. 2nd ed. London, England: Taylor and Francis; 2006.
- Gruenwald P. Chronic fetal distress and placental insufficiency.Biol Neonate 1963;5:215-221.
- Redline R.W.Placental pathology: a systematic approach with clinical correlations.Placenta 2007;18:1-6.
- Grantz, K.L., Grewal, J., Albert, P.S. et al. Dichorionic twin trajectories: the NICHD Fetal Growth Studies. Am J Obstet Gynecol. 2016; 215: 221.e1–221.e16
- Mayhew TM, Jackson MR, Boyd PA (1993) Changes in oxygen diffusive conductances of human placentae during gestation (10-41 weeks) are commensurate with the gain in fetal weight. Placenta 14:51–61
- Maternal serum placental growth factor (PlGF) in small for gestational age pregnancy at 11(+0) to 13(+6) weeks of gestation.
- Clausen I. Umbilical cord anomalies and antenatal fetal demise. Obstet Gynecol Surv.1989; 44: 841-5.
- Poon LC, Zaragoza E, Akolekar R, Anagnostopoulos E, Nicolaides KH: Maternal serum placental growth factor (PlGF) in small for gestational age pregnancy at 11(+0) to 13(+6) weeks of gestation. Prenat Diagn. 2008 Dec; 28(12):1110-5.
- Puccio G, Giuffré M, Piccione M et al. Intrauterine growth restriction and congenital malformations: a retrospective epidemiological study. Ital J Pediatr. 2013;39:23.
- Malik S, Cleves MA, Zhao W et al. Association between congenital heart defects and small for gestational age. Pediatrics 2007;119:e976-82
- Miller DT, Adam MP, Aradhya S et al. Consensus Statement: Chromosomal Microarray Is a First-Tier Clinical Diagnostic Test for Individuals with Developmental Disabilities or Congenital Anomalies. Am J Human Genet 2010:86;749-64.
- Warman ML, Cormier-Daire V, Hall C et al. Nosology and classification of genetic skeletal disorders: 2010 revision. Am J Med Genet A 2011;155:943-68
- Mosca-Boidron AL, Bouquillon S, Faivre L et al. What can we learn from old microdeletion syndromes using array-CGH screening? Clin Genet 2012:82:41-7
- Williams MC, et al. Histologic chorioamnionitis is associated with fetal growth restriction in term and preterm infants. Am J Obstet Gynecol. 2000;183(5):1094-1099.
- Dumont M et Brunet C. : “Maladies infectieuses et grossesse”. Encycl Med Chir (Elsevier, Paris). Obstétrique,5039-A-10, 1969: 2 p
- Zerlotin G: Malattie infettive e gravidanza, Gynecoline_net 2005, pagg. 1-3
- Chambers C.D. et al: “Maternal fever and birth outcome: a prospective study”. Teratology 1998;58:251-257.
- Ministero della Salute. Dati ISTAT 2005.
- .G. Noia, L. Masini1, M. De Santis, M. Scavo, F. Pomini, R. Grillo, P. Cattani, O. Ranno, A. Caruso and S. Mancuso: “Fetal Infection from Rubeovirus or Cytomegalovirus: Correlation Among Maternal Serological Profiles, Invasive Diagnostic Procedures, and Long-Term Follow-up”. Journal of Maternal-Fetal and Neonatal Medicine; 1998, Vol. 7, n°1, Pages 36-42
- Centers for Disease Control and Prevention (CDC). Three cases of congenital rubella syndrome in the postelimination era–Maryland, Alabama, and Illinois, 2012. MMWR Morb Mortal Wkly Rep. 2013 Mar 29;62:226-9.
- White SJ, Boldt KL, Holditch SJ, Poland GA, Jacobson RM. Measles, mumps, and rubella. Clin Obstet Gynecol. 2012 Jun;55(2):550-9.
- Cordier AG, Vauloup-Fellous C, Grangeot-Keros L, Pinet C, Benachi A, Ayoubi JM, Picone O. Pitfalls in the diagnosis of congenital rubella syndrome in the first trimester of pregnancy. Prenat Diagn. 2012 May;32(5):496-7.
- Migliucci A, Di Fraja D, Sarno L, Acampora E, Mazzarelli LL, Quaglia F, Mallia Milanes G, Buffolano W, Napolitano R, Simioli S, Maruotti GM, Martinelli P. Prenatal diagnosis of congenital rubella infection and ultrasonography: a preliminary study. Minerva Ginecol. 2011 Dec;63(6):485-489.
- Duszak RS. Congenital rubella syndrome–major review. Optometry. 2009 Jan;80(1):36-43.
- Best JM. Rubella. Semin Fetal Neonatal Med. 2007 Jun;12(3):182-92.
- De Santis M, Cavaliere AF, Straface G, Caruso A. Rubella infection in pregnancy. Reprod Toxicol. 2006 May;21(4):390-8.
- Mendelson E, Aboudy Y, Smetana Z, Tepperberg M, Grossman Z. Laboratory assessment and diagnosis of congenital viral infections: Rubella, cytomegalovirus (CMV), varicella-zoster virus (VZV), herpes simplex virus (HSV), parvovirus B19 and human immunodeficiency virus (HIV). Reprod Toxicol. 2006 May;21(4):350-82.
- Marshall BC, Adler SP. The frequency of pregnancy and exposure to cytomegalovirus infections among women with a young child in day care. Am J Obstet Gynecol 2009; 200:163.e1-5.
- Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol 2007; 17:253-76. 4.
- Rahav G, Gabbay R et al. Primary versus nonprimary cytomegalovirus infection during pregnancy, Israel. Emerg Infect Dis 2007, 13:1791-3.
- Kouri V, Correa C et al. Diagnosis and screening for cytomegalovirus infection in pregnant women in cuba as prognostic markers of congenital infection in newborns: 2007-2008. Ped Infect Dis J 2010; 29:1105-10
- Pass RF, Fowler KB et al. Congenital cytomegalovirus infection following first trimester maternal infection: symptoms at birth and outcome. J Clin Virol 2006; 35:216-20.
- De Carolis S, Santucci S et al. False-positive IgM for CMV in pregnant women with autoimmune disease: a novel prognostic factor for poor pregnancy outcome. Lupus 2010; 19: 844-9.
- Ajzenberg D, Cogné N, Paris L. Genotype of 86 Toxoplasma gondii isolates associated with human congenital toxoplasmosis, and correlation with clinical findings. J Infect Dis. 2009;186:684-89.
- Centers for Disease Control and Prevention. Toxoplasmosis: Pregnant Women. [Cited 2010 October 11].
- Pollina S.: “Toxoplasmosi in gravidanza”. Sito internet 2005.
- Conti F.: Infezioni in gravidanza; Artemisia News, Aprile 2003 23.
- Wong S, Remington JS: Toxoplasmosis in pregnancy. Clin Infect Dis 1994;18:853-862
- Boyer K et al. Risk factors for Toxoplasma gondii infection in mothers of infants with congenital toxoplasmosis: Implications for prenatal management and screening. Am J Obstet Gynecol. 2005 Feb;192(2):564-71
- D. Ingall and P. J. Sánchez, “Syphilis,” in Infectious Diseases of the Fetus and Newborn Infant, J. S. Remington and J. O. Klein, Eds., pp. 643–681, W.B. Saunders, Philadelphia, 5th edition, 2001.
- E. Tridapalli, M. G. Capretti, V. Sambri et al., “Prenatal syphilis infection is a possible cause of preterm delivery among immigrant women from eastern Europe,” Sexually Transmitted Infections, vol. 83, no. 2, pp. 102–105, 2007.
- R. L. Goldenberg and C. Thompson, “The infectious origins of stillbirth,” American Journal of Obstetrics and Gynecology, vol. 189, no. 3, pp. 861–873, 2003.
- J. S. Sheffield, P. J. Sánchez, G. Morris et al., “Congenital syphilis after maternal treatment for syphilis during pregnancy,” American Journal of Obstetrics and Gynecology, vol. 186, no. 3, pp. 569–573, 2002.
- D. Watson-Jones, J. Changalucha, B. Gumodoka et al., “Syphilis in pregnancy in Tanzania. I. Impact of maternal syphilis on outcome of pregnancy,” Journal of Infectious Diseases, vol. 186, no. 7, pp. 940–947, 2002.
- G. D. Wendel Jr., J. S. Sheffield, L. M. Hollier, J. B. Hill, P. S. Ramsey, and P. J. Sánchez, “Treatment of syphilis in pregnancy and prevention of congenital syphilis,” Clinical Infectious Diseases, vol. 35, supplement 2, pp. S200–S209, 2002.
- Goeschen K: “Cardiotocografia pratica” V edizione; CIC Edizioni Internazionali, Roma, 1998.
- Goeschen K: “Kardiotokographie-praxis”. 1997, G T Verlag edit., Stuttgart (Germany).25
- RK Creasy, R Resnik. Maternal-fetal medicine. Saunders 2005. 26:465-481.
- Gardosi, J. and Francis, A. A customized standard to assess fetal growth in a US population. Am J Obstet Gynecol. 2009; 201: 25.e1–25.e7
- Rosemberg K., Grant J., Tweedie I. et al.: Measurement of fundal height as a screening test for fetal growth retardation. Br. J. Obstet. Gynaecol. 89: 447, 1982.
- Ott WJ. The diagnosis of altered fetal growth. Obstet Gynecol Clin North Am. 1988;15:237–63.
- Daikoku N.H., Johnson J.W.C., Graf C., et al: Patterns of intrauterine growth retardation. Obstet. Gynecol. 54: 211, 1979.
- Altman D.G e Hytten F.E: Assessment of fetal size and fetal growth. in: Effective Care in pregnancy and Childborth. Chalmers I, Enkin M. and Keirse MJNC, eds, Oxford University Press, Oxford, p. 411, 1989.
- McIntire DD, Bloom SL, Casey BM, Leveno KJ. Birth weight in relation to morbidity and mortality among newborn infants. N Engl J Med 1999;340:1234-8.
- Aoki M. Fetal weight calculation; Osaka University metod. In: Yoshihide C ed. Ultrasound in obstetrics and gynaecology. 2nd ed. Kyoto: Kinpodo; 1990
- Shepard MJ, Richards VA, Berkowitz RL, Warsof SL, Hobbins JC. An evaluation of two equations for predicting fetal weight by ultrasound. Am J Obstet Gynecol 1982;142:47-54
- Patterson R.M.: Analysis of birth weight percentile as a predictor of perinatal outcome. Obstet. Gynecol, 68: 459, 1986.
- Hadlock FP, Harrist RB, Sharman RS, Deter RL, Park SK.: “Estimation of fetal weight with the use of head, body, and femur measurements–a prospective study”. Am J Obstet Gynecol. 1985;151:333-7
- Shivkumar, S., Himes, K.P., Hutcheon, J.A., and Platt, R.W. An ultrasound-based fetal weight reference for twins. Am J Obstet Gynecol. 2015; 213: 224.e1–224.e9
- Chang T.C., Robson S.C., Boys R.J. et al: Prediction of the small for gestation age infant: which ultrasonic measurement is best? Obstet. Gynecol. 80:1030, 1992.
- Warsof S.L., Gohari P., Berkowitz R.L. et al: The estimation of fetal weight by computer-assisted analysis. Am. J. Obstet. Gynecol. 128:881, 1977.
- Kiserud, T., Piaggio, G., Carroli, G. et al. The World Health Organization fetal growth charts: a multinational longitudinal study of ultrasound biometric measurements and estimated fetal weight. Myers JE, ed. PLOS Med. 2017; 14: e1002220
- Shepard M.J., Richards V.A., Bercowitz R.L. et al: An evaluation of two equations for predicting fetal weight by ultrasound. Am. J. Obstet. Gynecol., 142: 47, 1982.
- The British Medical Ultrasound Society: Fetal Measurement working party report. Clinical Applications of Ultrasonic Fetal Measurements. BIR (British Institute of Radiology), London 1990.
- Stirnemann, J., Villar, J., Salomon, L.J. et al. International estimated fetal weight standards of the INTERGROWTH-21st Project. (Available at:) (Accessed March 19, 2017) Ultrasound Obstet Gynecol. 2016; http://onlinelibrary.wiley.com/doi/10.1002/uog.17347/full
- Poon LCY, Tan MY, Yerlikaya G, Syngelaki A, Nicolaides KH. Birthweight in live births and stillbirths. Ultrasound Obstet Gynecol [Internet]. 2016 (cited Nov. 1, 2016]. Available at: http://doi.wiley.com/10.1002/uog.17287. Accessed March 19, 2017.
- Figueras, F., Figueras, J., Meler, E. et al. Customised birthweight standards accurately predict perinatal morbidity. Arch Dis Child Fetal Neonatal Ed. 2007; 92: F277–F280
- Sung IK, Vohr B, Oh W. Growth and neurodevelopmental outcome of very low birth weight infants with intrauterine growth retardation: comparison with control subjects matched by birth weight and gestational age. J Pediatr. 1993;123:618–24.
- De Jong, C.L.D., Francis, A., Van Geijn, H.P., and Gardosi, J. Customized fetal weight limits for antenatal detection of fetal growth restriction. Ultrasound Obstet Gynecol. 2000; 15: 36–40
- Neilson J.P., Munjanja S.P. and Whitfield C.R.: Screening for small for dates fetuses: a controlled trial. British Medical Journal, 289: 1179, 1984.
- Selbing A., Wichman K. and Ryden G.: Screening for detection of intra-uterine growth retardation by means of ultrasound. Acta Obstet. Gynecol. Scand. 63: 543, 1984.
- Geirsson R.T., Patel N.B. and Christie A.D.: Efficacy of intrauterine volume, fetal abdominal area and biparietal diameter measurement with ultrasound in screening of small-for-dates. Br. J. Obstet. Gynecol. 92: 929, 1985.
- Ferrazzi E., Nicolini U., Kusterman A. et al: Routine obstetric ultrasound: effectiveness of cross-sectional screening for fetal growth retardation. J. Clin. Ultrasound 14: 17, 1986.
- Warsof S.L., Cooper D.J., Little D. et al: Routine ultrasound screening for antenatal detection of intrauterine growth retardation. Obstet. Gynecol. 67: 33, 1986.
- Laurin J. and Persson P.H.: Ultrasound screening for detection of intra-uterine growth retardation. Acta Obstet. Gynecol. Scand. 66: 493, 1987.
- Rosendhal H. and Kivinen S.: Routine ultrasound screening for early detection of small for gestational age fetuses. Obstet. Gynecol. 71: 518, 1988.
- Thame M, Osmond C, Wilks R, Bennett FI, Forrester TE. Second-trimester placental volume and infant size at birth. Obstet Gynecol. 2001 Aug; 98(2):279-83.
- Fang SW, Ou CY, Tsai CC, Fu HC, Cheng HH, Cheng BH, Chang MS, Hsu TY. Second-trimester placental volume and vascular indices in the prediction of small-for-gestational-age neonates. Fetal Diagn Ther. 2015;37(2):123-8.
- M. Effendi et al: Association between first-trimester placental volume and birth weight. Placenta 2014;35:99-102.
- Hata T, Tanaka H, Noguchi J, Hata K. Three-dimensional ultrasound evaluation of the placenta. Placenta 2011;32:105e15.
- Proctor LK, Toal M, Keating S, Chitayat D, Okun N, Windrim RC, et al. Placental size and the prediction of severe early-onset intrauterine growth restriction in women with low pregnancy-associated plasma protein-A. Ultrasound Obstet Gynecol 2009;34:274e82
- Gynecol 2009;34:274e82. [13] Thame M, Osmond C, Wilks R, Bennett FI, Forrester TE. Second-trimester placental volume and infant size at birth. Obstet Gynecol 2001;98:279e83.]
- Thame M, Osmond C, Bennett F, Wilks R, Forrester T. Fetal growth is directly related to maternal anthropometry and placental volume. Eur J Clin Nutr 2004;58:894e900
- Metzenbauer M, Hafner E, Hoefinger D, Schuchter K, Philipp K. Associations between birth weight and placental volume in the first trimester. Z Geburtshilfe Neonatol 2002;206:138e41.
- Metzenbauer M, Hafner E, Hoefinger D, Schuchter K, Stangl G, Ogris E, et al. Three-dimensional ultrasound measurement of the placental volume in early pregnancy: method and correlation with biochemical placenta parameters. Placenta 2001;22:602e5
- Odibo AO, Goetzinger KR, Huster KM, Christiansen JK, Odibo L, Tuuli MG. Placental volume and vascular flow assessed by 3D power Doppler and adverse pregnancy outcomes. Placenta 2011;32:230e4
- Plasencia W, Akolekar R, Dagklis T, Veduta A, Nicolaides KH. Placental volume at 11-13 weeks’ gestation in the prediction of birth weight percentile. Fetal Diagn Ther 2011;30:23e8.
- Rizzo G, Capponi A, Cavicchioni O, Vendola M, Arduini D. First trimester uterine Doppler and three-dimensional ultrasound placental volume calculation in predicting pre-eclampsia. Eur J Obstet Gynecol Reprod Biol 2008;138:147e51.
- de Paula CF, Ruano R, Campos JA, Zugaib M. Placental volumes measured by 3- dimensional ultrasonography in normal pregnancies from 12 to 40 weeks’ gestation. J Ultrasound Med 2008;27:1583e90.
- Thame M,Osmond C,Bennett F, et al.Fetal growth is directly related to maternal anthrometry and placental volume.Eur J Clin Nutr. 2004;58:894- 900
- Hafner, E., Schuchter, K., Van leeuwen, M., Metzenbauer, M., Dillinger-paller, B., and Philipp, K. Three-dimensional sonographic volumetry of the placenta and the fetus between weeks 15 and 17 of gestation. Ultrasound Obstet Gynecol. 2001; 18: 116
- Noguchi, J., Hata, K., Tanaka, H., and Hata, T. Placental vascular sonobiopsy using three-dimensional power Doppler ultrasound in normal and growth restricted fetuses. Placenta. 2009; 30: 391–397
- Rizzo, G., Capponi, A., Pietrolucci, M.E., Capece, A., and Arduini, D. First-trimester placental volume and vascularization measured by 3-dimensional power Doppler sonography in pregnancies with low serum pregnancy-associated plasma protein a levels. J Ultrasound Med. 2009 Dec; 28: 1615–1622
- Rizzo, G., Capponi, A., Pietrolucci, M.E., and Arduini, D. Effects of maternal cigarette smoking on placental volume and vascularization measured by 3-dimensional power Doppler ultrasonography at 11 + 0 to 13 + 6 weeks of gestation. (e1–5)Am J Obstet Gynecol. 2009 Apr; 200: 415
- Avarello Ilaria, Cancemi Annalisa, D’Ambra Angela: fumo materno in gravidanza: quali effetti sul nascituro. RIGIP 2012;2
- Hayashibe H, Asayama K, Dobashi K, et al. Prenatal development of antioxidant enzymes in rat lung, kidney, and heart: Marked increase in immunoreactive superoxide dismutases, glutathione peroxidase, and catalase in the kidney. Pediatr. Res. 1990, 27, 472-475
- Walther F.J, Wade A.B, Warburton D, et al. Ontogeny of antioxidant enzymes in the fetal lamb lung. Exp. Lung Res. 1991, 17, 39-45
- Lambers DS, Clark KE. The maternal and fetal physiologic effects of nicotine. Semin Perinatol. 1996, 20, 115-126
- Lambers DS, Clark KE. The maternal and fetal physiologic effects of nicotine. Semin Perinatol. 1996, 20, 115-126
- Schwartz-Bickenbach D, Schulte-Hobein B, Abt S, et al. Smoking and passive smoking during pregnancy and early infancy: effects on birth weight, lactation period, and cotinine concentrations in mother’s milk and infant’s urine. Toxicol. Lett. 1987;35, 73–81
- Jordanov J S. Cotinine concentrations in amniotic fluid and urine of smoking, passive smoking and non-smoking pregnant women at term and in the urine of their neonates on 1st day of life. Eur. J. Pediatr. 1990; 149, 734–737
- Luck W, Nau H, Hansen R, et al. Extent of nicotine and cotinine transfer to the human fetus, placenta and amniotic fluid of smoking mothers. Dev. Pharmacol. Ther. 1985, 8, 384-395
- Dempsey D.A, Benowitz N.L. Risks and benefits of nicotine to aid smoking cessation in pregnancy. Drug Saf. 2001, 24, 277-322
- Matta SG, Balfour DJ, Benowitz NL, et al. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology 2007; 190, 269-319
- Jordanov J S. Cotinine concentrations in amniotic fluid and urine of smoking, passive smoking and non-smoking pregnant women at term and in the urine of their neonates on 1st day of life. Eur. J. Pediatr. 1990; 149, 734–737
- Luck W, Nau H, Hansen R, et al. Extent of nicotine and cotinine transfer to the human fetus, placenta and amniotic fluid of smoking mothers. Dev. Pharmacol. Ther. 1985, 8, 384-395
- Mitchell EA. Recommendations for sudden infant death syndrome prevention: a discussion document. Arch Dis Child. 2007 Feb;92 (2):155-9
- Anderson ME, Johnson DC, Batal HA. Sudden Infant Death Syndrome and prenatal maternal smoking: rising attributed risk in the Back to Sleep era. BMC Med. 2005 Jan 11;3:4
- Luck W, Nau H. Nicotine and cotinine concentrations in the milk of smoking mothers: influence of cigarette consumption and diurnal variation. Eur. J. Pediatr. 1987; 146, 21–26
- Holloway A. C, Lim G. E, Petrik J. J, et al. Fetal and neonatal exposure to nicotine in Wistar rats results in increased beta cell apoptosis at birth and postnatal endocrine and metabolic changes associated with type 2 diabetes. Diabetologia 2005; 48, 2661–2666
- 106 Butler A. E, Janson J, Bonner-Weir S, et al. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes. Diabetes 2003; 52, 102–110
- Bruin J.E, Kellenberger L.D, Gerstein H.C, et al. Fetal and neonatal nicotine exposure and postnatal glucose homeostasis: identifying critical windows of exposure. J. Endocrinol. 2007; 194, 171–178
- Bruin J. E, Petre M. A, Raha S, et al. Fetal and neonatal nicotine exposure in Wistar rats causes progressive pancreatic mitochondrial damage and beta cell dysfunction. PLoS.One 2008c.; 3, e3371
- Bruin J. E, Gerstein H. C, Morrison K. M, et al. Increased pancreatic beta cell apoptosis following fetal and neonatal exposure to nicotine is mediated via the mitochondria. Toxicol. Sci. 2008a; 103, 362–370
- Beratis N. G, Panagoulias D, Varvarigou A. Increased blood pressure in neonates and infants whose mothers smoked during pregnancy. J. Pediatr. 1996; 128, 806–812
- Blake K. V, Gurrin L. C, Evans S. F, et al. Maternal cigarette smoking during pregnancy, low birth weight and subsequent blood pressure in early childhood. Early Hum. Dev. 2000; 57, 137–147
- Gao Y. J, Holloway A. C, Su L. Y, et al. Effects of fetal and neonatal exposure to nicotine on blood pressure and perivascular adipose tissue function in adult life. Eur. J. Pharmacol. 2008; 590, 264–268
- Gao Y. J, Lu C, Su L. Y, et al. Modulation of vascular function by perivascular adipose tissue: the role of endothelium and hydrogen peroxide. Br. J. Pharmacol.2007; 151, 323–331.
- Gilliland F. D, Berhane K, McConnell R, et al. Maternal smoking during pregnancy, environmental tobacco smoke exposure and childhood lung function. Thorax 2000; 55, 271–276.
- Gilliland F. D, Li Y. F, Peters J. M. Effects of maternal smoking during pregnancy and environmental tobacco smoke on asthma and wheezing in children. Am. J. Respir. Crit. Care Med. 2001; 163, 429–436
- Skorge T. D, Eagan T. M, Eide G. E, et al. The adult incidence of asthma and respiratory symptoms by passive smoking in uterus or in childhood. Am. J. Respir. Crit. Care Med.2005; 172, 61–66.
- Upton M. N. Effects of parental smoking on the respiratory health of adults. Thorax 2004; 59, 274–276
- Matijevic, R. and Kurjak, A. The assessment of placental blood vessels by three-dimensional power Doppler ultrasound. J Perinat Med. 2002; 30: 26–32
- Guimarães Filho, H.A., da Costa, L.L., Araújo Júnior, E., Nardozza, L.M., Nowak, P.M., Moron, A.F. et al.Placenta: angiogenesis and vascular assessment through three-dimensional power Doppler ultrasonography. Arch Gynecol Obstet. 2008; 277: 195–200
- Salvesen K, Lees C, Abramowicz J, Brezinka C, Ter Har G, Marsal K. ISUOG statement on the safe use of Doppler in the 11 to 13+6-week fetal ultrasound examination. Ultrasound Obstet Gynecol 2011; 37: 628.
- Khare M, Paul S, Konje J. Variation in Doppler indices along the length of the cord from the intraabdominal to the placental insertion. Acta Obstet Gynecol Scand 2006; 85: 922 –928
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of blood velocity and pulsatility index at the intra-abdominal portion, and fetal and placental ends of the umbilical artery. Ultrasound Obstet Gynecol 2005; 26: 162 –169.
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T.Reference ranges for serial measurements of umbilical artery Doppler indices in the second half of pregnancy. Am J Obstet Gynecol 2005; 192: 937 –944.
- Sepulveda W, Peek MJ, Hassan J, Hollingsworth J. Umbili- cal vein to artery ratio in fetuses with single umbilical artery. UltrasoundObstet Gynecol 1996; 8: 23 –26.
- Madazli R, Uludağ S, Ocak V. Doppler assessment of umbilical artery, thoracic aorta and middle cerebral artery in the management of pregnancies with growth restriction. Acta Obstet Gynecol Scand. 2001;80 (8): 702-7. Acta Obstet Gynecol Scand (link) –
- Marsál K. Rational use of Doppler ultrasound in perinatal medicine. J Perinat Med. 1994;22 (6): 463-74.
- Gagnon R, Van den hof M. The use of fetal Doppler in obstetrics. J Obstet Gynaecol Can. 2003;25 (7): 601-14. –
- Baschat AA, Gembruch U, Reiss I et-al. Relationship between arterial and venous Doppler and perinatal outcome in fetal growth restriction. Ultrasound Obstet Gynecol. 2000;16 (5): 407-13.
- . Maulik D, Mundy D, Heitmann E et-al. Evidence-based approach to umbilical artery Doppler fetal surveillance in high-risk pregnancies: an update. Clin Obstet Gynecol. 2010;53 (4): 869-78.
- 6. Coppens M, Loquet P, Kollen M, De Neubourg F, Buytaert P. Longitudinal evaluation of uteroplacental and umbilical blood flow changes in normal early pregnancy. Ultrasound in obstetrics & gynecology : the official journal of the International Society of Ultrasound in Obstetrics and Gynecology. 7 (2): 114-21.
- Maiz N, Plasencia W, Dagklis T et-al. Ductus venosus Doppler in fetuses with cardiac defects and increased nuchal translucency thickness. Ultrasound Obstet Gynecol. 2008;31 (3): 256-60.
- . Huisman TW, Brezinka C, Stewart PA et-al. Ductus venosus flow velocity waveforms in relation to fetal behavioural states. Br J Obstet Gynaecol. 1994;101 (3): 220-4.
- Huisman TW, Stewart PA, Wladimiroff JW. Ductus venosus blood flow velocity waveforms in the human fetus–a Doppler study. Ultrasound Med Biol. 1992;18 (1): 33-7.
- Huisman TW. Doppler assessment of the fetal venous system. Semin. Perinatol. 2001;25 (1): 21-31.
- Goldberg BB, McGahan JP. Atlas of ultrasound measurements. Mosby Inc. (2006)
- Sherer DM, Fromberg RA, Divon MY. Prenatal ultrasonographic assessment of the ductus venosus: a review. Obstet Gynecol. 1996;88 (4 Pt 1): 626-32.
- Schmidt W, Kurjak A. Color Doppler Sonography in Gynecology and Obstetrics. Thieme Medical Publishers. (2004) ISBN:1588902560.
- Drose JA. Fetal Echocardiography. W B Saunders Co. (2009) ISBN:1416056696.
- Merz E, Bahlmann F. Ultrasound in obstetrics and gynecology. Thieme Medical Publishers. (2005) ISBN:1588901475.
- Chudleigh P, Thilaganathan B. Obstetric ultrasound, how, why and when. Churchill Livingstone. (2004) ISBN:0443054711.
- Merz E, Bahlmann F. Ultrasound in obstetrics and gynecology. Thieme Medical Publishers. (2005) ISBN:1588901475.
- Schmidt W, Kurjak A. Color Doppler Sonography in Gynecology and Obstetrics. Thieme Medical Publishers. (2004) ISBN:1588902560.
- Mari G, Hanif F. Fetal Doppler: umbilical artery, middle cerebral artery, and venous system. Semin. Perinatol. 2008;32 (4): 253-7.
- Kiserud T, Eik-Nes SH, Blaas HG, Hellevik LR. Ultrasono- graphic velocimetry of the fetal ductus venosus. Lancet 1991;338: 1412 –1414.
- Acharya G, Kiserud T. Pulsations of the ductus venosus blood velocity and diameter are more pronounced at the outlet than at the inlet. Eur J Obstet Gynecol Reprod Biol 1999; 84:149 –154
- Kiserud T. Hemodynamics of the ductus venosus. Eur J Obstet Gynecol Reprod Biol 1999; 84: 139 –147.
- Kessler J, Rasmussen S, Hanson M, Kiserud T. Longitudinal reference ranges for ductus venosus flow velocities and waveform indices. Ultrasound Obstet Gynecol 2006; 28: 890 –898.
- Simanaviciute D, Gudmundsson S.Fetal middle cerebral to uterine artery pulsatility index ratios in normal and pre-eclamptic pregnancies.Ultrasound Obstet Gynecol. 2006 Nov; 28(6):794-801.
- Mari G, Hanif F, Kruger M, Cosmi E, Santolaya-Forgas J, Treadwell MC.Middle cerebral artery peak systolic velocity: a new Doppler parameter in the assessment of growth-restricted fetuses.
Ultrasound Obstet Gynecol. 2007 Mar; 29(3):310-6.- Morris RK, Say R, Robson SC, Kleijnen J, Khan KSSystematic review and meta-analysis of middle cerebral artery Doppler to predict perinatal wellbeing..Eur J Obstet Gynecol Reprod Biol. 2012 Dec; 165(2):141-55. Epub 2012 Aug 15.
- Wing D.A., Fishman A., Gonzalez C., Paul R. H.: How frequently should the amniotic fluid index be performed during the course of antepartum testing! Am. J. Obstet. Gynecol.: 174:33-36,1996.
- RUTHERFORD, SUSAN E. MD; PHELAN, JEFFREY P. MD; SMITH, CARL V. MD; JACOBS, NANCY RN The Four-Quadrant Assessment of Amniotic Fluid Volume: Obstetrics & Gynecology: September 1987
- Gardosi J.: Toward safe standards for assessment of fetal growth in twin pregnancy. Am J Obstet Gynecol. 2017 May;216(5):431-433. doi: 10.1016/j.ajog.2017.03.018.
- Ghi, T., Prefumo, F., Fichera, A. et al. Development of customized fetal growth charts in twins. Am J Obstet Gynecol. 2017; 216: 514.e1–514.e17
- Odibo, A.O., Cahill, A.G., Goetzinger, K.R., Harper, L.M., Tuuli, M.G., and Macones, G.A. Customized growth charts for twin gestations to optimize identification of small-for-gestational age fetuses at risk of intrauterine fetal death: customized growth charts in twin pregnancies. Ultrasound Obstet Gynecol. 2013; 41: 637–642
- Fox NS, Rebarber A, Klauser CK, Roman AS, Saltzman DH.Intrauterine growth restriction in twin pregnancies: incidence and associated risk factors. Am J Perinatol. 2011 Apr;28(4):267-72.
- Fraser D, Picard R, Picard E, Leiberman JR Birth weight discordance, intrauterine growth retardation and perinatal outcomes in twins. J Reprod Med. 1994 Jul; 39(7):504-8.
- Inklaar MJ, van Klink JM, Stolk TT, van Zwet EW, Oepkes D, Lopriore E. Cerebral injury in monochorionic twins with selective intrauterine growth restriction: a systematic review. Prenat Diagn. 2014 Mar; 34(3):205-13. Epub 2014 Jan 13.
- Villar J et al: Preeclampsia, gestational hypertension and intrauterine growth restriction, related or independent conditions? Am J Obst Gynecol 2006;194,4:921-931
- Fox NS, Saltzman DH, Oppal S, Klauser CK, Gupta S, Rebarber The relationship between preeclampsia and intrauterine growth restriction in twin pregnancies. Am J Obstet Gynecol. 2014 Oct;211(4):422.e1-5.
- [Intrauterine growth characteristics of twins and those twins discordant birthweight]. Han ZY, Fang Q, Luo YM, Hou HY, Chen ML, He ZM, Song HL.Zhonghua Fu Chan Ke Za Zhi. 2012 May; 47(5):337-41.
- Intrauterine growth restriction in infants of less than thirty-two weeks’ gestation: associated placental pathologic features. Salafia CM, Minior VK, Pezzullo JC, Popek EJ, Rosenkrantz TS, Vintzileos AM.Am J Obstet Gynecol. 1995 Oct; 173(4):1049-57.
- [Foetal growth retardation]. Haram K, Gjelland K.Tidsskr Nor Laegeforen. 2007 Oct 18; 127(20):2665-9.
- Kaufmann P, Black S, Huppertz B: Endovascular Trophoblast Invasion: Implications for the Pathogenesis of Intrauterine Growth Retardation and Preeclampsia. Biology of Reproduction 69(1):1-7. 2003
- Benirschke, K. and P. Kaufmann. Pathology of the Human Placenta, 4th ed. New York: Springer; 2000.
- Brosens, I. A., H. G. Dixon, and W. B. Robertson. Fetal growth retardation and the arteries of the placental bed. Br J Obstet Gynaecol 1977. 84:656–663.
- Craven, C. M., T. Morgan, and K. Ward. Decidual spiral artery remodelling begins before cellular interaction with cytotrophoblasts. Placenta 1998. 19:241–252.
- Nanaev, A. K., K. Chwalisz, H. G. Frank, G. Kohnen, C. Hegele-Hartung, and P. Kaufmann. Physiological dilation of uteroplacental arteries in the guinea pig depends on nitric oxide synthase activity of extravillous trophoblast. Cell Tissue Res 1995. 282:407–421.
- Hirano, H., Y. Imai, and H. Ito. Spiral artery of placenta: development and pathology: immunohistochemical, microscopical, and electron-microscopic study. Kobe J Med Sci 2002. 48:13–23.
- Craven, C. M., L. Zhao, and K. Ward. Lateral placental growth occurs by trophoblast cell invasion of decidual veins. Placenta 2000. 21:160–169.
- Merviel, P., J. C. Challier, L. Carbillon, J. M. Foidart, and S. Uzan. The role of integrins in human embryo implantation. Fetal Diagn Ther 2001. 16:364–371.
- Lyall, F., J. N. Bulmer, E. Duffie, F. Cousins, A. Theriault, and S. C. Robson. Human trophoblast invasion and spiral artery transformation: the role of PECAM-1 in normal pregnancy, preeclampsia, and fetal growth restriction. Am J Pathol 2001. 158:1713–1721.
- Nanaev, A. K., G. Kosanke, F. Reister, B. Kemp, H. G. Frank, and P. Kaufmann. Pregnancy-induced de-differentiation of media smooth muscle cells in uteroplacental arteries of the guinea pig is reversible after delivery. Placenta 2000. 21:306–312.
- Lyall, F., J. N. Bulmer, H. Kelly, E. Duffie, and S. C. Robson. Human trophoblast invasion and spiral artery transformation: the role of nitric oxide. Am J Pathol 1999. 154:1105–1114.
- Martin, D. and K. P. Conrad. Expression of endothelial nitric oxide synthase by extravillous trophoblast cells in the human placenta. Placenta 2000. 21:23–31.
- Chwalisz, K. and I. Ciesla. Garfield RE. Inhibition of nitric oxide (NO) synthesis induces preterm parturition and preeclampsia-like conditions in guinea pigs. In: Program of the 41st Meeting of the Society of Gynecologic Investigation; 1994; Chicago, IL. Abstract O 36.
- Reister, F., H. G. Frank, J. C. P. Kingdom, W. Heyl, P. Kaufmann, W. Rath, and B. Huppertz. Macrophage-induced apoptosis limits endovascular trophoblast invasion in the uterine wall of preeclamptic women. Lab Invest 2001. 81:1143–1152.
- Caniggia, I., J. Winter, S. J. Lye, and M. Post. Oxygen and placental development during the first trimester: implications for the pathophysiology of pre-eclampsia. Placenta 2000. 21:S25–S30.
- Brosens, J. J., R. Pijnenborg, and I. A. Brosens. The myometrial junctional zone spiral arteries in normal and abnormal pregnancies: a review of the literature. Am J Obstet Gynecol 2002. 187:1416–1423.
- Cartwright, J. E., L. C. Kenny, P. R. Dash, I. P. Crocker, J. D. Aplin, P. N. Baker, and G. S. Whitley. Trophoblast invasion of spiral arteries: a novel in vitro model. Placenta 2002. 23:232–235.
- Monique Y. Rennie, Kathie J. Whiteley, S. Lee Adamson, and John G. Sled. (2016) Quantification of Gestational Changes in the Uteroplacental Vascular Tree Reveals Vessel Specific Hemodynamic Roles During Pregnancy in Mice. Biology of Reproduction 95:2.
- Anuja Dokras, Darren S. Hoffmann, Joshua S. Eastvold, Martha F. Kienzle, Lynn M. Gruman, Patricia A. Kirby, Robert M. Weiss, and Robin L. Davisson. (2006) Severe Feto-Placental Abnormalities Precede the Onset of Hypertension and Proteinuria in a Mouse Model of Preeclampsia. Biology of Reproduction 75:6, 899-907.
Online publication date: 2-Sep-2009.- Damien P. Hewitt, Peter J. Mark, Arun M. Dharmarajan, and Brendan J. Waddell. (2006) Placental Expression of Secreted Frizzled Related Protein-4 in the Rat and the Impact of Glucocorticoid-Induced Fetal and Placental Growth Restriction. Biology of Reproduction 75:1, 75-81.
- Swamy GK, Carrett ME, Miranda ML, Ashley-Koch AE: Maternal vitamin D receptor genetic variation contributes to infant birthweight among black mothers. Am J Med Genet A. 2011 Jun;155A(6):1264-71.
- Bodnar LM, Catov JM, Zmuda JM, Cooper ME, Parrott MS, Roberts JM, Marazita ML, Simhan HN.Maternal serum 25-hydroxyvitamin D concentrations are associated with small-for-gestational age births in white women. J Nutr. 2010 May; 140(5):999-1006.
- Bodnar LM, Simhan HN.Vitamin D may be a link to black-white disparities in adverse birth outcomes. Obstet Gynecol Surv. 2010 Apr; 65(4):273-84.
- Miettinen ME, Smart MC, Kinnunen L, Mathews C, Harjutsalo V, Surcel HM, Lamberg-Allardt C, Tuomilehto J, Hitman GAMaternal VDR variants rather than 25-hydroxyvitamin D concentration during early pregnancy are associated with type 1 diabetes in the offspring. .Diabetologia. 2015 Oct; 58(10):2278-83. Epub 2015 Jun 26.
- Alison D. Gernand, Hyagriv N. Simhan, Steve Caritis, and Lisa M. Bodnar: Maternal Vitamin D Status and Small-for-Gestational-Age Offspring in Women at High Risk for Preeclampsia. Obstet Gynecol. 2014 Jan; 123(1): 40–48.
- Looker AC, Johnson CL, Lacher DA, Pfeiffer CM, Schleicher RL, Sempos CT. Vitamin D status: United States, 2001-2006. NCHS Data Brief. 2011 Mar;(59):1–8.
- Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O’Beirne M, Rabi DM. Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies. BMJ. 2013;346:f1169.
- Specker BL. Does vitamin D during pregnancy impact offspring growth and bone? Proc Nutr Soc. 2012 Feb;71(1):38–45.
- Thorne-Lyman A, Fawzi WW. Vitamin D during pregnancy and maternal, neonatal and infant health outcomes: a systematic review and meta-analysis. Paediatr Perinat Epidemiol. 2012 Jul;26(1):75–90.
- Bodnar LM, Catov JM, Zmuda JM, Cooper ME, Parrott MS, Roberts JM, et al. Maternal serum 25-hydroxyvitamin D concentrations are associated with small-for-gestational age births in white women. J Nutr. 2010 May;140(5):999–1006.
- Gernand AD, Bodnar LM, Klebanoff MA, Parks WT, Simhan HN. Maternal serum 25-hydroxyvitamin D and placental vascular pathology in a multicenter US cohort. Am J Clin Nutr. 2013 Jun 26;
- Gernand AD, Simhan HN, Klebanoff MA, Bodnar LM. Maternal serum 25-hydroxyvitamin D and measures of newborn and placental weight in a U.S. multicenter cohort study. J Clin Endocrinol Metab. 2013 Jan;98(1):398–404.
- Burris HH, Rifas-Shiman SL, Camargo CA, Jr, Litonjua AA, Huh SY, Rich-Edwards JW, et al. Plasma 25-hydroxyvitamin D during pregnancy and small-for-gestational age in black and white infants. Ann Epidemiol. 2012 Aug;22(8):581–6.
- Ertl R, Yu CK, Samaha R, Akolekar R, Nicolaides KH. Maternal serum vitamin D at 11-13 weeks in pregnancies delivering small for gestational age neonates. Fetal Diagn Ther. 2012;31(2):103–8.
- Leffelaar ER, Vrijkotte TG, van Eijsden M. Maternal early pregnancy vitamin D status in relation to fetal and neonatal growth: results of the multi-ethnic Amstedam Born Children and their Development cohort. Br J Nutr. 2010 Jul;104(1):108–17.
- Morisaki N, Esplin MS, Varner MW, Henry E, Oken E. Declines in birth weight and fetal growth independent of gestational length. Obstet Gynecol. 2013 Jan;121(1):51–8.
- Seamans KM, Cashman KD. Existing and potentially novel functional markers of vitamin D status: a systematic review. Am J Clin Nutr. 2009 Jun;89(6):1997S–2008S. [PubMed]
- IOM. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: The National Academies Press; 2011.
- Workalemahu T, Badon SE, Dishi-Galitzky M, Qiu C, Williams MA, Sorensen T, Enquobahrie DA Placental genetic variations in vitamin D metabolism and birthweight. .Placenta. 2017 Feb; 50:78-83. Epub 2016 Dec 27.
- Cooke RW. Conventional birth weight standards obscure fetal growth restriction in preterm infants. Arch Dis Child Fetal Neonatal Ed. 2007 May;92(3):F189–92.
- Fernandez-Alonso AM, Dionis-Sanchez EC, Chedraui P, Gonzalez-Salmeron MD, Perez-Lopez FR. First-trimester maternal serum 25-hydroxyvitamin D(3) status and pregnancy outcome. Int J Gynaecol Obstet. 2012 Jan;116(1):6–9.
- Shand AW, Nassar N, Von Dadelszen P, Innis SM, Green TJ. Maternal vitamin D status in pregnancy and adverse pregnancy outcomes in a group at high risk for pre-eclampsia. BJOG. 2010 Dec;117(13):1593–8.
- Repke JT, Villar J (1991) Pregnancy induced hypertension and low birth weight: the role of calcium. Am J Clin Nutr 54(1 Suppl):237S–241S
- Christesen HT, Falkenberg T, Lamont RF, Jorgensen JS. The impact of vitamin D on pregnancy: a systematic review. Acta Obstet Gynecol Scand. 2012 Dec;91(12):1357–67. [PubMed]
- Bodnar LM, Simhan HN, Powers RW, Frank MP, Cooperstein E, Roberts JM. High prevalence of vitamin D insufficiency in black and white pregnant women residing in the northern United States and their neonates. J Nutr. 2007;137:447–52
- McGrath J. Does ‘imprinting’ with low prenatal vitamin D contribute to the risk of various adult disorders? Med Hypotheses. 2001;56:367–71.
- Moore CE, Murphy MM, Holick MF. Vitamin D intakes by children and adults in the United States differ among ethnic groups. J Nutr. 2005;135:2478–85.
- Looker AC, Pfeiffer CM, Lacher DA, Schleicher RL, Picciano MF, Yetley EA. Serum 25-hydroxyvitamin D status of the US population: 1988–1994 compared with 2000–2004. Am J Clin Nutr. 2008;88:1519–27
- Brooke OG, Brown IR, Bone CD, Carter ND, Cleeve HJ, Maxwell JD, et al. Vitamin D supplements in pregnant Asian women: effects on calcium status and fetal growth. Br Med J. 1980 Mar 15;280(6216):751–4.
- Hollis BW, Wagner CL (2004) Assessment of dietary vitamin D requirement during pregnancy and lactation. Am J Clin Nutr 79(5):717–726
- Hofmeyr GJ, Duley L, Atallah A (2007) Dietary calcium supplementation for prevention of pre-eclampsia and related problems: a systematic review and commentary. BJOG 114(8):933–943
- Yu CK, Sykes L, Sethi M, Teoh TG, Robinson S. Vitamin D deficiency and supplementation during pregnancy. Clin Endocrinol (Oxf) 2009 May;70(5):685–90.
- De-Regil LM, Palacios C, Ansary A, Kulier R, Pena-Rosas JP. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst Rev. 2012;2:CD008873.
- Swamy GK, Garrett ME, Miranda ML, Ashley-Koch AE. Maternal vitamin D receptor genetic variation contributes to infant birthweight among black mothers. Am J Med Genet A. 2011 Jun;155A(6):1264–71
- Cosman F, Nieves J, Dempster D, Lindsay R. Vitamin D economy in blacks. J Bone Miner Res. 2007 Dec;22(2):V34–8.
- Bodnar LM, Parrott MS. Intervention strategies to improve outcome in obese pregnancies: micronutrients and dietary supplements. In: Gillman MW, Poston L, editors. Maternal Obesity. Cambridge, UK: Cambridge University Press; 2012.
- ACOG Committee Opinion No. 495: Vitamin D: Screening and supplementation during pregnancy. Obstet Gynecol. 2011 Jul;118(1):197–8.
- Gopalan C, Rama Sastri BV, Balasubramanian SC (2004) Nutritive value of Indian foods, 1st edn. National Institute of Nutrition, ICMR, Hyderabad, pp 47–58
- Turan S, Miller J, Baschat AA. Integrated testing and management in fetal growth restriction. Semin Perinatol. 2008 Jun;32(3):194–200.
- Bhattacharyya SK, Kundu S, Kabiraj SP. Prediction of preeclampsia by midtrimester uterine artery Doppler velocimetry in high-risk and low-risk women. J Obstet Gynaecol India. 2012 Jun;62(3):297–300.
- Liu NQ, Ouyang Y, Bulut Y, Lagishetty V, Chan SY, Hollis BW, et al. Dietary Vitamin D Restriction in Pregnant Female Mice Is Associated With Maternal Hypertension and Altered Placental and Fetal Development. Endocrinology. 2013 May 15; [PubMed]
- Wei SQ, Audibert F, Luo ZC, Nuyt AM, Masse B, Julien P, et al. Maternal plasma 25-hydroxyvitamin D levels, angiogenic factors, and preeclampsia. Am J Obstet Gynecol. 2013 May;208(5):390. e1-6.
- Grundmann M, Haidar M, Placzko S, Niendorf R, Darashchonak N, Hubel CA, et al. Vitamin D improves the angiogenic properties of endothelial progenitor cells. Am J Physiol Cell Physiol. 2012 Nov;303(9):C954–62.
- Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011 Jul;96(7):1911–30.
Ashok Kumar, Krishna Agarwal, Salam G Devi, Ram K Gupta: Hypocalcemia in Pregnant Women Biological Trace Element Research July 2010, Volume 136, Issue 1, pp 26–32
- Repke JT (1994) Calcium homeostasis in pregnancy. Clin Obstet Gynecol 37(1):59–65
- Holick MF (2007) Vitamin D deficiency. N Engl J Med 357(3):266–281
- Ainy E, Ghazi AA, Azizi F (2006) Changes in calcium, 25(OH) vitamin D3 and other biochemical factors during pregnancy. J Endocrinol Investig 29(4):303–307
- Sachan A, Gupta R, Das V, Agarwal A, Awasthi PK, Bhatia V (2005) High prevalence of vitamin D deficiency among pregnant women and their newborn in Northern India. Am J Clin Nutr 81(5):1060–1064
- udkins A, Eagleton C (2006) Vitamin D deficiency in pregnant New Zealand women. N Z Med J 119(1241):U2144
- Mannino DM, Homa DM, Akinbami LJ, Moorman JE, Gwynn C, Redd SC. Surveillance for asthma–United States, 1980–1999. MMWR Morb Mortal Wkly Rep Surveill Summ. 2002;51:1–13.
- McKeever TM, Britton J. Diet and asthma. Am J Respir Crit Care Med. 2004;170:725–9.
- Cantorna MT, Zhu Y, Froicu M, Wittke A. Vitamin D status, 1,25-dihydroxyvitamin D3, and the immune system. Am J Clin Nutr. 2004;80(suppl):1717S–20S
- Warner JA, Jones CA, Jones AC, Warner JO. Prenatal origins of allergic disease. J Allergy Clin Immunol. 2000;105(suppl):S493–8.
- Devereux G, Seaton A. Diet as a risk factor for atopy and asthma. J Allergy Clin Immunol. 2005;115:1109–17.
- Annesi-Maesano I. Perinatal events, vitamin D, and the development of allergy. Pediatr Res. 2002;52:3–5.
- Menditto A., Musone R., De Franciscis P., Di Prisco L., Cassese E., Balbi G. C., Balbi C.: “La condotta ostetrica nello IUGR”. Minerva Ginecologica 2000 Gennaio-Febbraio;52(1-2):15-24
- Figueras, F. and Gardosi, J. Intrauterine growth restriction: new concepts in antenatal surveillance, diagnosis, and management. Am J Obstet Gynecol. 2011; 204: 288–300
- Roberge S, Giguere Y, Villa P, Nicolaides K, Vainio M, Forest JC, et al. Early administration of low-dose aspirin for the prevention of severe and mild preeclampsia: a systematic review and meta-analysis. Am J Perinatol 2012;29: 551e6
- Leitich H, Egarter C, Husslein P, Kaider AK, Schemper M. A meta-analysis of low dose aspirin for the prevention of intra uterine growth retardation. Br J Obstet Gynaecol. 1997;104:450–9.
- Bujold, Emmanuel et al: Prevention of Preeclampsia and Intrauterine Growth Restriction With Aspirin Started in Early Pregnancy: A Meta-Analysis. Obstetrics & Gynecology: August 2010 – Volume 116 – Issue 2, Part 1 – pp 402-414
- Stéphanie Roberge a Pia Villa d Kypros Nicolaides f Yves Giguère c Merja Vainio e Abdelouahab Bakthi g Alaa Ebrashy h Emmanuel Bujold Early Administration of Low-Dose Aspirin for the Prevention of Preterm and Term Preeclampsia: A Systematic Review and Meta-Analysis. Fetal Diagn Ther 2012;31:141–146
- Ebrashy A, Ibrahim M, Marzook A, Yousef D: Usefulness of aspirin therapy in high-risk pregnant women with abnormal uterine artery Doppler ultrasound at 14–16 weeks pregnancy: randomized controlled clinical trial. Croat Med J 2005;46:826–831.
- Vainio M, Kujansuu E, Iso-Mustajarvi M, Maenpaa J: Low-dose acetylsalicylic acid in prevention of pregnancy-induced hypertension and intrauterine growth retardation in women with bilateral uterine artery notches. BJOG 2002;109:161–167.
- Bakhti A, Vaiman D: Prevention of gravidic endothelial hypertension by aspirin treatment administered from the 8th week of gestation. Hypertens Res 2011; 34: 1116– 1120.
- Caritis S, Sibai B, Hauth J, Lindheimer MD, Klebanoff M, Thom E, et al. Low-dose aspirin to prevent preeclampsia in women at high risk. National Institute of Child Health and Human Development Network of Maternal-Fetal Medicine Units. N Engl J Med. 1998 Mar 12;338(11):701–5.
- Adam J. Duhl et al: “Antithrombotic therapy and pregnancy: consensus report and recommendations for prevention and treatment of venous thromboembolism and adverse pregnancy outcomes”. American Journal of Obstetrics and Gynecology. 2007;197, Issue 5, November 2007, Pages 457.e1–457.e21
- Soothill PW, Nicolaides KH, Campbell S. Prenatal asphyxia, hyperlacticaemia, hypoglycaemia, and erythroblastosis in growth retarded fetuses. Br Med J [Clin Res]. 1987;294:1051–3.
- D. Bartholdi, M. Krajewska-Walasek; K. Ounap; H. Gaspar; KH. Chrzanowska; H. Ilyana; H. Kayserili; IW. Lurie; A. Schinzel; A. Baumer, Epigenetic mutations of the imprinted IGF2-H19 domain in Silver-Russell syndrome (SRS): results from a large cohort of patients with SRS and SRS-like phenotypes., in J Med Genet, vol. 46, nº 3, marzo 2009, pp. 192-7,
- MG. Butler, Genomic imprinting disorders in humans: a mini-review., in J Assist Reprod Genet, vol. 26, 9-10, pp. 477-86



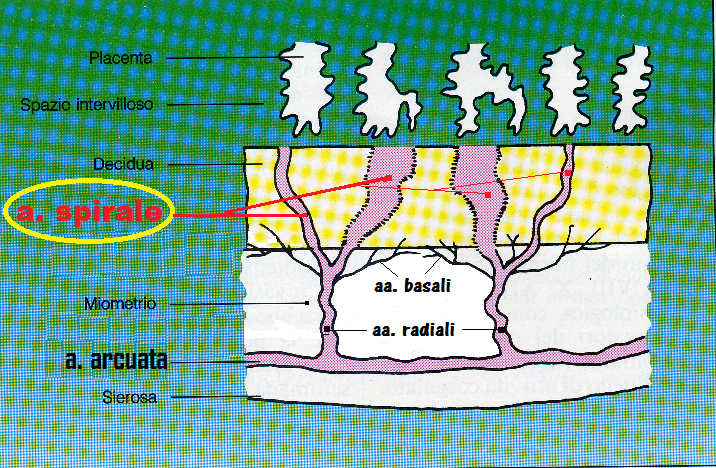


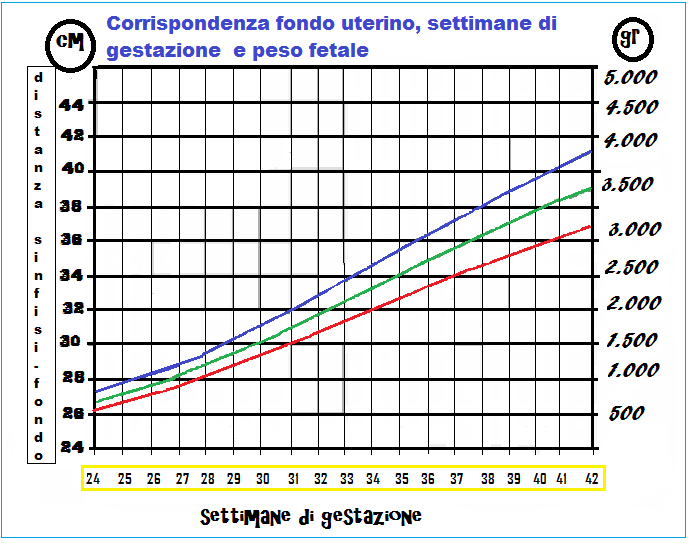




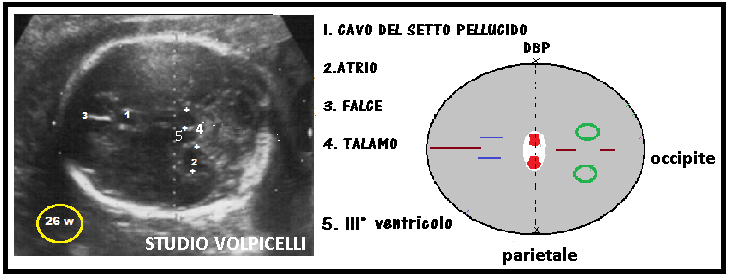




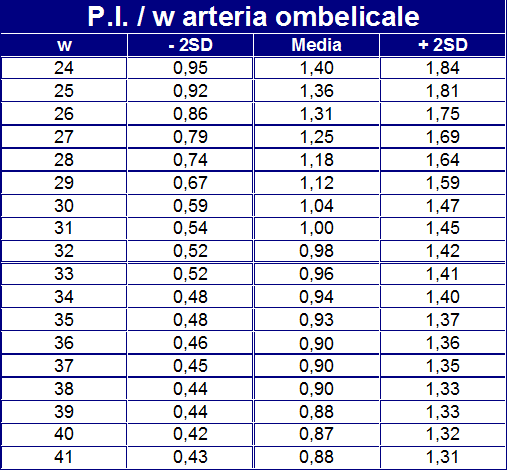







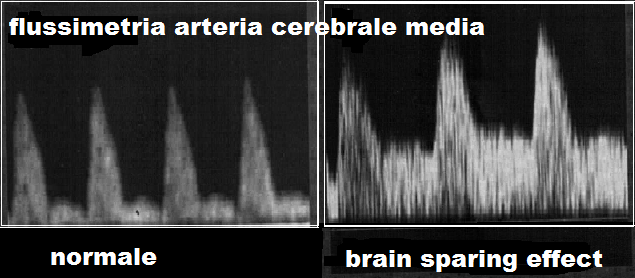

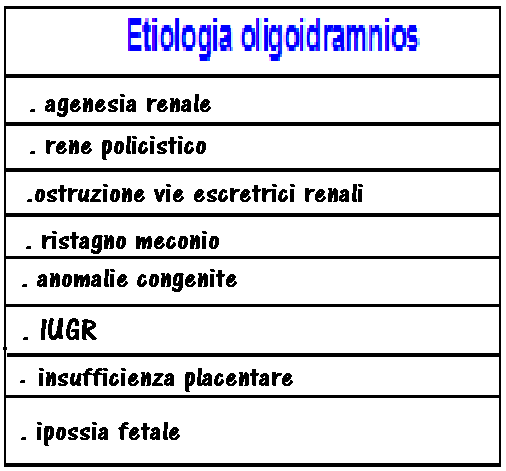




17 commenti
Awesome! Its really remarkable article, I have got much clear idea concerning from this
post.
Peculiar article, totally what I wanted to find.
Everything is very open with a very clear description of the issues.
It was really informative. Your website is very useful.
Thanks for sharing!
Pretty! This has been an incredibly wonderful article.
Thanks for supplying this information.
I was recommended this website by my cousin. I am not sure whether this post is written by him as
nobody else know such detailed about my problem. You are
wonderful! Thanks!
WOW just what I was looking for. Came here by searching for news
Wow, this piece of writing is good, my younger sister is analyzing these kinds of
things, thus I am going to let know her.
No problem. In fact I am very pleased to disclose my information. May I know who you are and what your interests preminent?
cordial greetings
Excellent post. Keep writing such kind of info on your blog.
Im really impressed by your site.
Hi there, You have performed a great job. I’ll certainly digg it
and individually recommend to my friends.
I’m sure they’ll be benefited from this website.
Yes! Finally someone writes about buy electric cigarettes.
Hello there! This post couldn’t be written any better!
Reading this post reminds me of my previous room mate!
He always kept talking about this. I will forward this post to him.
Pretty sure he will have a good read. Many thanks for sharing!
Does your website have a contact page? I’m having problems locating it but, I’d like to
send you an e-mail. I’ve got some suggestions for your blog you
might be interested in hearing. Either way, great blog and I look forward to seeing it develop over
time.
Tremendous things here. I’m very happy to look your article.
Thank you a lot and I am taking a look forward to touch you.
Will you please drop me a e-mail?
Woah! I’m really loving the template/theme of this blog. It’s simple, yet effective.
A lot of times it’s tough to get that “perfect balance” between usability and visual appeal.
I must say that you’ve done a excellent job with this.
Additionally, the blog loads very quick for me on Firefox.
Excellent Blog!
I am in fact glad to glance at this web site posts which carries lots of helpful information, thanks for providing
these kinds of information.
Pretty nice post. I just stumbled upon your weblog and wished to say that I have truly enjoyed surfing around your blog posts.
After all I’ll be subscribing to your rss feed and I hope you write again very soon!
Magnificent goods from you, man. I’ve understand your stuff previous to
and you are just too fantastic. I actually like what you’ve acquired here, certainly like what
you’re stating and the way in which you say it.
You make it entertaining and you still care for to keep it
sensible. I can not wait to read far more from you.
This is actually a wonderful site.