La terapia del ca. ovarico prevede un intervento chirurgico e chemioterapia in fase pre-operatoria per ridurre la  massa tumorale e in fase post-chirurgica per evitare metastasi e nei casi di recidiva (1-3).
massa tumorale e in fase post-chirurgica per evitare metastasi e nei casi di recidiva (1-3).
La chirurgia permette non solo la completa asportazione della neoplasia macroscopicamente evidente, ma consente di ottenere informazioni anatomo-chirurgiche dettagliate. Queste potranno fornire indicazioni utili alla selezione di pazienti sensibili a specifici trattamenti adiuvanti (5,6).
Il trattamento del carcinoma ovarico rimane comunque di natura multidisciplinare. Anche la presenza dello psicologo nel team curante è fortemente raccomandata perché, tenendo conto dei bisogni complessivi della donna, migliora le opportunità di ripresa psicofisica (7-12).
Terapia chirurgica: il cancro ovarico agli stadi I-II-III è operabile. L’intervento chirurgico è associato con chemioterapia pre- o post-intervento. L’intervento chirurgico prevede prelievo del liquido peritoneale ed esame citologico estemporaneo (washing), isterectomia totale extra-fasciale per via addominale e annessiectomia bilaterale con asportazione, ove possibile, di tutta la massa macroscopicamente visibile. E’ inoltre necessario procedere ad omentectomia infracolica e linfadenectomia pelvica e para-aortica. Devono essere ispezionate le logge paracoliche. e praticate biopsie multiple del peritoneo data la comune derivazione di ovaio e peritoneo dall’epitelio celomatico embrionale. Infatti la carcinosi peritoneale è la principale e più frequente evoluzione del cancro dell’ovaio. E’ necessario inoltre esplorare tutto l’intestino, il fegato e la milza per scoprire eventuali metastasi (13-17).
Fino ad oggi si riteneva che le cellule mesoteliali, che rivestono gli organi della cavità addominale, fossero solo vittime ‘passive’ dei processi di metastatizzazione Uno studio pubblicato su Journal of Clinical Investigation rivela che le cellule mesoteliali hanno un ruolo attivo nell’attirare le metastasi di cancro dell’ovaio. le cellule mesoteliali umane secernono fibronectina, in presenza di cellule tumorali ovariche. Andando inoltre a studiare lo stroma tumorale di un centinaio di metastasi omentali, i ricercatori hanno evidenziato che la fibronectina risultava sempre iperepressa in queste pazienti. Gli stessi ricercatori hanno anche dimostrato che le cellule di tumore ovarico secernono TGF-beta1, che a sua volta attiva nelle cellule mesenchimali una via di segnale (la TGF-β receptor/RAC1/SMAD dipendente), in grado di facilitare un fenotipo mesenchimale e la upregulation della trascrizione della fibronectina. Bloccando con degli anticorpi la funzione alfa 5 o beta1-integrina, gli autori dello studio sono riusciti a ridurre la formazione di metastasi, in un modello preclinico di metastasi da carcinoma ovarico.
Ca. ovarico avanzato: dalla completezza della rimozione dipende la sopravvivenza della paziente (65). Uno studio del Gynecologic Oncology Group ha dimostrato che le mediane di sopravvivenza, per pazienti con residuo tumore inferiore o uguale a 1 cm e di 2 cm erano rispettivamente di 37 e 31 mesi, mentre con una malattia residua maggiore di 2 cm la sopravvivenza mediana scendeva a 21 mesi (66). Attualmente la citoriduzione si definisce ottimale quando il residuo tumore è ≤1 cm, in accordo con la definizione proposta dal Gynecologic Oncology Group nel 1986 (protocollo numero 97) (67). Tuttavia, in considerazione della diretta correlazione tra residuo tumore e sopravvivenza, l’obiettivo del chirurgo dovrebbe essere, ove possibile, quello di non lasciare malattia residua intraddominale.Nei casi nei quali non sia stato possible ottenere una citoriduzione ottimale al primo intervento senza progressione di malattia dopo i primi 3 cicli di chemioterapia è proponibile una strategia terapeutica innovativa definita “chirurgia di intervallo”. Questa deve essere intesa come procedura chirurgica con intenti citoriduttivi dopo trattamento chemioterapico di induzione (68,69). Un’ulteriore strategia terapeutica, che ha il suo razionale proprio nella chirurgia di intervallo nell’esperienza retrospettiva non randomizzata di diversi gruppi europei e nordamericani, è rappresentata dalla cosiddetta chemioterapia neoadiuvante. Questa ha come obiettivo principale quello di ridurre la massa neoplastica nei tumori avanzati per diminuire il rischio di complicanze perioperatorie a parità di risultati terapeutici.Tale approccio è da considerarsi tuttora sperimentale.
- esame macroscopico, con descrizione di forma, consistenza e dimensioni della neoformazione e de
 l profilo e aspetto della capsula se presente (uniforme, liscia, presenza o meno di arborescenze sulla sua superficie e loro estensione);
l profilo e aspetto della capsula se presente (uniforme, liscia, presenza o meno di arborescenze sulla sua superficie e loro estensione); - descrizione della neoplasia al taglio, relativamente a colore, aspetto, presenza o meno di aree necrotiche ed emorragiche, se la neoformazione è solida. Se è parzialmente cistica o cistica in toto descrizione del contenuto e annotazione dell’eventuale presenza, sulla superficie interna, di macro o micro escrescenze;
- campionatura mirata e multipla della lesione, assolutamente indispensabile, in particolare quando la diagnosi istologica intraoperatoria nei primi campioni non è di carcinoma franco, ma di tumore sieroso borderline (dai dati riportati in letteratura tali neoplasie hanno un’incidenza del 10% circa nell’ambito dei tumori epiteliali) oppure di tumori a istotipo diverso quali i mucinosi (struttura complessa), gli endometrioidi (eventuale presenza di aree di TMMM), eccetera.
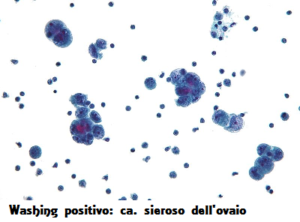 poiché tali neoplasie sono, in genere, complesse. La citomorfologia può indicare grossolanamente se si è in presenza di una lesione benigna o maligna.Se non vi sono alternative a questa metodica, si raccomanda di eseguire gli strisci per apposizione mirata, dopo aver evidenziato le aree sospette (colorazione con blu di toluidina o ematossilina/eosina).
poiché tali neoplasie sono, in genere, complesse. La citomorfologia può indicare grossolanamente se si è in presenza di una lesione benigna o maligna.Se non vi sono alternative a questa metodica, si raccomanda di eseguire gli strisci per apposizione mirata, dopo aver evidenziato le aree sospette (colorazione con blu di toluidina o ematossilina/eosina).Lo stadio IV è inoperabile e la sola opportunità terapeutica è costituita dalla chemioterapia, ma esiste la possibilità di una chirurgia citoriduttiva con intenti curativi in casi selezionati.
TERAPIA ADIUVANTE:
- Le donne affette da neoplasia epiteliale maligna dell’ovaio allo stadio FIGO Ia e Ib e istologia “favorevole” (istotipi non a cellule chiare, bene o moderatamente differenziati) non sembrano beneficiare di alcuna terapia adiuvante post-chirurgica. In tale gruppo di pazienti, infatti, la sopravvivenza libera da malattia è così alta dopo sola chirurgia (>90% a 6 anni) da non rendere necessaria l’adozione di un trattamento adiuvante (70).
- donne affette da neoplasie allo stadio FIGO Ia e Ib e istologia “sfavorevole” (istotipi scarsamente differenziati o a cellule chiare) e quelle allo stadio Ic e II, sembrano beneficiare di un trattamento chemioterapico adiuvante post-chirurgico con platino. Quale sia il trattamento adiuvante ottimale per questo gruppo di pazienti ad alto rischio di recidiva (25-45%) è tutt’ora oggetto di discussione.
- Il Cancro in Italia. I dati di incidenza dei Registri Tumori. Volume terzo: 1993-98. Plaxe SC. Epidemiology of low-grade serous ovarian cancer. Am J Obstet Gynecol 2008; 198: 459.e1-459.e9
- Vaidya AP et al. The follow-up of ovarian cancer. Sem Oncol 2003; 30: 401-12
- Jekmal A, Siegel R, Ward E, et al.: Cancer statistics, 2008. CA Cancer J Clin2008, 58:71–96
- Greenlee RT, Murray T, Bolden S, Wingo PA. 2000. Cancer statistics, 2000. CA Cancer J Clin 50: 7-33
- Kliewer EV, Smith KR. 1995. Ovarian cancer mortality among immigrants in Australia and Canada. Cancer Epidemiol Biomarkers Prev 4: 453-458
- Singer G, Oldt R, 3rd, Cohen Y, et al: Mutations in BRAF and KRAS characterize the development of low-grade ovarian serous carcinoma. J Natl Cancer Inst 2003; 95:484-6
- Mirjam J.A. Engelen, M.D.Henk W.A. de Bruijn, Ph.D. et al: “Serum CA 125, Carcinoembryonic Antigen, and CA 19-9 as Tumor Markers in Borderline Ovarian Tumors”.Gynecologic Oncology July 2000 Volume 78, Issue 1, Pages 16–20
- Berrino F et al (eds). Survival of cancer patients in Europe: the EUROCARE-2 Study. IARC ScientificPublications No 151. Lyon: IARC Press, 1999
- Bell R et al. Screening for ovarian cancer: a systematic review. Health Technol Assess 1998; 2:1-84.
- Jacobs IJ et al. Screening for ovarian cancer: a pilot randomised controlled trial. Lancet 1999; 353:1207-10.
- Einhorn N et al. Long-term follow-up of the Stockholm screening study on ovarian cancer. Gynecol
- Oncol 2000; 79: 466-70.Brunet JS et al. Effect of smoking on breast cancer in carriers of mutant BRCA1 and BRCA2 genes. J Natl Cancer Inst 1998; 90; 761-66.
- Narod SA et al. Tubal ligation and risk of ovarian cancer in carriers of BRCA1 or BRCA2 mutations: a case control study. Lancet 2001; 357: 1467-70
- National Cancer Institute. Ovarian Cancer (PDQ®) Prevention (http://www.cancer.gov/cance-rinfo/pdq/prevention/ovarian/
- Smith LH et al. Detection of malignant ovarian neoplasm(s): a review of the literature. I. Detection of the patient at risk; clinical, radiological and cytological detection. Obstet Gynecol Surv 1984; 39:313-28.
- Yancik R et al. Ovarian cancer in the elderly: an analysis of surveillance, epidemiology, and end results program data. Am. J. Obstet. Gynecol. 1986; 154: 639-47.Easton DF et al. Cancer mortality in relatives of women with ovarian cancer: the OPCS study. Int JCancer 1996; 65: 284-94
- Piver MS et al. Primary peritoneal carcinoma after prophylactic oophorectomy in women with a family history of ovarian cancer. A report of the Gilda Radner Familial Ovarian Cancer Registry. Cancer 1993; 71: 2751-55.
- Naylor B. Pleural, peritoneal and pericardial fluids. In Bibbo M. (ed) Comprehensive cytopathology. Philadelphia: Saunders, 1997 (2nd ed), 551-621.
- Zuna RE et al. Peritoneal washing cytology in gynecologic cancers: long-term follow-up of 355 patients. J Natl Cancer Inst 1996; 88: 980-87.Griffiths CT. Surgical resection of tumor bulk in the primary treatment of ovarian carcinoma. NatlCancer Inst Monogr 1975; 42: 101-04
- Hoskins WJ et al. The influence of cytoreductive surgery on recurrent-free interval and survival in small-volume stage III epithelial ovarian cancer: a Gynecologic Oncology Group study. Gynecol Oncol 1992; 47: 159-66.
- Chen KT, Schooley JL, Flam MS. Peritoneal carcinomatosis after prophylactic oophorectomy in familial ovarian cancer syndrome. Obstet Gynecol. 1985;66:(suppl 3) 93S-94S
- Paley PJ, Swisher EM, Garcia RL. et al. Occult cancer of the fallopian tube in BRCA1 germline mutation carriers at prophylactic oophorectomy: a case for recommending hysterectomy at surgical prophylaxis. Gynecol Oncol. 2001;80:176-180
- Colgan TJ, Boerner SL, Murphy KJ, Cole DE, Narod SA, Rosen B. Peritoneal lavage cytology: an assessment of its value during prophylactic oophorectomy. Gynecol Oncol. 2002;85:397-403
- Finch A, Shaw P, Rosen B, Murphy J, Narod SA, Colgan TJ. Clinical and pathologic findings of prophylactic salpingo-oophorectomies in 159 BRCA1 and BRCA2 carriers [epub]. Gynecol Oncol. 2005;100:58-64


