Gli anticorpi antispermatozoi (ASA) sono immunoglobuline IgA, IgG e, più raramente, IgM diretti contro gli antigeni degli spermatozoi. Non sono comuni, ma sia gli uomini che le donne possono produrli quando gli spz. vengono a contatto con il sistema immunitario e perciò possono essere ritrovati nel liquido seminale, secrezioni uretrali e nel siero degli uomini, nel muco cervicale, nel liquido follicolare e nel siero delle donne. In queste ultime gli ASA possono formarsi in seguito ad una reazione immunitaria al seme del partner in seguito a rapporti sessuali anche per via orale o anale (1-3).
 Eziologia – A livello dei testicoli, è presente la barriera emato-testicolare che separa il liquido seminale dal sistema circolatorio e quindi dal sistema immunitario. A seguito di tumori o traumi testicolari, biopsia, vasectomia, ostruzioni epididimarie, infezioni testicolari o della prostata, lo sperma di un uomo potrebbe venire a contatto con il suo sistema immunitario e determinare la produzione di auto-anticorpi antispermatozoo (4-6).
Eziologia – A livello dei testicoli, è presente la barriera emato-testicolare che separa il liquido seminale dal sistema circolatorio e quindi dal sistema immunitario. A seguito di tumori o traumi testicolari, biopsia, vasectomia, ostruzioni epididimarie, infezioni testicolari o della prostata, lo sperma di un uomo potrebbe venire a contatto con il suo sistema immunitario e determinare la produzione di auto-anticorpi antispermatozoo (4-6).
Gli anticorpi maschili attaccano gli spermatozoi anche nell’uomo perchè gli spz. sono costituiti da un corredo cromosomico aploide e quindi non riconosciuti come “self” dal sistema immunitario dello stesso individuo (le cellule dell’organismo sono composte da 46 cromosomi).
Gli ASA possono indurre la formazione di sostanze tossiche che possono danneggiare direttamente gli spermatozoi o porzioni dello spermatozoo interferendo con la fertilità in modi diversi: se gli ASA interagiscono con la coda (flagello) dello spermatozoo, tendono a ridurne la motilità e a farli agglutinare tra loro; quando aderiscono alla testa, invece, possono impedirne la penetrazione attraverso il muco cervicale femminile, ridurne la capacitazione e l’attitudine alla fecondazione. La presenza di ASA è si ritrova nel nel 20% circa delle coppie infertili ma non sempre la presenza di ASA induce infertilità (7-13).
Indicazioni per la ricerca di ASA: non tutti gli AA. concordano sull’utilità del dosaggio degli ASA data la scarsa utilità dei farmaci a disposizione per la terapia; comunque le indicazioni principali sono:
- oligo-astenospermia
- teratospermia
- agglutinazioni nel liquido seminale;
- infertilità inspiegata
- malattie sistemiche autoimmuni
- vasectomia – il 75% degli uomini vasectomizzati e anche quelli che hanno invertito il processo con vasovasostomia hanno alti livelli di ASA nel sangue.
- rapporti non protetti, prostitute e donne con svariati partners – Circa il 40-45% di queste categorie risulta positivo agli anticorpi antispermatozoi (42-44).
DIAGNOSTICA –
- MAR test Mixed Anti-globuline Reaction – è un test diagnostico diretto, effettuato sul liquido seminale per valutare lo stato d’infertilità immunologica e consente di identificare l’eventuale presenza di ASA sulla superficie degli spermatozoi. Il liquido seminale è raccolto per masturbazione dopo un periodo di 2-5 gg di astinenza. Viene quindi effettuato in laboratorio un prelievo venoso alla partner. Il MAR test è considerato positivo se gli ASA sono presenti su oltre il 50% degli spermatozoi. In tal caso si parla di infertilità immunologica e la possibilità di gravidanze spontanee è molto bassa. Invece una gravidanza spontanea è impossibile in presenza di >90% di spermatozoi ricoperti da ASA.
- GAT Test (Gelatin Agglutination Test) nel liquido seminale
- TAT nel liquido seminale e nel siero
- SIT nel siero
- Micro-SIT nel muco cervicale
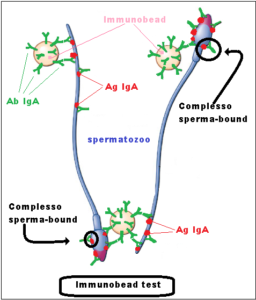
- Immunobead test (IgG, IgA, IBT) nel liquido seminale. E’ il test più specifico per la ricerca ASA. Piccole sfere di plastca sono ricoperte do antigeni o anticorpi che causano agglutinazioni in presenza di corrispondenti anticorpi o antigeni. Il test è considerato positivo se >25% delle sfere risulta conglutinato con gli spermatozoi
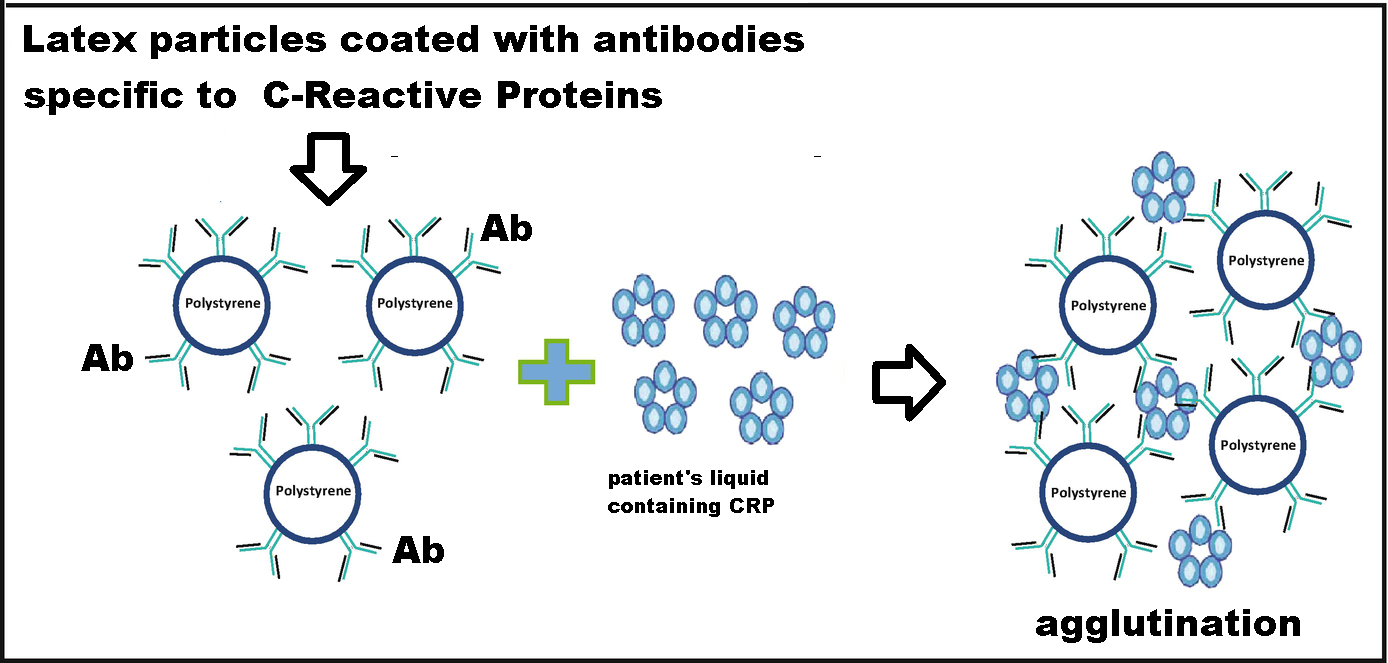
- Latex Agglutination test – Il test di agglutinazione al lattice è un metodo di laboratorio per il controllo di alcuni anticorpi o antigeni in una varietà di fluidi corporei tra cui liquido seminale, liquido follicolare, saliva, urina, liquido cerebrospinale o sangue. Il campione viene inviato al laboratorio dove viene mescolato con perle di lattice rivestite con un anticorpo o antigene specifico. Se la sostanza sospetta è presente, i granuli di lattice si agglutineranno insieme. I risultati di agglutinazione al lattice richiedono 15-60′ (33-41).
TERAPIA – prevede 3 step:
- Terapia eziologica: trattamento della condizione patologica che ha indotto lo sviluppo degli anticorpi anti-spermatozoi.
- Farmaci steroidei, come il cortisone, che deprimono il sistema immunitario con lo scopo di ridurre la presenza di anticorpi. 20 mg/die di prednisone (Deltacortene® cpr 5 mg, 25 mg) dal 1° giorno al 10° giorno del ciclo della partner e poi 5 mg/die fino al giorno dell’ovulazione (14-21).
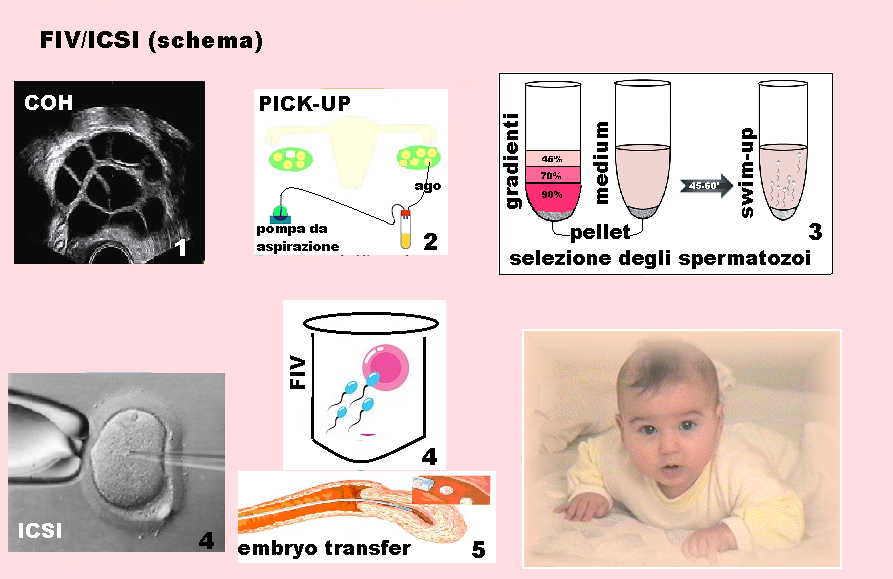
- FIV/ICSI IUI (Inseminazione intrauterina) con utilizzo dei gradienti di Percoll e tecnica Swim-up (22-30).
Gradienti di Percoll – Le tecniche più diffuse su gradiente di Percoll utilizzano gradienti piccoli e discontinui con due o tre strati; è da utilizzare nei casi di oligo-astenospermia grave (<5 milioni di spermatozoi per eiaculato). Tale gradiente utilizza tre strati da 0.3 mL di Percoll isotonico rispettivamente al 50%, 70% e al 95%. L’utilizzo, nelle fasi di lavaggio iniziale, di pentossifillina (una molecola antiossidante) determina un miglioramento sostanziale nelle percentuali di fertilizzazione alla IVF.
Gradienti di mini-Percoll sono preparati in provette coniche da centrifuga, caricate con il pellet di spermatozoi lavati e risospesi in 0.3mL di medium di coltura e quindi centrifugati a 300 giri per 30-45 minuti. La separazione in base al gradiente permette di eliminare detriti cellulari ed acellulari, batteri e di recuperare gli spermatozoi mobili,presenti nelle frazioni più concentrate del gradiente e morfologicamente normali localizzati nel sedimento. Questa metodica trova quindi indicazione nei casi di oligoastenospermia severa.
Swim-up – dopo la liquefazione (30′ circa dalla raccolta), il liquido seminale viene posto in 4 separate provette e miscelato con una quantità doppia di medium di cultura. Tutto il preparato è quindi centrifugato a 600-800 giri per 4-6 minuti. Quindi si elimina da ogni provetta il sopranatante e il pellet complessivo è riunito in una sola provetta e quindi risospeso in un terreno di coltura fresco e lasciato incubare a 37°C per 40-60 minuti.
References:
- ALombardo F, Gandini L, Dondero F, Lenzi Antisperm immunity in natural and assisted reproduction.
Hum Reprod Update. 2001 Sep-Oct;7(5):450-6 - R., YAMANO S., KAMADA M., DAITOH T., AONO T.: Effect of sperm-immobilizing antibodies on the acrosome reaction of human spermatozoa. Fertil Steril, 57:387–92, 1992.
- CHECK J.H., ADELSON H.G., BOLLENDORF A.: Effect of antisperm antibodies on computerized semen analysis. Arch Androl, 27:61–3, 1991.
- KREMER J., JAGER S.: The significance of antisperm antibodies for sperm and cervical mucus interaction. Hum Reprod, 7:781– 4, 1992.
- DUBIN L., AMELAR R.D.: Etiologic factors in 1294 consecutive cases of male infertility. Fertil Steril, 22:469–81, 1971.
- STEWART B.H.: Varicocele in infertility: incidence and results of surgical therapy. J Urol, 112:222–8, 1974.
- WITKIN S.S., KLIGMAN I., BONGIOVANNI A.M.: Relationship between asymptomatic male genital tract exposure to Chlamydia trachomatis and an autoimmune response to spermatozoa. Hum Reprod, 10: 2952–5, 1995.
- EGGERT-KRUSE W., HOFSAB A., HAURY E., TILGEN W., GERHARD I., RUNNEBAUM B.: Relationship between local anti-sperm antibodies and spermmucus interaction in vitro and in vivo. Hum Reprod, 6:267–76, 1991.
- CLARKE G.N.: Immunoglobulin class and regional specificity of antispermatozoal autoantibodies blocking cervical mucus penetration by human spermatozoa. Am J Reprod Immunol Microbiol, 16:135– 8, 1988.
- MENGE A.C., BEITNER O.: Interrelationships among semen characteristics, antisperm antibodies, and cervical mucus penetration assays in infertile human couples. Fertil Steril, 51:486 –92, 1989.
- DIMITROV D.G., URBANEK V., ZVERINA J., MADAR J., NOUZA K., KINSKY R.: Correlation of asthenozoospermia with increased antisperm cell-mediated immunity in men from infertile couples. J Reprod Immunol, 27:3–12, 1994.
- FANN C.H., LEE C.Y.G.: Monoclonal antibodies affecting sperm-zona binding and/or zona-induced acrosome reaction. J Reprod Immunol, 21:175– 87, 1992.
- FRANCAVILLA F., ROMANO R., SANTUCCI R.: Effect of sperm-antibodies on acrosome reaction of human sperm used for the hamster egg penetration assay. Am J Reprod Immunol 25:77– 80, 1991.
- GILBERT B.R., WITKIN S.S., GOLDSTEIN M.: Correlation of sperm-bound immunoglobulins with impaired semen analysis in infertile men with varicoceles. Fertil Steril, 52:469 –73, 1989.
- HAAS G.G. Jr, MANGANIELLO P.: A double-blind, placebo-controlled study of the use of methylprednisolone in infertile men with sperm-associated immunoglobulins. Fertil Steril, 47:295–301, 1997.
- KORTEBANI G., GONZALES G.F., BARRERA C., MAZZOLLI A.B.: Leukocyte populations in semen and male accessory gland function: relationship with antisperm antibodies and seminal quality. Andrologia, 24:197–204, 1992.
- LAHTEENMAKI A., VEILAHTI J., HOVATTA O.: Intra-uterine insemination versus cyclic, low-dose prednisolone in couples with male antisperm antibodies. Hum Reprod, 10:142–7, 1995.
- MATHUR S., BARBER M., CARLTON M., ZIEGLER J., WILLIAMSON H.O.: Motion characteristics of spermatozoa from men with cytotoxic sperm antibodies. Am J Reprod, Immunol Microbiol, 12:87–9, 1986.
- STEEN Y., FORSSMAN L., LONNERSTEDT E., JONASSON K., WASSEN A.C., LYCKE E.: Anti-sperm IgA antibodies against the equatorial segment of the human spermatozoon are associated with impaired sperm penetration and subfertility. Int J Fertil, 39:52–6, 1994.
- TSUKI S., NODA Y., YANO J., FUKUDA A., MORI T.: Inhibition of sperm penetration through human zona pellucida by antisperm antibodies. Fertil Steril, 46:92–6, 1986.
- WOLFF H., POLITCH J.A., MARTINEZ A., HAIMOVICI F., HILL J.A., ANDERSON D.J.: Leukocytospermia is associated with poor semen quality. Fertil Steril, 53:528 –36, 1990.
- ZOUARI R., DE ALMEIDA M.: Effect of sperm associated antibodies on human sperm ability to bind to zona pellucida and to penetrate zona-free hamster oocytes. J Reprod Immunol, 24:175– 86, 1993.
-
Daniela Pasquali Prevalence of antisperm antibodies by SpermMARtest in subjects undergoing a routine sperm analysis for infertility International Journal of Andrology, 1993
-
Test immuno-bead (IgG-IgA-IBT) nel muco cervicale per la diagnosi di isoimmunizzazione antispermata in pazienti infertili con PCT negativo o dubbio. Cimino C, Barba G, Bevilacqua S, Perino A, Cittadini E.Acta Eur Fertil. 1988 maggio-giugno; 19 (3): 121-7.
- ROBINSON J.N., FORMAN R.G., NICHOLSON S.C., MACIOCIA L.R., BARLOW D.H.: A comparison of intrauterine insemination in superovulated cycles to intercourse in couples where the male is receiving steroids for the treatment of autoimmune infertility. Fertil Steril, 63:1260–6, 1995.
- A.: Treatment of immunological infertility by sperm washing and intrauterine. Arch Androl, 29:207–13, 1992.
- . Sperm antibodies and human fertilization. Am J Reprod Immunol. 1988;17:65–71.
- . Immunology and immunopathology of the male genital tract (Antisperm immunity in natural and assisted reproduction). Hum Reprod Update. 2001;7:450–456.
- . Relationship of epididymal sperm antibodies to their in vitro fertilization capacity in men with congenital absence of the vas deferens. Fertil Steril. 1992;58:1006–1010.
- . The effects on in-vitro fertilization of autoantibodies to spermatozoa in subfertile men. Hum Reprod. 1993;8:1079–1082.
- . Intracytoplasmic sperm injection for treating infertility associated with sperm autoimmunity. Fertil Steril. 1997;68:112–117.
- . Relationship between circulating antisperm antibodies in women and autoantibodies on the ejaculated sperm of their partners. Am J Obstet Gynecol. 1989;161:900–903.
- . Seminal “priming” for protection from pre-eclampsia—a unifying hypothesis. J Reprod Immunol. 2003;59:253–265.
-
Guo L, Liu S, Zhang S, Chen Q, Zhang M, Quan P, et al. C-reactive protein and risk of breast cancer: a systematic review and meta-analysis. Sci Rep. 2015;5:10508.
-
Mahmoud FA, Rivera NI. The role of C-reactive protein as a prognostic indicator in advanced cancer. Curr Oncol Rep. 2002;4(3):250–5
-
Heikkila K, Harris R, Lowe G, Rumley A, Yarnell J, Gallacher J, et al. Associations of circulating C-reactive protein and interleukin-6 with cancer risk: findings from two prospective cohorts and a meta-analysis. Cancer Causes Control. 2009;20(1):15–26.
-
Poole EM, Lee IM, Ridker PM, Buring JE, Hankinson SE, Tworoger SS. A prospective study of circulating C-reactive protein, interleukin-6, and tumor necrosis factor alpha receptor 2 levels and risk of ovarian cancer. Am J Epidemiol. 2013;178(8):1256–64.
-
Yousuf O, Mohanty BD, Martin SS, Joshi PH, Blaha MJ, Nasir K, et al. High-sensitivity C-reactive protein and cardiovascular disease: a resolute belief or an elusive link? J Am Coll Cardiol. 2013;62(5):397–408.
-
Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest. 2003;111(12):1805–12.
-
Kuller LH, Tracy RP, Shaten J, Meilahn EN. Relation of C-reactive protein and coronary heart disease in the MRFIT nested case-control study. Multiple Risk Factor Intervention Trial. Am J Epidemiol. 1996;144(6):537–47.
-
Musunuru K, Kral BG, Blumenthal RS, Fuster V, Campbell CY, Gluckman TJ, et al. The use of high-sensitivity assays for C-reactive protein in clinical practice. Nat Clin Pract Cardiovasc Med. 2008;5(10):621–35.
-
Ridker PM, Cushman M, Stampfer MJ, Tracy RP, Hennekens CH. Inflammation, aspirin, and the risk of cardiovascular disease in apparently healthy men. N Engl J Med. 1997;336(14):973–9.
- Selvaraj, Kamala; Selvaraj, Priya (2014). “Capitolo 24: Immunologia in infertilità”. In Rao, Kamini; Carp, Howard; Fischer, Robert. Principi e pratica della tecnologia di riproduzione assistita, volume 1 . JP Medical Ltd. p. 311. ISBN 9789350907368 . OCLC 865062991
- Krause, Walter KH; Naz, Rajesh K. (2017). “Prefazione”. A Krause, Walter KH; Naz, Rajesh K. Immunità Infertilità: Impatto delle reazioni immunitarie sulla fertilità umana (2a ed.). Springer.
- Marconi, Marcelo; Shetty, Wolfgang Weidner (2017). “Capitolo 8: M Sito e fattori di rischio della produzione di anticorpi antispermati nella popolazione maschile”. A Krause, Walter KH; Naz, Rajesh K. Immunità Infertilità: Impatto delle reazioni immunitarie sulla fertilità umana (2a ed.). Springer.


2 commenti
Awesome blog you have here but I was curious if you
knew of any discussion boards that cover the same topics talked about in this article?
I’d really love to be a part of online community where I can get comments from other experienced people that share the same interest.
If you have any recommendations, please let me know.
Many thanks!
Wonderful blog! I found it while browsing on Yahoo News.
Do you have any suggestions on how to get listed in Yahoo
News? I’ve been trying for a while but I never seem to get
there! Many thanks