Ultimo aggiornamento 05/09/2023
L’ipotalamo è un organo diencefalico impari situato nella zona centrale interna ai due emisferi cerebrali, corrispondente al pavimento e alla parte inferiore delle pareti del terzo ventricolo.

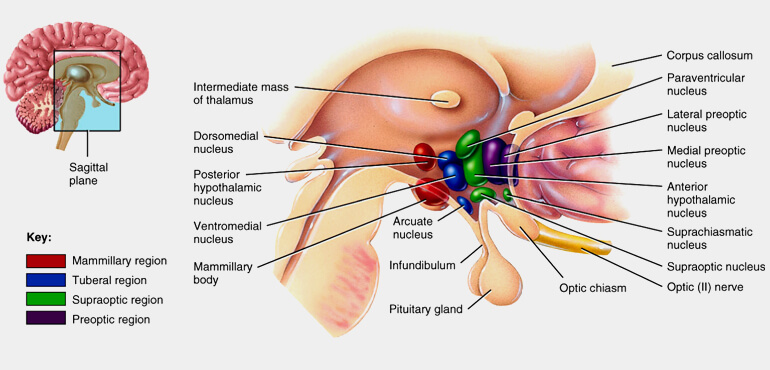
L’ipotalamo è formato da cellule della sostanza grigia raggruppate in nuclei a loro volta divisi in tre gruppi principali: anteriore, intermedio e posteriore
- gruppo anteriore: comprende i nuclei sopraottico, pre-ottico, paraventricolare e sovrachiasmatico;
- gruppo intermedio: in esso, prendendo come riferimento un piano sagittale passante per la colonna del fornice, possiamo distinguere una region e mediale con i nuclei ventromediale, dorsomediale e arcuato (che si estende nell’eminenza mediana) e una regione laterale: nucleo ipotalamico laterale e tuberali laterali;
- gruppo posteriore: comprende i corpi mammillari nei quali si distinguono i nuclei mammillari mediale, laterale e intermedio, e i nuclei ipotalamici posteriori.
oppure identificati come nuclei della regione mammillare, regione tuberale, regione sovraottica e regione pre-ottica.
L’ipotalamo è collegato alla corteccia cerebrale, ai centri del telencefalo, al talamo, all’epitalamo, al mesencefalo e al bulbo.
Le dimensioni dell’ipotalamo sono: 1,5 cm di altezza e 1,3 cm di larghezza; il peso è di circa 2,5 gr. L’ipotalamo è limitato anteriormente dalla lamina terminale, posteriormente del margine posteriore dei corpi mammillari; in basso termina con il tuber cinereum dal cui centro sporge l’infundibolo ipofisario, riccamente vascolarizzato, che collega ipotalamo e ipofisi formando il cosiddetto asse ipotalamo-ipofisario.
posteriore dei corpi mammillari; in basso termina con il tuber cinereum dal cui centro sporge l’infundibolo ipofisario, riccamente vascolarizzato, che collega ipotalamo e ipofisi formando il cosiddetto asse ipotalamo-ipofisario.
Lateralmente i margini sono mal definiti anche se la capsula interna forma un limite approssimativo.
Nuclei ipotalamici – La componente cellulare dell’ipotalamo è rappresentata da neuroni di varie dimensioni raggruppati in nuclei a volte mal definiti o dispersi nel tessuto nervoso. I neuroni più grandi (magnocellulari) formano i nuclei sopraottico e paraventricolare; gli assoni di queste cellule formano parte del peduncolo ipofisario e terminano (la maggior parte ma non esclusivamente) nel processo infundibulare dell’ipofisi. Una seconda popolazione di neuroni, più piccoli, sono dispersi in tutto l’ipotalamo. I limiti di questi nuclei sono meno definiti rispetto ai precedenti e pertanto il loro numero e la loro nomenclatura spesso non sono univoci.
Funzionalmente possiamo raggruppare i nuclei ipotalamici in nuclei con neuroni magnocellulari e parvocellulari. I primi (NPV e NSO) secernono ossitocina e vasopressina (o ADH) che verranno “rilasciati” nell’ipofisi posteriore e quindi immessi nel circolo sistemico.
I nuclei con neuroni parvicellulari secernono Gn-RH, TRH, HPRL-RH, GH-RH, CRF (corticotropin releasing factor). Tutti questi ormoni verranno veicolati tramite il sistema portale ipofisario all’adenoipofisi per stimolare rispettivamente la secrezione di gonadotropine, TSH, prolattina, GH, ACTH.
IPOTALAMO E SISTEMA IMMUNITARIO – Il sistema immnunitario, riconosciuti gli stimoli antigenici, non cognitivi, non soltanto elabora le risposte di difesa relative (produzione di anticorpi e sostanze citotossiche) ma, attraverso la produzione di particolari sostanze come le citochine ed altri peptidi contatta l’asse ipotalamo-ipofisario e lo stimola alla produzione dei relativi ormoni che a loro volta, attraverso le ghiandole endocrine periferiche modulano la risposta immunitaria (1).
Che il Sistema Nervoso Centrale possa influenzare la risposta immunitaria è largamente dimostrato. 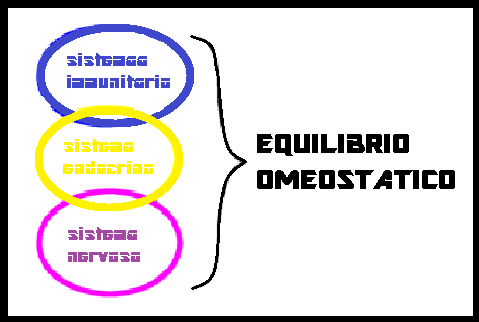 Lesioni dell’ipotalamo anteriore ad es. modificano l’asma; i ratti con deficienza ereditaria di CRH, che come è noto regola la secrezione di ACTH, sono più vulnerabili ai processi infiammatori inclusa l’artrite e l’encefalite autoimmune. Le modificazioni della funzione immunitaria dopo alterazioni del sistema nervoso centrale suggeriscono che la immunocompetenza possa essere regolata dal cervello. Sembra, ad esempio, che i ragazzi mancini e dislettici abbiano una maggiore incidenza di malattie autoimmuni.
Lesioni dell’ipotalamo anteriore ad es. modificano l’asma; i ratti con deficienza ereditaria di CRH, che come è noto regola la secrezione di ACTH, sono più vulnerabili ai processi infiammatori inclusa l’artrite e l’encefalite autoimmune. Le modificazioni della funzione immunitaria dopo alterazioni del sistema nervoso centrale suggeriscono che la immunocompetenza possa essere regolata dal cervello. Sembra, ad esempio, che i ragazzi mancini e dislettici abbiano una maggiore incidenza di malattie autoimmuni.
Il sistema nervoso può modulare il sistema immunitario in molti modi. Ciascuno degli ormoni dell’ipofisi anteriore è controllato dall’ipotalamo e la loro secrezione può essere influenzata da stimoli di origine sopra-ipotalamica come ad esempio il ritmo del sonno e stimoli fisici ed emozionali. D’altra parte ciascuno di questi ormoni ha un effetto, diretto o indiretto, sulla risposta immunitaria attraverso la secrezione delle rispettive ghiandole dipendenti. Il più convincente esempio di neuro-immuno-modulazione è l’attivazione della secrezione adrenocorticale che si verifica in risposta a stimoli antigenici o infiammatori. Le cellule immunocompetenti sono coinvolte dall’ormone dell’accrescimento e dalla prolattina. I recettori del GH sono presenti sui linfociti; gli animali deficitari di GH hanno atrofia del timo e sono immunodeficienti ed inoltre la immunodeficienza si corregge in seguito al trattamento con GH. La prolattina, oltre ad essere un essenziale fattore di accrescimento in una linea di cellule linfoidi, si lega a specifici recettori di varie classi di linfociti e ne stimola la secrezione di citokine. La ciclosporina, una sostanza immunosoppressiva, lega i recettori della prolattina. Il trattamento con bromocriptina, sostanza che inibisce la secrezione di prolattina, migliora l’encefalite sperimentale autoimmune e, limitatamente agli studi condotti nell’uomo, migliora varie malattie autoimmuni incluse la psoriasi, l’iridociclite e l’irite. Gli estrogeni secreti dall’ovaio aumentano l’incidenza delle malattie autoimmuni.
Una seconda via di regolazione nervosa della funzione immunitaria è quella che si realizza attraverso il sistema nervoso simpatico mediante liberazione di catecolamine a livello delle terminazioni nervose autonomiche e della midollare del surrene. L’attivazione del sistema nervoso simpatico o l’iniezione di adrenalina causa leucocitosi, linfopenia (per sequestro) e inibizione dell’attività delle cellule natural-killer. I principali organi inmmunoregolatori (linfonodi, timo, milza e placche intestinali di Peyer ) sono abbondantemente innervate da fibre del sistema autonomico e la immunosoppressione periferica indotta dall’iniezione intracerebroventricolare di CRH è parzialmente inibita dal blocco autonomico periferico.
I neuroni sensitivi contengono una varietà di neurotrasmettitori e neuropeptidi che possono influenzare la funzione linfocitaria, la sostanza P, il polipetdine intestinale vasoattivo (VIP), l’angiotensina II, la somatostatina ed infine il peptide calcitonina gene-correlato. Il timo secerne anche molti peptidi immunoregolatori e la secrezione di alcuni di essi è direttamente regolata dal sistema nervoso autonomico (o indirettamente attraverso gli ormoni ipofisari). La sostanza P e la sostanza K, secrete dalle terminazioni delle vie afferenti sensitive, stimolano le cellule immunocompetenti a secernere le citochine infiammatorie.
L’integrazione, a livello ipotalamico, di stimoli provenienti dal sistema nervoso, da quello endocrino e da quello immunitario è dunque evidente : l’ipotalamo è il crocevia attraverso il quale gli stimoli cognitivi possono influenzare vari aspetti della patologia internistica (manifestazioni vegetative, patologia tiroidea, funzioni genitale, l’apparato cardiovascolare, la coagulazione, la trombolisi, la malattia ulcerosa, l’asma bronchiale, le mesenchimopatie reattive, ecc.).
Comunque, durante la fase acuta della risposta agli stimoli endogeni, le citochine, Il-1, IFN-gamma , TNF-alfa, e Il-6, contribuiscono a stimolare le cellule neurosecretrici ipotalamiche.
Patologia ipotalamica
L’ipotalamo può essere sede di tumori, di difetti di sviluppo embriologico e può essere coinvolto nei traumi cranici, nel colpo di calore, negli stati tossici, nell’alcolismo e in alcune patologie infettive. In genere la sua lesione determina il cointeressamento del diencefalo e dell’ipofisi. È pertanto eccezionale osservare sindromi ipotalamiche pure. Tra i sintomi di sofferenza ipotalamica si segnalano: i disturbi del ricambio idrico, sotto forma di sete intollerabile con esagerata assunzione di liquidi (polidipsia) e contemporaneo aumento della secrezione urinaria (poliuria: da 5-10 fino a 40 l al giorno); l’ipertermia non accompagnata da variazioni del polso e del respiro in un quadro di relativo benessere; l’alterazione delle singole funzioni dell’ipofisi (di solito nel senso della carenza, ma in quello di eccesso nel caso della prolattina) e quindi delle ghiandole bersaglio (ipogonadismo, nella maggior parte dei casi).
Bibliografia
- Cooper EL, Peters G, Ahmed II, Faisal M, Ghoneum MH. 1989. Aggression in Tilapia affects immunocompetent leukocytes. Aggres Behav, 15: 13-22.
- p. felig, j.d. baxter, l.a. frohman, Endocrinology and metabolism, New York, McGraw-Hill, 1995.
- f. martini, Fondamenti di anatomia e fisiologia, Napoli, EdiSES, 1994.
- a. pinchera et al., Endocrinologia e metabolismo, Milano, Ambrosiana, 1991.
- a.s. romer, t.s. parson, The vertebrate body, Philadelphia, Saunders, 1986 (trad. it. Anatomia comparata dei Vertebrati, Napoli, SES, 19872).
- j.d. wilson, d.w. foster, William’s textbook of endocrinology, Philadelphia, Saunders, 1992.










1 commento
Hi there it’s me, I aam aoso visiting this wweb paage onn a
regular basis, tis web site iis actyually gooid and thhe viewers are relly
shring good thoughts.