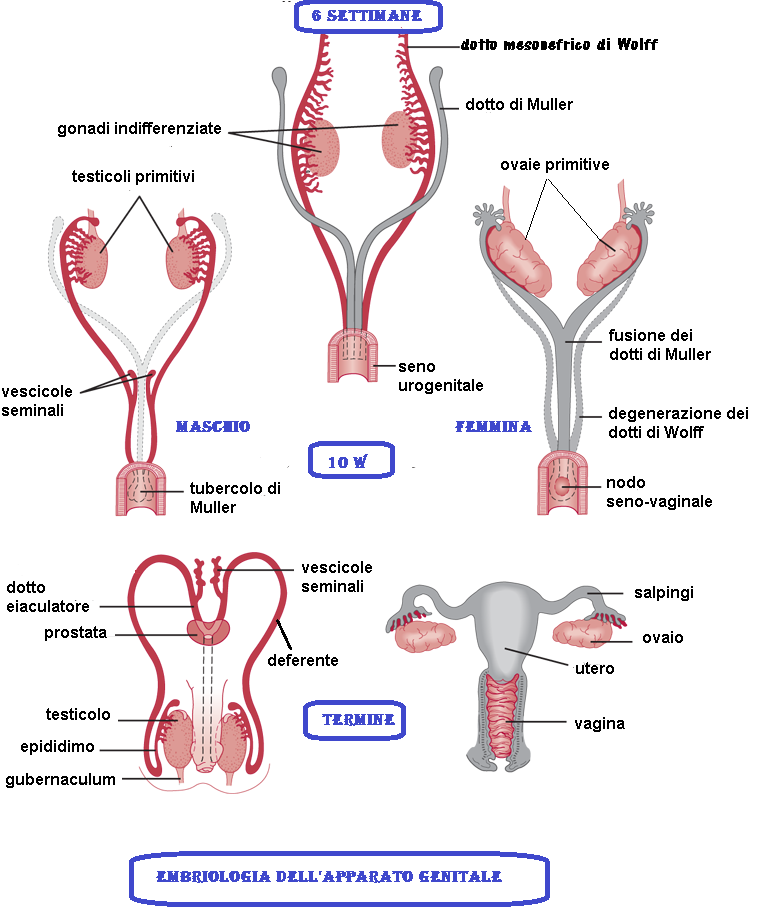
Il dotto di Wolff (o dotto del mesonefro) è un organo pari che si ritrova nei mammiferi, compresi gli esseri umani di ambo i sessi, durante la fase embrionale. Il nome lo si deve a Caspar Friedrich Wolff. Nella specie umana, fino alla 7a settimana dello sviluppo embrionale i due embrioni di sesso diverso sono morfologicamente indistinguibili, intervengono dunque gli enzimi litici che, rilasciati dai lisosomi, degradano nella femmina ciò che caratterizza il maschio e viceversa.
Nel sesso maschile
Nel maschio i dotti di Wolff si sviluppano fino a formare i condotti eiaculatori, l’epididimo, i canali deferenti e le vescichette seminali. La regressione dei dotti mulleriani inizia al livello della porzione anteriore (tubarica) il 50° giorno di concepimento, quando il loro diametro diminuisce.
Nel sesso femminile
Nella donna i condotti di Wolff si atrofizzano a favore dei dotti di Müller da cui si originano tube, utero e il terzo prossimale della vagina. Se sottoposti, nel periodo dalla settima alla 12a settimana, all’azione di androgeni, i dotti di Wolff possono sopravvivere anche nei feti di sesso femminile con alterazioni dell’identità sessuale gonadica e fenotipica, ma non dell’identità sessuale cromosomica codificata all’atto del concepimento dal gene Tdy situato sul cromosoma Y.
Nel maschio, la mancata regressione dei dotti di Müller si manifesta con la PMDS “Persistent Müllerian duct syndrome” caratterizzata dalla presenza di abbozzi di organi di derivazione dai  dotti di Müller (tube, utero e terzo superiore della vagina) in individuo cromosomicamente e fenotipicamente maschio. Spesso è presente criptorchidismo. Questa condizione è solitamente causata dalla mancata azione dell’ormone antimulleriano in epoca embrionale. Ciò può essere a sua volta dovuto a deficit di secrezione di AMH sia mutazioni del gene dello stesso ormone che ad insensibilità del recettore specifico (4-18).
dotti di Müller (tube, utero e terzo superiore della vagina) in individuo cromosomicamente e fenotipicamente maschio. Spesso è presente criptorchidismo. Questa condizione è solitamente causata dalla mancata azione dell’ormone antimulleriano in epoca embrionale. Ciò può essere a sua volta dovuto a deficit di secrezione di AMH sia mutazioni del gene dello stesso ormone che ad insensibilità del recettore specifico (4-18).
REFERENCES:
- Stinnakre M. G.: Period of sensitivity to androgens of the Wolff duct of the rat fetus. Arch Anat Microsc Morphol Exp. 1975 Jan-Mar;64(1):45-59.
- Chronology of development of the genital tract of the calf fetus]. Vigier B, Prépin J, Jost A.Arch Anat Microsc Morphol Exp. 1976; 65(2):77-101.
- Developmental pattern and regulation by androgens of androgen receptor expression in the urogenital tract of the rat. Bentvelsen FM, Brinkmann AO, van der Schoot P, van der Linden JE, van der Kwast TH, Boersma WJ, Schröder FH, Nijman JM.Mol Cell Endocrinol. 1995 Sep 22; 113(2):245-53.
- Renu D, Rao BG, Ranganath K (February 2010). “Persistent mullerian duct syndrome”. primary. The Indian Journal of Radiology & Imaging. 20 (1): 72–4.
- Carlson NR (2013). Physiology of behavior. review (11th ed.). Boston: Pearson. p. 328.
- Imbeaud S, Belville C, Messika-Zeitoun L, Rey R, di Clemente N, Josso N, Picard JY (September 1996). “A 27 base-pair deletion of the anti-müllerian type II receptor gene is the most common cause of the persistent müllerian duct syndrome” (Free full text). primary. Human Molecular Genetics. 5 (9): 1269–77.
- Colacurci N, Cardone A, De Franciscis P, Landolfi E, Venditto T, Sinisi AA (February 1997). “Laparoscopic hysterectomy in a case of male pseudohermaphroditism with persistent Müllerian duct derivatives”. primary. Human Reproduction. 12 (2): 272–4. doi:10.1093/humrep/12.2.272. PMID 9070709.
- Fernandes ET, Hollabaugh RS, Young JA, Wilroy SR, Schriock EA (December 1990). “Persistent müllerian duct syndrome”. primary. Urology. 36 (6): 516–8.
- Agrawal AS, Kataria R (June 2015). “Persistent Müllerian Duct Syndrome (PMDS): a Rare Anomaly the General Surgeon Must Know About”. review. The Indian Journal of Surgery. 77 (3): 217–21.
- Prakash N, Khurana A, Narula B (2009-10-01). “Persistent Müllerian duct syndrome”. primary. Indian Journal of Pathology & Microbiology. 52 (4): 546–8.
- Al-Salem AH (2017). “Persistent Müllerian Duct Syndrome (PMDS)”. An Illustrated Guide to Pediatric Urology. review. Cham: Springer International Publishing Springer. pp. 287–293.
- Sekhon V, Luthra M, Jevalikar G (January 2017). “Persistent Mullerian Duct Syndrome presenting as irreducible inguinal hernia – A surprise surgical finding!”. primary. Journal of Pediatric Surgery Case Reports. 16: 34–36.
- Josso N, Belville C, di Clemente N, Picard JY (2005-05-05). “AMH and AMH receptor defects in persistent Müllerian duct syndrome”. review. Human Reproduction Update. 11 (4): 351–6.
- Vanikar AV, Nigam LA, Patel RD, Kanodia KV, Suthar KS, Thakkar UG (June 2016). “Persistent mullerian duct syndrome presenting as retractile testis with hypospadias: A rare entity”. primary. World Journal of Clinical Cases. 4 (6): 151–4. .
- Pappis C, Constantinides C, Chiotis D, Dacou-Voutetakis C (April 1979). “Persistent Müllerian duct structures in cryptorchid male infants: surgical dilemmas”. primary. Journal of Pediatric Surgery. 14(2): 128–31.
- Shamim M (August 2007). “Persistent Mullerian duct syndrome with transverse testicular ectopia presenting in an irreducible recurrent inguinal hernia”. primary. JPMA. The Journal of the Pakistan Medical Association. 57 (8): 421–3.
- Rey R (February 2005). “Anti-Müllerian hormone in disorders of sex determination and differentiation”. review. Arquivos Brasileiros De Endocrinologia E Metabologia. 49 (1): 26–36.
- Gujar NN, Choudhari RK, Choudhari GR, Bagali NM, Mane HS, Awati JS, Balachandran V (December 2011). “Male form of persistent Mullerian duct syndrome type I (hernia uteri inguinalis) presenting as an obstructed inguinal hernia: a case report”. primary. Journal of Medical Case Reports. 5 (1): 586.