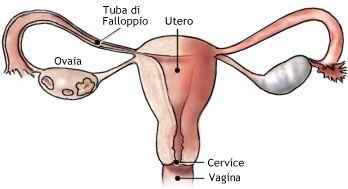
La cervice uterina rappresenta la parte terminale, inferiore, extra-pelvica dell’utero. Si presenta come una formazione cilindro-conica, di consistenza parenchimatosa, di 2-4 centimetri di lunghezza, diametro di 2 cm circa ed un volume di 3 cm3 nelle  pluripare e 4 cm3 nelle pluripare. Le dimensioni variano con l’età e la parità. Prima della pubertà la cervice rappresenta circa la metà della dimensione totale dell’utero. Nella donna in età fertile e soprattutto in seguito a gravidanza, le dimensioni relative diminuiscono: la cervice rappresenta 1/3 del viscere uterino, dato il notevole sviluppo longitudinale del corpo dell’utero (1-3).
pluripare e 4 cm3 nelle pluripare. Le dimensioni variano con l’età e la parità. Prima della pubertà la cervice rappresenta circa la metà della dimensione totale dell’utero. Nella donna in età fertile e soprattutto in seguito a gravidanza, le dimensioni relative diminuiscono: la cervice rappresenta 1/3 del viscere uterino, dato il notevole sviluppo longitudinale del corpo dell’utero (1-3).
La cervice è in rapporto:
- anteriormente con il setto vescico-vaginale, il trigono vescicale e la parte terminale dell’uretere
- lateralmente con i ligamenti cardinali di Mackenrodt
- posteriormente con il cul de sac peritoneale retto-uterino.
Irrorazione: arteria cervico-vaginale, voluminoso ramo dell’a. uterina che nasce a livello dell’incrocio dell’uterina con l’uretere. Subito dopo essere passata sotto l’uretere l’arteria si divide in numerosi rami anteriori e posteriori che irrorano la cervice uterine (6 rami anteriori e 6 posteriori), il fornice vaginale anteriore, il collo e la base della vescica. Le vene defluiscono in ambo i lati nei plessi venosi del legamento largo che a loro volta defluiscono nelle vene ipogastriche.
Innervazione: piccole diramazioni dei nervi uterini, a loro volta derivanti dalla porzione superiore del plesso ipogastrico inferiore; si accompagnano ai rami arteriosi cervicali.
La cervice è composta da due strati:
- Endometrio: Il canale cervicale ha una struttura simile a quella del corpo uterino con alcune differenze. La mucosa non è liscia come quello della cavità uterina ma presenta delle pliche a forma di “foglia di felce” che formano una immagine arboriforme detta “arbor vitae”. La mucosa dell’endocollo è formata da cellule cilindriche, colonnari, ciliate monostratificate intervallate da numerose cellule secernenti muco. La mucosa cervicale non subisce modificazioni cicliche così eclatanti come quelle della mucosa della cavità uterina. Ciò che varia macroscopicamente è soprattutto la secrezione di muco da parte delle ghiandole cervicali. La mucosa della portio vaginalis è composta da un epitelio pavimentoso pluristratificato non corneificato e carico di glicogeno; non ci sono ghiandole. Al di sotto dello strato superficiale della mucosa si trova lo strato basale con funzioni di rigenerazione.

- Miometrio costituito per il 90% da fibrocellule muscolari lisce riunite in fasci da un’impalcatura fibro-elastica. Le fibrocellule hanno una lunghezza di 50 µ in donne non gravide e raggiungono i 1500 µ in gravidanza in cui si assiste anche a fenomeni di iperplasia che regrediscono nel puerperio. Il miometrio è disposto in tre strati: l’esterno è costituito da fibre longitudinali, lo strato muscolare intermedio costituito da fibre miste circolari e longitudinali intrecciate fra di loro (strato plessiforme) riccamente vascolarizzate mentre lo strato interno è costituito da fibre circolari particolarmente abbondanti a livello istmico. Il miometrio contiene la maggior parte dei nervi e dei vasi sanguigni che irrorano l’utero (1-6).
La zona di transizione fra epitelio pavimentoso ed epitelio cilindrico e detta giunzione squamo-colonnare. Nella giovane adulta, la giunzione squamocellulare è posizionata nel versante vaginale della cervice, mentre nella donna adulta la giunzione si approfonda all’interno dell’orificio uterino esterno, ma le variazioni sono frequenti. Questa zona di transizione istologica assume una particolare importanza in oncologia essendo la zona anatomica maggiormente interessata allo sviluppo di carcinoma della 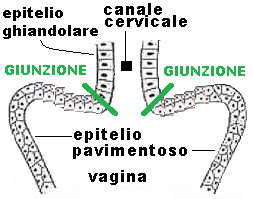 cervice uterina.
cervice uterina.
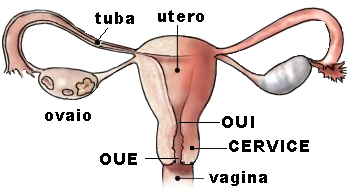
Il canale comunica da un lato con l’ambiente vaginale attraverso l’orificio uterino esterno (OUE) e dall’altro con la cavità uterina attraverso l’orificio uterino interno (OUI). La porzione di cervice che protrude in vagina viene detta portio vaginalis. E’ a forma di cono, della lunghezza di 8-12 mm, con la punta rivolta in basso.
L’orifizio esterno (OUE) del corpo dell’utero subisce modificazioni:
- Puberale: l’orificio ha la forma di una fessura delimitata da due labbri, anteriore e posteriore; ricorda il muso di tinca
- Nullipara: cilindrico
- Primipara: cilindro-conico;
- Multipara l’orifizio diventa più largo
- Durante il parto l’OUE può dilatarsi fino a raggiungere dimensioni di 8–10 cm.
Tinca: pesce di acqua dolce della famiglia dei cipriniformi
VARIAZIONI CITOLOGICHE ORMONALI
Estrogeni e progesterone determinano modificazioni morfologiche e funzionali dell’epitelio di rivestimento, influenzando il ritmo di replicazione cellulare e lo spessore dell’epitelio, la desquamazione dello strato superficiale ed il metabolismo delle cellule dei vari strati.
- Durante la fase follicolare gli estrogeni stimolano progressivamente la divisione cellulare dell’epitelio di rivestimento pluristratificato esocervicale. Dal 10° al 14° giorno del ciclo, il numero degli strati aumenta da 20 a 40. L’aumento di spessore dello strato superficiale si accompagna a desquamazione cellulare, più accentuata nella fase preovulatoria. Alla fine della fase follicolare, le cellule degli strati intermedio, di trasposizione e superficiale mostrano un alto contenuto di glicogeno nel loro citoplasma, aumenta il numero di giunzioni intercellulari ed è apprezzabile una variazione nel metabolismo delle cellule dello strato basale che mostrano un progressivo accumulo di gocce lipidiche. L’epitelio cilindrico endocervicale, in questa fase, è costituito da cellule con citoplasma relativamente denso e basofilo, il nucleo ha forma ellittica o sferica. Alla fine della fase follicolare, il citoplasma delle cellule cilindriche si riempie di abbondante e chiaro muco che spinge il nucleo verso la porzione basale della cellula.
- Nella fase luteinica si verifica l’aumento del progesterone. Esso è responsabile dell’inibizione della moltiplicazione cellulare dell’epitelio squamoso, della riduzione delle giunzioni desmosomiali e quindi dell’incremento della desquamazione cellulare. Questi fenomeni determinano una riduzione notevole del numero degli strati cellulari. Si assiste, inoltre, ad una infiltrazione leucocitaria nella tonaca propria che determina lo scollamento dello strato basale.
L’analisi al microscopio dell’esame citologico, ottenuto con lo striscio cervicovaginale (pap-test, thin prep), può dare, oltre che, naturalmente, informazioni sulla presenza di affezioni vaginali o di neoplasie cervicali, anche indicazioni utili sulla funzione ovarica o sulla efficacia di terapie estro-progestiniche.
L’indice di maturazione dell’epitelio di rivestimento e l’entità dei fenomeni desquamativi che dipendono direttamente dal grado di proliferazione raggiunto durante la fase estrogenica, si ripercuotono sulle caratteristiche delle cellule osservate al microscopio. Ad esempio, uno striscio atrofico, con marcata riduzione del livello di maturazione dell’epitelio squamoso, indica l’assenza di attività estrogenica, mentre uno striscio composto prevalentemente da cellule squamose eosinofile indica un effetto estrogenico endogeno od esogeno. Anche l’epitelio ghiandolare endocervicale subisce le variazioni ormonali, ma queste sono di più difficile evidenziazione al Pap-test. Gli estrogeni inducono la completa maturazione degli epiteli. Lo striscio cervico-vaginale all’inizio della fase estrogenica, mostra la presenza di cellule squamose dello strato intermedio raggruppate in clusters e cellule superficiali sparse; in fase preovulatoria, è dominante la presenza di cellule squamose superficiali completamente mature, con nucleo picnotico e citoplasma acidofilo, isolate tra loro.
Eritrociti, leucociti e macrofagi sono comunemente evidenziabili all’inizio della fase estrogenica e divengono scarsi fino a scomparire in fase ovulatoria. Le cellule endocervicali hanno citoplasma basofilo e sferico con nucleo centrale. Al momento dell’ovulazione lo striscio è composto soprattutto da cellule superficiali squamose di grosse dimensioni ed intensamente eosinofile, i leucociti sono infrequenti, esso viene definito “pulito”. Le cellule endocervicali divengono rigonfie e larghe con citoplasma ripieno di muco chiaro, e restano poi immodificate fino alla fine del ciclo.
Durante la fase progestinica si assiste ad una graduale riduzione nella proporzione di cellule squamose superficiali che sono sostituite da cellule dello strato intermedio. È possibile identificare rare cellule navicolari (cellule intermedie con depositi gialli di glicogeno), i leucociti divengono numerosi. Verso la fine del ciclo le cellule intermedie divengono prevalenti formano piani continui o clusters. - Subito prima delle mestruazioni, a causa della citolisi indotta dai lattobacilli, compaiono nuclei spogli e frammenti cellulari accompagnati da un incremento di leucociti che danno allo striscio un aspetto “sporco” (1,2).
Le modificazioni cito-istologiche che si evidenziano in relazione al ciclo ovarico possono essere motivate data la presenza di modificazioni molecolari che evidenziano una variazione dell’espressione dei recettori per estrogeno e progesterone a livello cervicale: in particolare, è stato dimostrato che in fase estrogenica si verifica una lieve-moderata espressione di recettori estrogenici nello strato basale e parabasale, l’espressione è ridotta in fase progestinica. Assente l’espressione di recettori progestinici in tutto l’epitelio esocervicale (3).
PATOLOGIE CERVICALI
La presenza di una cervice corta (17) è la condizione più strettamente associata a parto prematuro (18-20). Alcuni interventi chirurgici come la crioterapia, la conobiospia e la procedura di escissione elettrochirurgica ad ansa (utilizzati per la prevenzione del carcinoma della cervice uterina) possono essere responsabili della condizione di cervice uterina corta.
La patologia infettiva più spesso associata a cervicite è sostenuta da Candida albicans, Neisseria gonorrhoeae, Chlamydia e Mycoplasma (21,22). Le forme virali sono invece sostenute da herpes simplex, citomegalovirus e papillomavirus. Quest’ultimo, unitamente ad altri fattori e condizioni di rischio, è responsabile del carcinoma della cervice uterina (3).
References:
- Giuseppe C. Balboni, et al., Anatomia Umana, Vol. 1-2., Ristampa 2000, Milano, Edi. Ermes s.r.l., 1976,
- Weschler, Toni, MPH, Taking Charge of Your Fertility, Second Edition, 2002, pp. 59, 64.
- Robbins e Cotran, Le basi patologiche delle malattie (7ª edizione), Torino – Milano, Elsevier Masson, 2008,
- Richard RM:Cervical intraepithelial neoplasia. Pathol Annu 8:301,1973.
- Ann Westinore; Evelyn, Dr Billings, The Billings Method: Controlling Fertility Without Drugs or Devices, Toronto, Life Cycle Books, 1998, p. 37,
- Weschler, Toni, MPH, Taking Charge of Your Fertility, Second Edition, 2002, pp. 58-59.
- Nappi, Ostetricia & ginecologia, Ristampa 2005, Napoli, Idelson-Gnocchi,
- Fiorenzo Conti, et al., Fisiologia del sistema endocrino, in Fisiologia medica – Volume 2, Prima edizione, Milano, Edi.Ermes, 2005,
- Khaldoun Sharif, Olufowobi, Olufemi, The structure chemistry and physics of human cervical mucus, in Jordan, Joseph; Singer, Albert; Jones, Howard; Shafi, Mahmood (a cura di), The Cervix, 2nd, Malden, MA, Blackwell Publishing, 2006, pp. 157–68,
- Robert E. Brannigan, Lipshultz, Larry I., Sperm Transport and Capacitation, in The Global Library of Women’s Medicine, 2008,
- Toni Weschler, Taking charge of your fertility : the definitive guide to natural birth control, pregnancy achievement, and reproductive health, New York, NY, Collins, 2006, pp. 59, 64,
- Anderson, Matthew; Karasz, Alison, Are Vaginal Symptoms Ever Normal? A Review of the Literature, in Medscape General Medicine, vol. 6, nº 4, 2004, p. 49.
- Ann Westinore e Billings Evelyn, The Billings Method: Controlling Fertility Without Drugs or Devices, Toronto, ON, Life Cycle Books, 1998, p. 37,
- G. Wagner e R. J. Levin, Electrolytes in vaginal fluid during the menstrual cycle of coitally active and inactive women
- Naja Becher, Waldorf Kristina Adams, Hein Merete, Uldbjerg Niels, The Cervical Mucus Plug: Structured Review of the Literature, in Acta Obstetricia et Gynecologica Scandinavica, vol. 88, nº 5, maggio 2009, pp. 502–13,
- Deitra Leonard Lowdermilk e Shannon E. Perry, Maternity Nursing, 7ª ed., Edinburgh, United Kingdom, Elsevier Mosby, 2006, p. 394,
- Goldenberg RL, Iams JD, Mercer BM, et al., The preterm prediction study: the value of new vs standard risk factors in predicting early and all spontaneous preterm births. NICHD MFMU Network, in Am J Public Health, vol. 88, nº 2, 1998, pp. 233–8,
- To MS, Skentou CA, Royston P, Yu CKH, Nicolaides KH. Prediction of patient-specific risk of early preterm delivery using maternal history and sonographic measurement of cervical length: a population-based prospective study. Ultra Obstet Gynecol 2006; 27: 362–367.
- Fonseca et al. Progesterone and the risk of preterm birth among women with a short cervix. NEJM 2007; vol 357, no 5, pg 462–469.
- Romero R. Prevention of sponatneous preterm birth: the role of sonographic cervical length in identifying patients who may benefit from progesterone treatment. Ultrasound Obstet Gynecol 2007; 30: 675–686.
- Harrison, Principi di Medicina Interna (16ª edizione), New York – Milano, McGraw-Hill, 2006,
- Anna M. Molina Romanzi, et al., Malattie sessualmente trasmesse, in Microbiologia clinica, Ristampa 2004, Torino, UTET, 2002,




1 commento
It’s very straightforward to find out any topic on net as compared to
textbooks, as I found this post at this web
page.