Il cervelletto è un’importante struttura del sistema nervoso centrale a sua volta costituito da encefalo e midollo spinale. Nell’encefalo, sono riconoscibili 4 regioni: il telencefalo (o cervello propriamente detto), il diencefalo, il tronco encefalico e il cervelletto.
Il cervelletto si trova nella fossa cranica posteriore, dietro al ponte (da cui lo separa il 4° ventricolo e a cui è collegato tramite il peduncolo cerebellare medio), dietro e sopra al bulbo a cui è collegato tramite il peduncolo cerebellare inferiore, al di sotto e posteriormente al cervello da cui lo separa un ispessimento della dura madre, il tentorio del cervelletto. Si connette al mesencefalo tramite il peduncolo cerebellare superiore;
Anatomia macroscopica – Il cervelletto ha consistenza parenchimatosa, forma ellissoidale e “a cuore”, del peso di 130-140 grammi. Rappresenta solo il 10% del volume totale del cervello, ma possiede più della metà di tutti i suoi neuroni. Si presenta come come una massa di tessuto neuronale suddiviso in due emisferi da un setto centrale denominato verme. L’estremità anteriore del verme sporge libera nel 4° ventricolo dove termina con un’estremità arrotondata, lingula.
La sua superficie è coperta da fitte scanalature perpendicolari all’asse maggiore del cervelletto, parallele fra loro e finemente distanziate che conferiscono un aspetto laminato alla superficie cerebellare. Queste scanalature parallele nascono dal fatto che la corteccia cerebellare è un sottile strato di tessuto strettamente piegato come una fisarmonica. All’interno di questo sottile strato vi sono diversi tipi di neuroni con una disposizione altamente regolare, le cellule più importanti sono le cellule Purkinje e le cellule granulari.
Anatomia microscopica – Il cervelletto presenta uno strato di sostanza grigia superficiale, detta corteccia cerebellare, di forma irregolare a causa di numerosi solchi ad andamento prevalentemente trasversale rispetto all’asse principale del cervelletto.  In profondità è presente la sostanza bianca che forma, al centro, il corpo midollare da cui dipartono tralci di sostanza che seguono i ripiegamenti della griglia superficiale e disegnano l’arbor vitae. Nel profondo del corpo midollare sono situati quattro nuclei (detti nuclei intrinseci): nucleo del tetto, nucleo globoso, nucleo emboliforme e nucleo dentato.
In profondità è presente la sostanza bianca che forma, al centro, il corpo midollare da cui dipartono tralci di sostanza che seguono i ripiegamenti della griglia superficiale e disegnano l’arbor vitae. Nel profondo del corpo midollare sono situati quattro nuclei (detti nuclei intrinseci): nucleo del tetto, nucleo globoso, nucleo emboliforme e nucleo dentato.
FUNZIONI – La principale funzione del cervelletto è quella di controllo del movimento volontario in corso di esecuzione in modo da renderlo armonico e accurato. Ciò è reso possibile dal fatto che il cervelletto riesce a mettere in relazione i movimenti reali, in esecuzione, con quelli programmati. In questa funzione di “correttore” o “comparatore” è fondamentale la connessione fra il verme cerebellare e il nucleo rosso (circuito riverberante cerebello-rubro-cerebellare).
Programmazione dei movimenti – gli emisferi cerebellari ricevono dalla corteccia cerebrale (telencefalo) le informazioni riguardo ai movimenti che si vogliono eseguire e in risposta invia (attraverso il nucleo ventrale anteriore e ventrale laterale del talamo) i cosiddetti programmi motori, ovvero memoria di movimenti già eseguiti: memoria motoria. La memori motoria permette di ripetere movimenti già fatti con un elevato grado di precisione.
Inoltre il cervelletto integra la sensibilità relativa all’equilibrio e alla postura attraverso la modulazione del tono dei muscoli tonico-posturali, complesso di muscoli che ci tiene in piedi e contrasta la forza di gravità, mantenendo continuamente il peso del corpo, quindi gestendo senza interruzioni il baricentro nel poligono di base. I mm. tonico-posturali sono, a partire dal basso verso l’alto: gastrocnemi, sartorio, ischio crurali, ileo psoas, retto del femore, tensore della fascia lata, gruppo degli adduttori e piriforme, complesso dei muscoli erettori della colonna ed in particolar modo, a livello cervicale e lombare, il quadrato dei lombi e gli scaleni. Nel cingolo scapolare vi sono il grande pettorale, l’elevatore della scapola, il trapezio superiore ed il bicipite brachiale.
Alterazioni funzionali cerebellari si traducono nell’atassia cerebellare, una sindrome poliedrica che può esprimersi con deficit posturali e della deambulazione, andatura barcollante, tremore delle mani durante la ricerca degli oggetti, deficit della prensione (target overshoot), eccessiva angolazione della spalla, difficoltà nell’articolazione della parola (disartria).
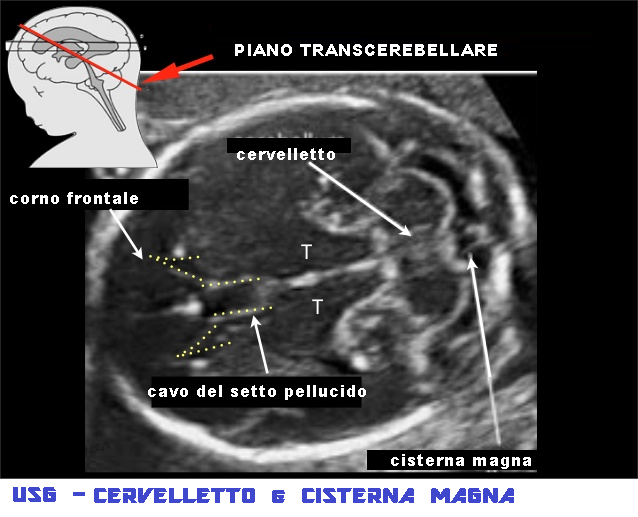
USG – per visualizzare in modo ottimale il cervelletto e la cisterna magna, si ricorre ad una scansione transcerebellare che si ottiene posizionando la sonda ad un livello leggermente inferiore rispetto alla proiezione transventricolare e basculando lievemente con la sonda in senso posteriore. Con questo piano è possibile visualizzare i corni frontali dei ventricoli laterali, il cavo del setto pellucido (CSP), il talamo, il cervelletto e la cisterna magna. Questo piano di scansione corrisponde alla sezione trasversa suboccipito-bregmatica. Un altro piano di scansione è costituito dalla sezione  obliqua occipito-frontale che sfrutta come punto di ingresso e finestra acustica la fontanella mastoidea.
obliqua occipito-frontale che sfrutta come punto di ingresso e finestra acustica la fontanella mastoidea.
I principali parametri ecografici da osservare sono l’ecostruttura e conformazione del cervelletto, il diametro trasverso cerebellare, conformazione e diametri del verme e diametri della cisterna magna.
Gli emisferi cerebellari appaiono come una struttura ipoecogena, a forma di farfalla, tondeggianti uniti al centro per mezzo del verme. L’eventuale presenza di una zona iperecogena nel contesto del cervelletto indica un recente infarto cerebellare.
Il diametro trasverso cerebellare (TCD) aumenta con l’età gestazionale e presenta una stretta  correlazione con DBP, CA e CC (17). Il TCD, fra la 14a e la 21a settimana, può essere utilizzato per la datazione dell’epoca gestazionale nei casi in cui non è certa l’epoca di amenorrea o non è possibile utilizzare il DBP come nell’oligoamnios, presentazione podalica e gravidanza gemellare. Un aumentato rapporto TCD/AC fa porre il sospetto di IUGR; infatti il 20% dei feti small-for-gestational age (SGA) presenta un ridotto TCD e l’82% dei feti SGA mostra un alto rapporto TCD/AC (17). La mortalità perinatale nei feti IUGR con crescita del TCD inferiore alla norma è doppia rispetto ai casi controllo (1-8). Solo in caso di sicura epoca gestazionale, la ridotta biometria del cervelletto può indicarne l’ipoplasia, anomalia oltretutto molto rara.
correlazione con DBP, CA e CC (17). Il TCD, fra la 14a e la 21a settimana, può essere utilizzato per la datazione dell’epoca gestazionale nei casi in cui non è certa l’epoca di amenorrea o non è possibile utilizzare il DBP come nell’oligoamnios, presentazione podalica e gravidanza gemellare. Un aumentato rapporto TCD/AC fa porre il sospetto di IUGR; infatti il 20% dei feti small-for-gestational age (SGA) presenta un ridotto TCD e l’82% dei feti SGA mostra un alto rapporto TCD/AC (17). La mortalità perinatale nei feti IUGR con crescita del TCD inferiore alla norma è doppia rispetto ai casi controllo (1-8). Solo in caso di sicura epoca gestazionale, la ridotta biometria del cervelletto può indicarne l’ipoplasia, anomalia oltretutto molto rara.
La chiusura del verme cerebellare si completa fra la 15a e la 20a settimana. In fasi iniziali di gravidanza è possibile che il verme non copra ancora per intero il quarto ventricolo e questo può erroneamente indurre a sospettare agenesia parziale del verme. Se questa caratteristica persiste oltre la 22a w di gravidanza è ragionevole sospettare che si tratti di una anomalia cerebellare (1-6). Nella scansione ecografica si valuteranno, inoltre, la rotazione antioraria e il sollevamento verso l’alto del verme cerebellare; alterazioni tutte che possono caratterizzare alcune sindromi malformative come la sindrome di Dandy-Walker e la S. di Joubert (1-3). L’USG non sempre l’ecografia è in grado di dirimere i dubbi sulla presenza di un verme ipoplasico o normale; di notevole aiuto è l’integrazione dell’esame ecografico con la RMN (9-16).
La sindrome di Dandy-Walker è una sindrome polimorfa caratterizzata da malformazioni varie del cervello che può comprendere: dilatazione del 4° ventricolo, allargamento della fossa cranica posteriore (megacisterna magna) e malformazioni cerebellari (4-7) come:
- assenza del verme cerebellare nella forma classica della sindrome di Dandy-Walker
- ipoplasia del verme cerebellare che caratterizza la Dandy-Walker variant
- rotazione in alto del verme cerebellare normalmente conformato e ampio cleft mediano degli emisferi cerebellari: si presentano nella cosiddetta cisti della tasca di Blake.
- dilatazione cistica del IV° ventricolo che si estende occupando gran parte della fossa cranica posteriore; la cisterna magna è compressa tra il 4° ventricolo dilatato e la dura madre
- ipogenesia o agenesia del verme cerebellare: l’agenesia del verme cerebellare, tipica della malformazione di Dandy-Walker, si riconosce per la presenza di un tunnel mediano anecogeno che mette in comunicazione la cisterna magna dilatata con il IV° ventricolo.
- ampia separazione degli emisferi cerebellari: caratteristica è la schisi a “V” del verme cerebellare nel piano assiale
- sul piano mediano il 4° ventricolo dilatato si estende superiormente dislocando il verme cerebellare, che è frequentemente ipoplasico. L’idrocefalia si osserva in circa l’80% dei casi ma ad insorgenza spesso post-natale.
Le anomalie più frequentemente associate alla S. di Dandy-Walker sono altre anomalie della linea mediana come agenesia del corpo calloso e oloprosencefalia. Altre anomalie associate sono: encefalocele, reni policistici, anomalie cardiovascolari, schisi facciali.
I sintomi principali della S. di Dandy-Walker si manifestano in genere durante l’infanzia e sono: ritardo di sviluppo, progressivo aumento della circonferenza cranica, atassia cerebellare, spasticità, idrocefalia (vomito, irritabilità, convulsioni). 
Diagnosi differenziale – deve essere posta con la Sindrome di Joubert: è una anomalia a trasmissione autosomica recessiva caratterizzata da ipoplasia del verme cerebellare ed anomalie del tronco encefalico. Il 4° ventricolo è dilatato e comunica con una cisterna magna di aspetto normale; importante per la diagnosi è la presenza di una anamnesi familiare positiva e di un segno caratteristico rilevabile ecograficamente ma soprattutto con la RMN: il segno del dente molare (MTS), dovuto alla particolare immagine derivata dalla coesistenza delle anomalie cerebellari e del tronco encefalico (26-36):
- ipoplasia del verme cerebellare
- fossa interpeduncolare infossata ed accentuata
- peduncoli cerebellari ispessiti, allungati ed orizzontalizzati.
La cisterna magna o cisterna cerebello-medullare è uno spazio, ricolmo di liquido, posto dorsalmente al cervelletto. Al suo interno sono presenti setti sottili, strutture fisiologiche, da non scambiare per strutture vascolari o anomalie di tipo cistico. Essa comunica con il 4° ventricolo attraverso il foro di Magendie. La mancata perforazione del 4° ventricolo (mancata formazione del foro di Magendie) comporta la persistenza della cisti di Blake che fisiologicamente è transitoria e dovrebbe scomparire, in seguito appunto alla formazione del foro di Magendie alla 10a settimana circa. Nella seconda metà della gravidanza la cisterna magna presenta una profondità media di 5 mm (range 2-10 mm). La profondità della cisterna magna è misurata tra il verme cerebellare ed il lato interno dell’osso occipitale.
Esiste una correlazione lineare fra la profondità della CM e l’epoca gestazionale e il DBP (10-12).
In caso di dolicocefalia è possibile che le misure superino, anche se di poco, i 10 mm.
In assenza di altri reperti che suggeriscano una lesione della fossa posteriore, è improbabile che una cisterna magna prominente (megacisterna) sia di per se stessa un’entità clinicamente significativa (10-15). La megacisterna magna rappresenta un elemento di rischio che spesso nasconde alterazioni morfologiche e cromosomice non sempre evidenziabili dall’esame USG standard morfostrutturale eseguito alla 18-20a settimana. Infatti, in caso di megacisterna diagnosticata come isolata all’esame USG, ulteriori indagini con RMN rilevano alterazioni del SNC nel 13% dei casi e nel 18% dei casi l’esame del cariotipo fetale rivela la presenza di alterazioni cromosomiche (16-25).
La cisterna magna obliterata è associata a spina bifida. In tal caso il cervelletto, prolassato caudalmente, assume una caratteristica forma a “banana”.
Bibliografia
- Malinger G, Lev D, Lerman-Sagie T. The fetal cerebellum. Pitfalls in diagnosis and management.
Prenat Diagn. 2009 Apr; 29(4):372-80. - A.S.M. Vinkesteijn, P.G.H. Mulder, J.W. Wladimiroff: “Fetal transverse cerebellar diameter measurements in normal and reduced fetal growth”. Ultrasound in Obstetrics & Gynecology. Volume 15, Issue 1, pages 47–51, January 2000.
- Reece EA, Goldstein I, Pilu G, Hobbins JC. Fetal cerebellar growth unaffected by intrauterine growth retardation: a new parameter for prenatal diagnosis. Am J Obstet Gynecol 1987; 157: 632-82
- Hill LM, Guzick D, Rivello D, Hixson J, Peterson C. The transverse cerebellar diameter cannot be used to assess gestational age in the small for gestational age fetus. Obstet Gynecol 1990; 75: 329-33
- Lee W, Barton S, Comstock CH, Bajorek S, Batton D, Kirk JS. Transverse cerebellar diameter: a useful predictor of gestational age for fetuses with asymmetric growth retardation. Am J Obstet Gynecol 1991;165: 1044 50
- Campbell WA, Vintzileos AM, Rodis JF, Turner GW, Egan JF, Nardi DA. Use of the transverse cerebellar diameter/abdominal circumference ratio in pregnancies at risk for intrauterine growth retardation. J Clin Ultrasound 1994; 22: 497-502
- Snijders RJ, De Courcy-Wheeler RH, Nicolaides KH. Intrauterine growth retardation and fetal transverse cerebellar diameter. Prenat Diagn 1994; 14: 1101-15
- Timor-Tritsch IE, Monteagudo A. Transvaginal fetal neurosonography: standardization of the planes and sections by anatomic landmarks. Ultrasound Obstet Gynecol 1996; 8: 42–47.
- Bromley B, Nadel AS, Pauker S, Estroff JA, Benacerraf BR. Closure of the cerebellar vermis: evaluation with second trimester US. Radiology 1994; 193: 761–763.
- Paladini D, Volpe P. Posterior fossa and vermian morphometry in the characterization of fetal cerebellar abnormalities: a prospective three-dimensional ultrasound study. Ultrasound Obstet Gynecol. 2006 May; 27(5):482-9.
- Pilu G, Visentin A, Valeri B. The Dandy-Walker complex and fetal sonography. Ultrasound Obstet Gynecol. 2000 Aug; 16(2):115-7.
- [Quantitative analysis of cerebellar vermis in fetuses with Dandy-Walker syndrome with three-dimensional ultrasonography]. Xie HN, Cai DL, He H, Zhu YX, Li LJ.Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2008 Feb; 30(1):80-5.
- Malinger G, Lev D, Lerman-Sagie T. Is fetal magnetic resonance imaging superior to neurosonography for detection of brain anomalies? Ultrasound Obstet Gynecol 2002; 20: 317–321
- Griffiths PD, Paley MN, Widjaja E, Taylor C, Whitby EH. In utero magnetic resonance imaging for brain and spinal abnormalities in fetuses. BMJ 2005; 331: 562–565.
- Malinger G, Ben-Sira L, Lev D, Ben-Aroya Z, Kidron D, Lerman-Sagie T. Fetal brain imaging: a comparison between magnetic resonance imaging and dedicated neurosonography. Ultrasound Obstet Gynecol 2004; 23: 333–340
- Koktener A, Dilmen G, Kurt A. The cisterna magna size in normal second-trimester fetuses. J Perinat Med. 2007; 35(3):217-9.
- Mahony BS, Callen PW, Filly RA, Hoddick WK. The fetal cisterna magna. Radiology 1984; 153: 773–776
- Goldstein RB, Podrasky AE, Filly RA, Callen PW. Effacement of the fetal cisterna magna in association with myelomeningocele. Radiology. 1989 Aug; 172(2):409-13.
- Ultrasound imaging of fetal brain abnormalities: three essential anatomical levels.
Angtuaco TL.Ultrasound Q. 2005 Dec; 21(4):287-94.
- Cystic malformations of the posterior fossa. Bernard JP, Moscoso G, Renier D, Ville Y.Prenat Diagn. 2001 Dec; 21(12):1064-9.
- Hereditary subependymal heterotopia associated with mega cisterna magna: antenatal diagnosis with magnetic resonance imaging. Bargalló N, Puerto B, De Juan C, Martinez-Crespo JM, Lourdes Olondo M.Ultrasound Obstet Gynecol. 2002 Jul; 20(1):86-9.
- Abnormal or delayed development of the posterior membranous area of the brain: anatomy, ultrasound diagnosis, natural history and outcome of Blake’s pouch cyst in the fetus.
Paladini D, Quarantelli M, Pastore G, Sorrentino M, Sglavo G, Nappi C.Ultrasound Obstet Gynecol. 2012 Mar; 39(3):279-87.
- Systematic review and meta-analysis of isolated posterior fossa malformations on prenatal ultrasound imaging (part 1): nomenclature, diagnostic accuracy and associated anomalies.
D’Antonio F, Khalil A, Garel C, Pilu G, Rizzo G, Lerman-Sagie T, Bhide A, Thilaganathan B, Manzoli L, Papageorghiou AT.Ultrasound Obstet Gynecol. 2016 Jun; 47(6):690-7. Epub 2016 May 10.
- Prenatal diagnosis and outcome of fetal posterior fossa fluid collections.
Gandolfi Colleoni G, Contro E, Carletti A, Ghi T, Campobasso G, Rembouskos G, Volpe G, Pilu G, Volpe P.Ultrasound Obstet Gynecol. 2012 Jun; 39(6):625-31. Epub 2012 May 14.
- Enlarged posterior fossa on prenatal imaging: differential diagnosis, associated anomalies and postnatal outcome. Wüest A, Surbek D, Wiest R, Weisstanner C, Bonel H, Steinlin M, Raio L, Tutschek B.Acta Obstet Gynecol Scand. 2017 Jul; 96(7):837-843. Epub 2017 Apr 10.
- slan H, Ulker V, Gulcan EM, Numanoglu C, Gul A, et al. Prenatal diagnosis of Joubert syndrome: a case report. Prenat Diagn 2002;22:13-16.
- Dirik MA, Yis U, Dirik E.: Molar tooth sign is not pathognomonic for Joubert syndrome.Pediatr Neurol. 2013 Dec;49(6):515-6.
- Joubert M, Eisenring JJ, Robb JP, Andermann F, Familial agenesis of the cerebellar vermis. A syndrome of episodic hyperpnea, abnormal eye movements, ataxia, and retardation in Neurology, vol. 19, nº 9, settembre 1969, pp. 813-825,
- Ferland R. J. et al. Abnormal cerebellar development and axonal decussation due to mutations in AHI1 in Joubert syndrome. Nature Genetics, September 2004, 36:1008-1013.
- Karakas E, Cullu N, Karakas O, Calik M, Boyaci FN, Yildiz S, Cece H, Akal A.: Joubert syndrome: the clinical and radiological findings.J Pak Med Assoc. 2014 Jan;64(1):91-4.
- Karegowda LH, Shenoy PM, Sripathi S, Varman M.: Joubert syndrome.BMJ Case Rep. 2014 Mar 20;2014.
- Maria BL, Quisling RG, Rosainz LC, et al.: Molar tooth sign in Joubert Syndrome: clinical, radiologic and pathologic significance. J Child Neurol 1999; 14:368-376.
- Ni Scanaill S, Crowley P, Hogan M, Stuart B. Abnormal prenatal sonographic findings in the posterior cranial fossa: a case of Joubert syndrome. Ultrasound Obstet Gynecol 1999;13:71-74.
- Pugash D., Godwin K., Robinson J., et al.: Sonographic “molar tooth” sugn in tge diagnosis of Joubert syndrome. Ultrasound Obstet Gynecol 2011; 38:598-602.
- Quarello E, Molho M, Garel C, et al..: Prenatal abnormal features of the fourth ventricle in Joubert syndrome and related disorders. Ultrasound Obstet Gynecol. 2014 Feb;43(2):227-32.
- Saraiva, JM, Baraitser M (1992) Joubert syndrome: a review. Am. J. Med. Genet. 43: 726-731
Shen O, Ben-Sira L, Rosenak D, Michaelson-Cohen R.: Early second-trimester molar tooth sign.Fetal Diagn Ther. 2014;36(3):259-62.









1 commento
Hi! I could have sworn I’ve visited this website before but after looking
at many of the articles I realized it’s new to me. Anyhow,
I’m definitely delighted I stumbled upon it and I’ll be bookmarking
it and checking back regularly!