Ultimo aggiornamento 2023-04-10
La terapia medica per il cancro mammario in genere è complementare all’intervento chirurgico e classicamente prevede la somministrazione di chemioterapici, preparati ormonali e chemioterapia con personalizzazione relativamente alla tipologia e al grading.
Carcinoma infiltrante
Radioterapia
Se si esegue l’asportazione locale è consigliabile la radioterapia. In alcuni casi, la radioterapia alla parete toracica è indicata anche in caso di mastectomia per evitare le recidive e per eliminare le cellule maligne residue. Si pratica radioterapia (boost sequenziale, 10 Gy) su letto operatorio e applicazione giornaliera di 2 Gy per cinque giorni a settimana per 5-6 settimane di seguito.
Chemioterapia
La chemioterapia postoperatoria dovrebbe essere intrapresa il prima possibile dopo l’intervento chirurgico (non più tardi di 4-6 settimane) e normalmente viene somministrata prima della radioterapia. Il trattamento chemioterapico convenzionale prevede l’utilizzo di regimi di associazione, contenenti antracicline e/o taxani, secondo schemi sequenziali e prolungati per circa 6 mesi. L’associazione di sostanze diverse consente di aggredire le cellule tumorali colpendo contemporaneamente diversi meccanismi essenziali per la loro replicazione. Inoltre, molti dei più recenti farmaci a bersaglio molecolare vengono somministrati in associazione con la chemioterapia: per esempio gli anticorpi monoclonali trastuzumab e pertuzumab nel trattamento dei tumori della mammella che esprimono il recettore per HER2.
ANTRACICLINE – Epirubicina, Doxorubicina
Doxorubicina (Adriblastina®, Caelyx®) chiamata anche con il nome di adriamicina: si tratta di un antibiotico antineoplastico, capace di agire soprattutto su cellule a rapida riproduzione proprio come quelle tumorali. Appartiene al gruppo delle antracicline; presenta anche attività antibatterica e immunosoppressiva. Viene spesso usata in associazione con altri farmaci antiblastici per la terapia di varie malattie neoplastiche tra cui il carcinoma della mammella. La doxorubicina è somministrata per via endovenosa periferica o centrale (PICC).
TAXANI: Docetaxel e Paclitaxel (o Taxolo) (Taxol®, Abraxane®, Praxene®, Anzatax®) è un fitoterapico estratto dalle radici del Tasso del Pacifico (Taxus Brevifolia); attualmente è sintentizzato in laboratorio. Agisce con meccanismo essenzialmente antimitotico, con effetti collaterali negativi inferiori rispetto a quelli della doxorubicina. Il taxolo è somministrato per via endovenosa ma occorre una terapia di prevenzione nell’immediatezza dell’infusione.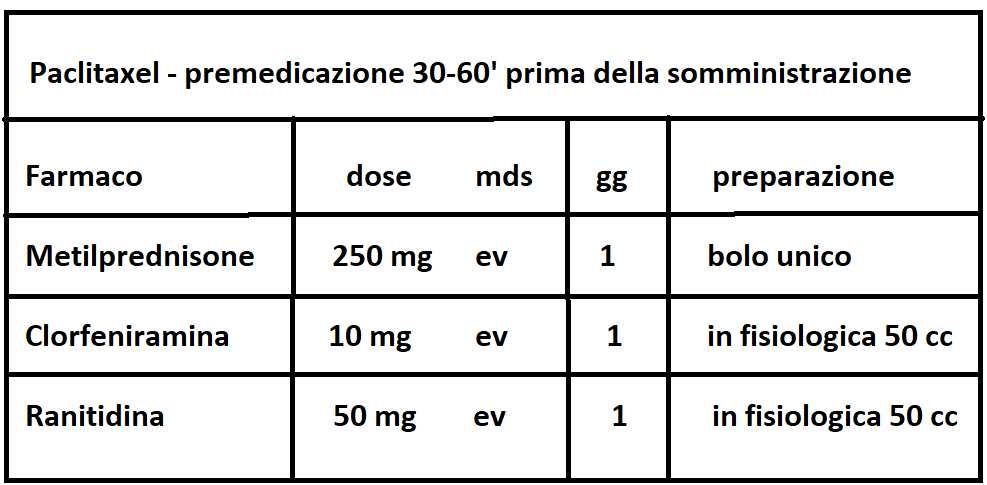
Il taxolo è utilizzato, molto spesso in associazione, nel trattamento di diverse neoplasie, tra cui in particolare ca. mammario (dopo terapia con antraciclina e ciclofosfamide, soprattutto in caso di metastasi).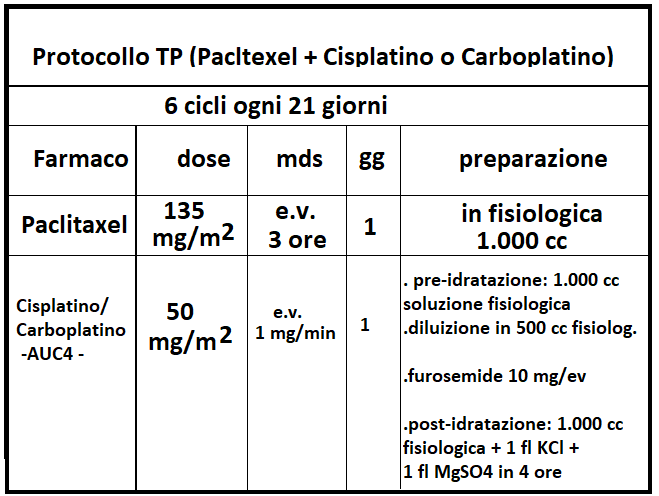
Il cisplatino è un farmaco chemioterapico appartenente alla classe degli agenti alchilanti e – come tutti gli agenti alchilanti – è in grado di formare legami con i due filamenti che costituiscono il DNA. Il legame del cisplatino ai filamenti di DNA impedisce che questo sia trascritto e replicato, condannando le cellule cancerose alla morte cellulare programmata (apoptosi). E’ indicato, in monoterapia o in associazione, per il trattamento del carcinoma mammario metastatico.
Per la monoterapia, sono raccomandati due regimi posologici:
- Singola dose da 50 a 120 mg/m² di superficie corporea ogni 3–4 settimane;
- 15-20 mg/m²/dì per cinque giorni, ogni 3-4 settimane.
Se il cisplatino viene utilizzato in una chemioterapia combinata, la dose di cisplatino deve essere ridotta. La dose abituale è 20 mg/m² o più una volta ogni 3-4 settimane.
Il cisplatino può anche essere utilizzato in combinazione alla terapia Auger, un particolare tipo di radioterapia che utilizza fasci di elettroni a bassa energia per irradiare le cellule maligne.
Il cisplatino è in grado di reagire con l’alluminio metallico formando un precipitato nero di platino. Il farmaco, perciò, va somministrato evitando l’uso di aghi, siringhe e cateteri contenenti alluminio.
- Nomi commerciali: (Cisplatino Pfizer® fl 10 ml 10 mg, 50 ml 50 mg 100 ml 100 mg, Cisplatino Teva® fl ev 100 ml 100 mg, Citoplatino®, Platamine®, Platinex®, Pronto Platamine®)
Ciclofosfamide (Endoxan® Baxter): in monoterapia: 40-50 mg/kg frazionati in più dosi in 2-5 giorni. In alternativa, assumere 10-15 mg/kg ogni 7-10 gg o 5 mg/kg due volte a settimana.
Derivati del fluoro (5-fluorouracile e capecitabina)
Di norma la chemioterapia viene somministrata nell’arco di 3-6 mesi e in genere include da tre-quattro a sei-otto cicli di trattamento, di durate e intervalli variabili. Il programma inoltre può cambiare in relazione al tipo di malattia, al singolo paziente e alla reazione individuale alle cure. Le interruzioni di qualche settimana fra un ciclo e l’altro garantiscono una maggiore efficacia, dal momento che non tutte le cellule sono contemporaneamente in fase di replicazione e quindi sensibili ai farmaci chemioterapici. Inoltre, consentono al corpo un migliore recupero dagli effetti collaterali. Una particolare modalità di somministrazione della chemioterapia è quella definita dose-densa che consiste nella riduzione del tempo che intercorre tra due successivi cicli di trattamento. Questa modalità richiede l’assunzione di fattori di crescita (IGF) che consentano una ripresa tempestiva del sistema immunitario prima dell’inizio del successivo trattamento.
I protocolli di associazione più comunemente utilizzati sono:
-
- AC (doxorubicina/adriamicina e ciclofosfamide)
- CMF (ciclofosfamide, metotrexate e 5-fluorouracile)
- CAF (ciclofosfamide, doxorubicina/adriamicina e 5-fluorouracile)
- FAC/FEC (5-fluorouracile, doxorubicina/adriamicina o epirubicina e ciclofosfamide).
Questi schemi possono essere a loro volta composti ulteriormente (per esempio, lo schema CMF può essere preceduto dalla somministrazione di adriamicina) o combinati con altri farmaci come i taxani o i derivati del platino o ancora con farmaci biologici come il trastuzumab.
TERAPIA ORMONALE
La terapia ormonale può essere utilizzata solo per tumori HR positivi; l’acronimo HR (Hormon Receptor) identifica i tumori caratterizzati dalla presenza di recettori per gli estrogeni (ER+) e/o progesterone (PR+). I carcinomi della mammella HR+ rappresentano circa il 70%
Prima della menopausa, la maggior parte degli estrogeni è sintetizzata dalla granulosa ovarica mentre dopo la menopausa le ovaie sono atresiche e gli estrogeni circolanti sono prodotti da tessuti periferici dell’organismo (soprattutto il tessuto adiposo e i muscoli) a partire dagli androgeni prodotti dalle ghiandole surrenali e metabolizzati in estrogeni soprattutto tramite l’azione dell’aromatasi.
1) Modulatori selettivi dei recettori estrogenici (SERMs): a seconda dell’organo bersaglio svolgono un’azione pro-estrogenica o anti-estrogenica; sono tamoxifene, raloxifene (Evista® cpr 60 mg), arzoxifene, lasoxifene.
Tamoxifene (Nolvadex® cpr 10, 20 mg): è al momento attuale l’unica terapia endocrina precauzionale che ha dimostrato di essere efficace nei ca. mammari ormono-sensibili (ER+ e PR+) che rappresentano il 70% dei ca. mammari. Il tamoxifene si lega ai recettori estrogenici, oltretutto iperespressi, impedendo agli estrogeni di esplicare la loro azione mitogena e proliferativa. Viene prescritto sia alle pazienti in premenopausa che a quelle in menopausa. La durata del trattamento è di 5 anni con dosi giornaliere di 20-40 mg. Recenti evidenze hanno dimostrato come il tamoxifene possa ridurre i livelli ematici di colesterolo totale, ed in particolare delle LDL, preservando al contempo il mantenimento della densità minerale ossea, risultando così protettivo nei confronti di patologie cardiovascolari e osteoporotiche. Se nell’esame istologico non sono stati trovati i recettori ormonali, la terapia endocrina non viene consigliata perché inutile, non porterebbe alcun beneficio.
In Italia nel 2017 l’Agenzia italiana del farmaco (AIFA) ha inserito il tamoxifene nell’elenco dei medicinali erogabili a totale carico del Servizio sanitario nazionale per il trattamento preventivo del carcinoma mammario in donne ad alto rischio (definite tali da specifici calcoli sulla base dei fattori di rischio).
2) Inibitori dell’aromatasi (IA): Letrozolo (Femara® cpr), Exemestane (Aromasin®), Anastrozolo (Arimidex®) –
Gli IA inibiscono la trasformazione degli androgeni in estrogeni; si sono dimostrati efficaci e sono prescritti soprattutto in caso di tumore invasivo e nelle donne in post-menopausa dal momento che in menopausa gli estrogeni sono sintetizzati principalmente dall’aromatasi (in età fertile, invece, prevale la secrezione ovarica, che avviene sotto stimolo dell’ormone luteinizzante LH). La dose raccomandata è 25 mg/die per os fino a 5 anni o fino alla completa remissione del cancro.
Nelle donne non ancora in menopausa occorre bloccare completamente l’attività delle ovaie (ablazione ovarica), inducendo in pratica la menopausa. Ciò si può fare in diversi modi:
- con un’asportazione chirurgica delle ovaie;
- con 3-4 applicazioni di radioterapia alle ovaie;
- con iniezioni di agonisti dell’LH-RH, che bloccando la secrezione e rilascio di LH inibiscono la produzione di estrogeni da parte delle ovaie.
3) LH-RH agonisti e antagonisti
La somministrazione pulsatile di Gn-RH, mediante pompa da infusione, è e utilizzata per stimolare la secrezione di di FSH ed LH, per confermare la diagnosi e terapia di ipogonadismo ipogonadotropo, amenorrea ipotalamica e anovulazione ipotalamica (31-35),
La somministrazione im/sc di Analoghi (Gn-RH-a), ormoni di sintesi simili al Gn-RH, in preparazione depot comporta inibizione della secrezione ipofisaria delle gonadotropine LH/FSH (dopo un flare-up iniziale) e riduzione dell’espressione del recettore. Viene utilizzata per la terapia di Pubertà precoce centrale, Carcinomi prostatico e mammario, iperplasia endometriale steroido-dipendente, Leiomiomi uterini, Endometriosi, Sindrome dell’ovaio policistico, Irsutismo, Turbe sessuali. Alcuni nomi commerciali di Gn-RH-a:
- leuprorelina (Lupron, Eligard)
- buserelina (Suprefact, Suprecor)
- nafarelina (Synarel)
- istrelina (Supprelin LA, Vantas)
- goserelina (Zoladex)
- deslorelina (Suprelorin, Ovuplant)
- triptorelina (Gonapeptyl®, Decapeptyl® fl s.c. 0,1 mg/ml, fl im 3,75 mg/2ml, fl im 11,25 mg/2 ml soluzione a rilascio prolungato)
Effetti avversi dei GnRH-a:
- Iniziale iperstimolazione gonadotropinica (flare-up)
- Ipogonadismo
- Vampate di calore
- Secchezza e atrofia vaginale
- Impotenza
- Osteoporosi: controllare calcemia, densità ossea
Antagonisti recettoriali del Gn-RH (Ganirelix (Orgalutran® fl s.c. 0,25 mg/0,5 ml; Cetrotide (Cetrorelix® fl sc 0,25 mg, fl 3 mg): Stessi usi clinici degli analoghi però non inducono il flare up iniziale. Poco utilizzati nella terapia antiblastica.
TERAPIA BIOLOGICA – Terapia anti-HER2
Se le cellule carcinomatose hanno un’iperespressione del recettore HER2 sulla membrana cellulare, il tumore è chiamato HER2 positivo. Per questo tipo di carcinoma della mammella si può effettuare la terapia anti-HER2 con Trastuzumab (Hercepitin®) o Bevacizumab (Avastin®): la dose raccomandata per il trattamento del cancro al seno è 10 mg/kg per via endovenosa ogni 2 settimane; in genere, il farmaco viene combinato con paclitaxel (Abraxane®, Paxene®).
Il farmaco è utilizzato sia in monoterapia, sia in associazione con altri farmaci (es. paclitaxel). Iniziare l’assunzione con 4 mg/kg per infusione e.v. di 90 minuti. Proseguire la terapia con 2 mg/kg per infusione endovenosa di 30 minuti ogni settimana, fino alla completa regressione del tumore.
- Lapatinib (Tyverb®) la dose iniziale è di 1250 mg (5 tavolette) da assumere per os una volta al dì, per un periodo variabile da 1 a 21 giorni, in associazione a capecitabina (Xeloda®). Il trattamento va protratto fino alla regressione della neoplasia.
Prognosi: il 97,1% delle donne con un tumore allo stadio 1 sopravvive per cinque anni e 94% vive più di dieci anni.
Nei tumori al secondo stadio, l’88% delle donne vive per più di cinque anni e il 79,4% supera i dieci anni. Il tasso di mortalità è alto anche nelle neoplasie al terzo stadio: il 70,1% delle donne vive oltre cinque anni e il 46,3% vive per oltre dieci anni. Al quarto stadio la speranza di vita media è di:
- 4-6 mesi se la paziente ha delle metastasi epatiche;
- Due anni in caso di metastasi polmonari;
- Maggiore di 5 anni se ci sono solo metastasi ossee.
Carcinoma tubulare – Recenti studi hanno suggerito un possibile ruolo del CT come precursore del ca. duttale in situ (DCIS) di lieve grado (41-45).
La diagnosi e il trattamento locale (chirurgia e radioterapia) sono in linea generale uguali agli altri tipi di carcinoma (46-49). La ricerca del nodo sentinella e la biopsia linfonodale ascellare non è ritenuta necessaria dalla maggior parte degli AA. in caso di CT <1 cm; ma anche in questi casi si sono ritrovati casi di micrometastasi ascellari anche se molto rari (46-51).
Terapia medica adiuvante: La maggior parte dei carcinomi tubulari contiene i recettori ormonali per gli estrogeni e il progesterone. È perciò solitamente indicata una terapia ormonale per ridurre le dimensioni della neoplasia e anche come prevenzione (50-59).
Poiché il carcinoma tubulare si diffonde molto meno di altri tipi di tumore alle ghiandole linfatiche dell’ascella e ad altre aree del corpo la chemioterapia è raramente indicata (53-57).
Il carcinoma tubulare inoltre non presenta di solito sulla superficie delle cellule tumorali la proteina (detta anche recettore) chiamata HER2 (o Cerb-B2) che stimola le cellule tumorali a crescere. Non vi è perciò indicazione alla terapia biologica mirata (terapia a bersaglio) (52-56).
Carcinoma midollare – caratteristica del carcinoma midollare è la presenza pressocchè costante nella paziente della mutazione del gene BRCA1.
La prognosi di questo tipo di tumore è solitamente molto buona, grazie alla crescita lenta e alla strettissima adesione intercellulare delle cellule carcinomatose.
Il trattamento (chirurgia e radioterapia) è, in linea generale, uguale agli altri tipi di carcinomi mammari.
Terapia medica adiuvante: molto spesso all’esame istologico i tumori midollari si presentano come triplo negativi: ai recettore degli estrogeni (ERs), ai recettori del progesterone (PRs) e ai recettori del fattore di crescita epidermico umano 2 (HERs-2). Nei carcinomi midollari non è perciò indicata né una terapia ormonale né la terapia biologica mirata con Trastuzumab (Herceptin®). Poiché il carcinoma midollare ha in genere una prognosi favorevole e scarsa aggressività, anche la chemioterapia è raramente indicata.
Carcinoma infiammatorio
Il carcinoma infiammatorio può crescere più velocemente di altri tipi di tumore e quindi diffondersi ad altre parti del corpo. Per questa ragione il trattamento deve essere iniziato velocemente.
Il tipo di trattamento dipende dal risultato della biopsia e degli esami radiologici che sono stati eseguiti.
Nella maggior parte dei casi viene usata una combinazione di diverse terapie, usate di solito in successione:
- Terapia sistemica:
viene di solito usata come prima scelta. Nella maggior parte dei casi il carcinoma infiammatorio non contiene i recettori ormonali per gli estrogeni e il progesterone. La chemioterapia rappresenta perciò il trattamento di scelta mentre non è indicata la terapia ormonale. Il carcinoma infiammatorio presenta invece, più spesso che altri tipi di tumori, sulla superficie delle cellule tumorali il recettore HER2 (o Cerb-B2) che stimola le cellule tumorali a crescere. Può essere quindi utile associare alla chemioterapia una terapia biologica mirata (terapia a bersaglio) con Trastuzumab (Herceptin®).
- Chirurgia
Poiché il carcinoma infiammatorio tende a coinvolgere più aree del seno e a interessare diffusamente i vasi linfatici, il trattamento chirurgico indicato è di solito la mastectomia. È sempre raccomandato rimuovere e analizzare alcuni o tutti i linfonodi sotto il braccio (ascella) per verificare se questi contengano o meno cellule tumorali. I linfonodi dell’ascella sono infatti la prima tappa attraverso cui le cellule tumorali vengono filtrate dal sistema linfatico. Sapere se i linfonodi siano interessati dal tumore è importante per decidere quali trattamenti proporre dopo l’intervento chirurgico.
- Radioterapia
Nella maggior parte dei casi è indicata una radioterapia sulla parete toracica e spesso sulle aree di drenaggio linfatico (ascella, collo).
- Chirurgia ricostruttiva
La necessità di una radioterapia postoperatoria su un’ampia regione (parete toracica e aree di drenaggio linfatico) e di verificare che la malattia non si ripresenti precocemente nelle sedi dell’intervento fanno sì che la ricostruzione del seno venga di solito considerata e discussa solo in un secondo tempo (cosiddetta ricostruzione ritardata).
Nonostante il carcinoma infiammatorio sia una forma più seria di tumore al seno, le possibilità di trattamento sono migliorate negli ultimi anni e con esse anche la prognosi.
Il carcinoma mucinoso di solito non presenta sulla superficie delle cellule tumorali la proteina (detta anche recettore) chiamata HER2 (o Cerb-B2) che stimola le cellule tumorali a crescere. Non vi è perciò indicazione alla terapia biologica mirata (terapia a bersaglio) con Trastuzumab (Herceptin®).
I tumori metaplastici all’esame patologico sono abitualmente triplo negativi. Nei carcinomi metaplastici non è perciò indicata né una terapia ormonale né la terapia biologica mirata (terapia a bersaglio) con Trastuzumab (Herceptin®).
La chemioterapia rappresenta perciò il trattamento precauzionale di scelta in questi tumori.
Tumori cribriformi e ca. papillare – I principi di diagnosi e trattamento sono uguali agli altri tipi di tumore.
Tumore filloide maligno
L’intervento chirurgico è molto spesso il solo trattamento necessario per un tumore filloide maligno.
Può essere consigliato un intervento conservativo (tumorectomia o quadrantectomia) . Si tratta dell’asportazione di una parte del tessuto mammario con un margine (bordo) di tessuto normale attorno all’area interessata.
In alcuni casi può essere consigliata una mastectomia. La scelta tra i diversi tipi di intervento dipende da molti fattori, per esempio l’estensione della malattia nel seno e le dimensioni del seno stesso. Le diverse possibilità vanno discusse con il chirurgo di riferimento. Una mastectomia è di solito raccomandata se non è stato possibile ottenere un margine di tessuto sano dopo un intervento conservativo.
Se viene proposta una mastectomia di solito si discute sulla possibilità di una ricostruzione de seno. L’intervento di ricostruzione può essere eseguito contemporaneamente alla mastectomia oppure in un secondo tempo..
Nel tumore filloide le cellule tumorali non si estendono di solito alle ghiandole linfatiche sotto l’ascella. Per questa ragione abitualmente non è necessario rimuoverle ed esaminarle come invece è richiesto negli altri casi di tumore invasivo.
Ulteriori trattamenti
Non sono di solito necessari ulteriori trattamenti dopo l’intervento chirurgico.
In alcuni casi rari i tumori filloide maligno e borderline possono riformarsi dopo un intervento chirurgico conservativo: anche in questi casi è di solito sufficiente un ulteriore trattamento chirurgico. Molto più raramente un tumore filloide maligno può diffondersi ad altri organi e richiedere un trattamento oncologico.
Cancro mammario triplo negativo, Triple-Negative Breast Cancer (TNBC): sulle cellule tumorali non si riscontrano recettori per estrogeni (ER), recettori per il progesterone (PR) e non HER2. Possono avere una velocità di crescita e diffusione più rapida rispetto a molti altri tipi di cancro mammario. Il 10-20% di questi tumori possiedono recettori per gli androgeni (AR positivi) e da un punto di vista molecolare, questi tumori sono molto simili a quelli della prostata, e potrebbero quindi essere suscettibile agli stessi agenti terapeutici come la bicalutamide (farmaco antiandrogeno non steroideo). Né la terapia ormonale, né i farmaci destinati a HER2 sono efficaci. La chemioterapia post-chirurgica migliora la sopravvivenza a 5 anni (79% vs. 69%) ed attualmente è l’unica terapia medica effettivamente disponibile (14-19).
Bibliografia:
- Pencavel TD, Hayes A: Breast sarcoma – a review of diagnosis and management
- A.M. Pluchinotta et al.: “Iconografia e metodologia clinica delle lesioni mammarie”, Edizioni Sorbona 1994.
- Forza Operativa Nazionale sul Carcinoma Mammario: “I tumori della mammella. Linee guida sulla diagnosi, il trattamento e la riabilitazione”, Marzo 2001.
- G. Bonadonna et al.: “Manuale di Oncologia Medica”, Masson, 1987
- Harris JR, Lippman ME, Morrow M, Osborne CK, editors. Diseases of the Breast. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2009.
- Caliskan M, Gatti G, Sosnovskikh I, et al. Paget’s disease of the breast: the experience of the European Institute of Oncology and review of the literature. Breast Cancer Research and Treatment 2008;112(3):513–521.
- Kanitakis J. Mammary and extramammary Paget’s disease. Journal of the European Academy of Dermatology and Venereology 2007;21(5):581–590.
- Harris JR, Lippman ME, Morrow M, Osborne CK, editors. Diseases of the Breast. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2009.
- Caliskan M, Gatti G, Sosnovskikh I, et al. Paget’s disease of the breast: the experience of the European Institute of Oncology and review of the literature. Breast Cancer Research and Treatment 2008;112(3):513–521.
- Kanitakis J. Mammary and extramammary Paget’s disease. Journal of the European Academy of Dermatology and Venereology 2007;21(5):581–590.
- Kawase K, Dimaio DJ, Tucker SL, et al. Paget’s disease of the breast: there is a role for breast-conserving therapy. Annals of Surgical Oncology 2005;12(5):391–397
- Marshall JK, Griffith KA, Haffty BG, et al. Conservative management of Paget disease of the breast with radiotherapy: 10- and 15-year results. Cancer 2003;97(9):2142–2149.
- Sukumvanich P, Bentrem DJ, Cody HS, et al. The role of sentinel lymph node biopsy in Paget’s disease of the breast. Annals of Surgical Oncology 2007;14(3):1020–1023.
- Laronga C, Hasson D, Hoover S, et al. Paget’s disease in the era of sentinel lymph node biopsy. American Journal of Surgery 2006;192(4):481–483.
- Joseph KA, Ditkoff BA, Estabrook A, et al. Therapeutic options for Paget’s disease: a single institution long-term follow-up study. Breast Journal 2007;13(1):110–111.
- Bone J Cell biology of Paget’s disease. Miner Res 1999 Oct;14 Suppl 2:3-8.
- Karakas C. Paget’s disease of the breast J Carcinog. 2011; 10: 31.
- Ascensao AC, Marques MS, Capitao-Mor M. Paget’s disease of the nipple.Clinical and pathological review of 109 female patients. Dermatologica. 1985;170:170–9.
- Fu W, Lobocki CA, Silberberg BK, Chelladurai M, Young SC. Molecular markers in Paget disease of the breast. J Surg Oncol. 2001;77:171–8.
- Sagami S. Electron microscopic studies in Paget’s disease. Med J Osaka Univ. 1963;14:173–88.
- Sagebiel RW. Ultrastructural observations on epidermal cells in Paget’s disease of the breast. Am J Pathol. 1969;57:49–64. [PMC free article]
- Jahn H, Osther PJ, Nielsen EH, Rasmussen G, Andersen J. An electron microscopic study of clinical Paget’s disease of the nipple. APMIS. 1995;103:628–34.
- Kawase K, Dimaio DJ, Tucker SL, et al. Paget’s disease of the breast: there is a role for breast-conserving therapy. Annals of Surgical Oncology 2005;12(5):391–397.
- Marshall JK, Griffith KA, Haffty BG, et al. Conservative management of Paget disease of the breast with radiotherapy: 10- and 15-year results. Cancer 2003;97(9):2142–2149.
- Sukumvanich P, Bentrem DJ, Cody HS, et al. The role of sentinel lymph node biopsy in Paget’s disease of the breast. Annals of Surgical Oncology 2007;14(3):1020–1023.
- Laronga C, Hasson D, Hoover S, et al. Paget’s disease in the era of sentinel lymph node biopsy. American Journal of Surgery 2006;192(4):481–483.
- Chen CY, Sun LM, Anderson BO. Paget disease of the breast: changing patterns of incidence, clinical presentation, and treatment in the U.S. Cancer 2006;107(7):1448–1458.
- Joseph KA, Ditkoff BA, Estabrook A, et al. Therapeutic options for Paget’s disease: a single institution long-term follow-up study. Breast Journal 2007;13(1):110–111.
-
Sullivan T, Raad RA, Goldberg S, Assaad SI, Gadd M, Smith BL, et al. Tubular carcinoma of the breast: a retrospective analysis and review of the literature. Breast Cancer Res Treat. 2005;93:199–205.
-
Cabral AH, Recine M, Paramo JC, McPhee MM, Poppiti R, Mesko TW. Tubular carcinoma of the breast: an institutional experience and review of the literature. Breast J. 2003;9:298–301.
-
Rakha EA, Lee AH, Evans AJ, Menon S, Assad NY, Hodi Z, et al. Tubular carcinoma of the breast: further evidence to support its excellent prognosis. J Clin Oncol. 2010;28:99–104.
-
Cooper HS, Patchefsky AS, Krall RA. Tubular carcinoma of the breast. Cancer. 1978;42:2334–2342.
-
McDivitt RW, Boyce W, Gersell D. Tubular carcinoma of the breast: clinical and pathological observations concerning 135 cases. Am J Surg Pathol. 1982;6:401–411.
-
Leibman AJ, Lewis M, Kruse B. Tubular carcinoma of the breast: mammographic appearance. AJR Am J Roentgenol. 1993;160:263–265.
-
Livi L, Paiar F, Meldolesi E, Talamonti C, Simontacchi G, Detti B, et al. Tubular carcinoma of the breast: outcome and loco-regional recurrence in 307 patients. Eur J Surg Oncol. 2005;31:9–12.
-
Fedko MG, Scow JS, Shah SS, Reynolds C, Degnim AC, Jakub JW, et al. Pure tubular carcinoma and axillary nodal metastases. Ann Surg Oncol. 2010;17(Suppl 3):338–342.
-
Diab SG, Clark GM, Osborne CK, Libby A, Allred DC, Elledge RM. Tumor characteristics and clinical outcome of tubular and mucinous breast carcinomas. J Clin Oncol. 1999;17:1442–1448.
-
Javid SH, Smith BL, Mayer E, Bellon J, Murphy CD, Lipsitz S, et al. Tubular carcinoma of the breast: results of a large contemporary series. Am J Surg. 2009;197:674–677.
-
Kader HA, Jackson J, Mates D, Andersen S, Hayes M, Olivotto IA. Tubular carcinoma of the breast: a population-based study of nodal metastases at presentation and of patterns of relapse. Breast J. 2001;7:8–13.
-
Fernandez-Aguilar S, Noël JC. Expression of cathepsin D and galectin 3 in tubular carcinomas of the breast. APMIS. 2008;116:33–40.
-
Abdel-Fatah TM, Powe DG, Hodi Z, Lee AH, Reis-Filho JS, Ellis IO. High frequency of coexistence of columnar cell lesions, lobular neoplasia, and low grade ductal carcinoma in situ with invasive tubular carcinoma and invasive lobular carcinoma. Am J Surg Pathol. 2007;31:417–426.
-
Aulmann S, Elsawaf Z, Penzel R, Schirmacher P, Sinn HP. Invasive tubular carcinoma of the breast frequently is clonally related to flat epithelial atypia and low-grade ductal carcinoma in situ. Am J Surg Pathol. 2009;33:1646–1653.
-
Kunju LP, Ding Y, Kleer CG. Tubular carcinoma and grade 1 (well-differentiated) invasive ductal carcinoma: comparison of flat epithelial atypia and other intra-epithelial lesions. Pathol Int. 2008;58:620–625.
-
Man S, Ellis IO, Sibbering M, Blamey RW, Brook JD. High levels of allele loss at the FHIT and ATM genes in non-comedo ductal carcinoma in situ and grade I tubular invasive breast cancers. Cancer Res. 1996;56:5484–5489.
-
Winchester DJ, Sahin AA, Tucker SL, Singletary SE. Tubular carcinoma of the breast: predicting axillary nodal metastases and recurrence. Ann Surg. 1996;223:342–347.
-
Stalsberg H, Hartmann WH. The delimitation of tubular carcinoma of the breast. Hum Pathol. 2000;31:601–607.
-
Hansen CJ, Kenny L, Lakhani SR, Ung O, Keller J, Tripcony L, et al. Tubular breast carcinoma: an argument against treatment de-escalation. J Med Imaging Radiat Oncol. 2012;56:116–122.
-
McBoyle MF, Razek HA, Carter JL, Helmer SD. Tubular carcinoma of the breast: an institutional review. Am Surg. 1997;63:639–644.
-
Shin HJ, Kim HH, Kim SM, Kim DB, Lee YR, Kim MJ, et al. Pure and mixed tubular carcinoma of the breast: mammographic and sonographic differential features. Korean J Radiol. 2007;8:103–110
-
Abdel-Fatah TM, Powe DG, Hodi Z, Reis-Filho JS, Lee AH, Ellis IO. Morphologic and molecular evolutionary pathways of low nuclear grade invasive breast cancers and their putative precursor lesions: further evidence to support the concept of low nuclear grade breast neoplasia family. Am J Surg Pathol. 2008;32:513–523.
-
Fernandez-Aguilar S, Jondet M, Simonart T, Nöel JC. Microvessel and lymphatic density in tubular carcinoma of the breast: comparative study with invasive low-grade ductal carcinoma. Breast. 2006;15:782–785.
-
Fernández-Aguilar S, Simon P, Buxant F, Simonart T, Noël JC. Tubular carcinoma of the breast and associated intra-epithelial lesions: a comparative study with invasive low-grade ductal carcinomas. Virchows Arch. 2005;447:683–687.
-
Fasano M, Vamvakas E, Delgado Y, Inghirami G, Mitnick J, Roses D, et al. Tubular carcinoma of the breast: immunohistochemical and DNA flow cytometric profile. Breast J. 1999;5:252–255.
-
Dejode M, Sagan C, Campion L, Houvenaeghel G, Giard S, Rodier JF, et al. Pure tubular carcinoma of the breast and sentinel lymph node biopsy: a retrospective multi-institutional study of 234 cases. Eur J Surg Oncol. 2013;39:248–254. Clinical practice guidelines in oncology – v.3.2013. National Comprehensive Cancer Network.[Accessed August 12th,
-
Lucci A, McCall LM, Beitsch PD, Whitworth PW, Reintgen DS, Blumencranz PW, et al. Surgical complications associated with sentinel lymph node dissection (SLND) plus axillary lymph node dissection compared with SLND alone in the American College of Surgeons Oncology Group Trial Z0011. J Clin Oncol. 2007;25:3657–3663.
-
Mansel RE, Fallowfield L, Kissin M, Goyal A, Newcombe RG, Dixon JM, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. J Natl Cancer Inst. 2006;98:599–609.




1 commento
Hey there! Do you use Twitter? I’d like too follow youu iif
thst wkuld bbe okay. I’m absolutely enjying your blog aand look forward to
neww updates.