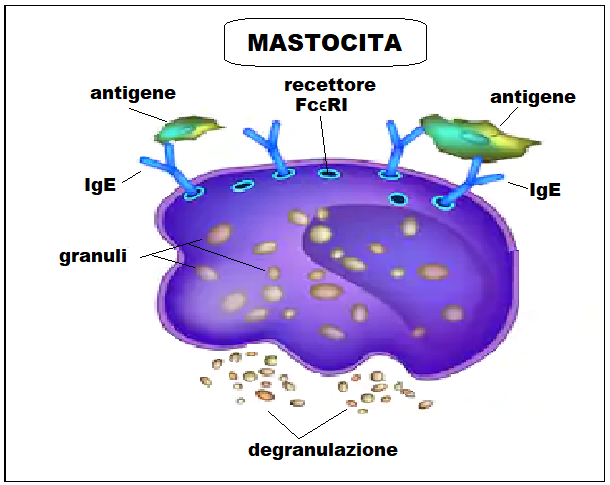
I mastociti, o mastcellule, sono cellule mononucleate, di forma ovoidale o ellissoidali, del diametro di 20-30 µ derivate dal processo di emopoiesi, dal ceppo mieloide. Appartengono al sistema immunitario innato.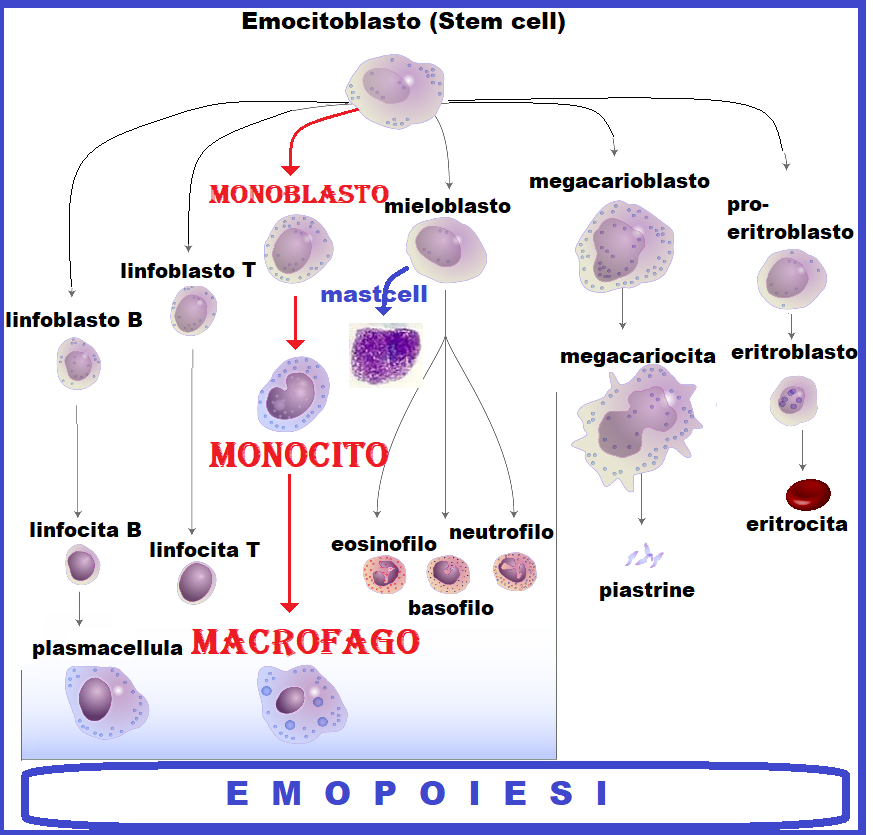
Prodotti dal midollo osseo le mastcellule si dispongono prevalentemente nel tessuto connettivo del tipo fibrillare lasso sottocutaneo e sottomucoso in prossimità dei vasi sanguigni e linfatici di tutto il corpo ad eccezione del tessuto nervoso e della retina. Non si trovano in circolo.
La mastcellula possiede una sottile membrana esterna che avvolge un citoplasma con mitocondri scarsi di numero e di piccole dimensioni e apparato del Golgi ben differenziato. Da quest’ultimo prendono origine 200-300 granuli del diametro di 0,3-0,8 µ, così densi da oscurare il nucleo; essi contengono eparina, istamina, triptasi, chimasi e TNF-alfa. Il colorante alcalino blu toluidina colorerà i granuli secretori rosso-violetto. Nel citoplasma si osservano anche gocce lipidiche, o corpi lipidici, contenenti acido arachidonico, interleuchine, fattori chemiotattici e NO.
In seguito ad insulto traumatico o flogistico i mastociti rilasciano l’eparina, l’istamina e altri modulatori flogistici all’esterno delle cellule mediante degranulazione. L’eparina ha lo scopo di impedire la coagulazione delle proteine plasmatiche fuoriuscite dal circolo ematico.
L’istamina agisce stimolando i recettori H1 che si trovano sulle cellule muscolari lisce e sulle cellule endoteliali producendo vasodilatazione, edema e contrazione delle fibre muscolari lisce sottostanti epitelio e mucose. L’aumento di vasodilatazione e permeabilità vascolare favorisce l’afflusso locale di altre cellule immunitarie (eosinofili, neutrofili, monociti, linfociti T) e antigeni per combattere e rimuovere gli agenti patogeni responsabili dell’infezione o infiammazione. La stessa contrazione delle miofibrille sottomucosali ha lo scopo di rimuovere i parassiti dal tratto gastrointestinale e respiratorio. In caso di esagerata degranulazione può comparire una reazione anafilattica o allergica.
Il meccanismo di degranulazione è innescata dal legame antigene-IgE se queste ultime risultano già migrate sulla superficie dei mastociti in occasione di precedenti esposizioni allo stesso antigene e legate ai recettori FcϵRI. Gli anticorpi IgE sono prodotti dalle cellule B mature in risposta alle cellule CD4 + Th2. Le cellule B mature naïve producono anticorpi IgM e IgD. Una volta attivati da un antigene, le cellule B prolifereranno. Se queste cellule B interagiscono con citochine, come IL-4 (che è modulata dalle cellule CD4 + Th2), la classe di anticorpi passa da IgM a IgE. Le IgE si trovano principalmente legate ai recettori FcϵRI sui mastociti e pochissime IgE si trovano come anticorpi solubili in circolazione. Quando un antigene entra in contatto con i mastociti, reticola due o più molecole di FcϵRI e attiva il rilascio di granuli dai mastociti.
L’acido arachidonico è il precursore di prostaglandine, trombossani e leucotrieni, tutti coinvolti nel processo infiammatorio con meccanismo vasodilatatorio e miocontratturante. Interleuchine e fattori chemiotattici favoriscono l’afflusso locale delle cellule immunitarie mentre l’ossido di azoto (NO) contribuisce notevolmente con l’istamina per l’effetto vasodilatatorio.
Clinica delle reazioni anafilattiche – I siti più comuni nel corpo esposti agli antigeni sono la mucosa del tratto respiratorio e gastrointestinale, il sangue e i tessuti connettivi. A livello cutaneo la  reazione anafilattica si traduce in reazione orticarioide e angioedema (e a lungo andare con dermatite atopica ed eczema) mentre a livello respiratorio si manifesta con costrizione delle vie aeree, aumento della produzione di muco e tosse e a livello gastro-enterico osserviamo iperacidità gastrica, vomito e diarrea.
reazione anafilattica si traduce in reazione orticarioide e angioedema (e a lungo andare con dermatite atopica ed eczema) mentre a livello respiratorio si manifesta con costrizione delle vie aeree, aumento della produzione di muco e tosse e a livello gastro-enterico osserviamo iperacidità gastrica, vomito e diarrea.
La desensibilizzazione dei mastociti può verificarsi a causa dell’esposizione a dosi crescenti di antigene. Questa tecnica può essere utilizzata se un paziente è allergico a un farmaco necessario e la prevenzione delle reazioni anafilattiche al cibo. Desensibilizzando i recettori, questo può ridurre il numero di molecole FcϵRI disponibili sulla superficie dei mastociti
References:
- da Silva EZ, Jamur MC, Oliver C. Mast cell function: a new vision of an old cell. J Histochem Cytochem (2014) 62(10):698–738.
- Galli SJ, Tsai M. Mast cells in allergy and infection: versatile effector and regulatory cells in innate and adaptive immunity. Eur J Immunol (2010) 40(7):1843–51.
- Jamur MC, Grodzki AC, Berenstein EH, Hamawy MM, Siraganian RP, Oliver C. Identification and characterization of undifferentiated mast cells in mouse bone marrow. Blood (2005) 105(11):4282–9. doi:10.1182/blood-2004-02-0756
- Metcalfe DD, Boyce JA. Mast cell biology in evolution. J Allergy Clin Immunol (2006) 117(6):1227–9.
- Collington SJ, Williams TJ, Weller CL. Mechanisms underlying the localisation of mast cells in tissues. Trends Immunol (2011) 32(10):478–85.
- Irani AA, Schechter NM, Craig SS, DeBlois G, Schwartz LB. Two types of human mast cells that have distinct neutral protease compositions. Proc Natl Acad Sci U S A (1986) 83(12):4464–8.
- Schwartz LB. Analysis of MC(T) and MC(TC) mast cells in tissue. Methods Mol Biol (2006) 315:53–62.
- Strauss-Albee DM, Horowitz A, Parham P, Blish CA. Coordinated regulation of NK receptor expression in the maturing human immune system. J Immunol (2014) 193(10):4871–9.
- Bradding P. Allergen immunotherapy and mast cells. Clin Exp Allergy (1999) 29(11):1445–8. doi:10.1046/j.1365-2222.1999.00675.x
- Hofmann AM, Abraham SN. New roles for mast cells in modulating allergic reactions and immunity against pathogens. Curr Opin Immunol (2009) 21(6):679–86.
- Galli SJ, Nakae S, Tsai M. Mast cells in the development of adaptive immune responses. Nat Immunol (2005) 6(2):135–42. doi:10.1038/ni1158
- Rasmussen T, Jensen JF, Ostergaard N, Tanner D, Ziegler T, Norrby PO. On the mechanism of the copper-catalyzed cyclopropanation reaction. Chemistry (2002) 8(1):177–84.
- Siraganian RP. Mast cell signal transduction from the high-affinity IgE receptor. Curr Opin Immunol (2003) 15(6):639–46.
- Sibilano R, Frossi B, Pucillo CE. Mast cell activation: a complex interplay of positive and negative signaling pathways. Eur J Immunol (2014) 44(9):2558–66.
- Kalesnikoff J, Galli SJ. New developments in mast cell biology. Nat Immunol (2008) 9(11):1215–23. doi:10.1038/ni.f.216
- Iwaki S, Tkaczyk C, Metcalfe DD, Gilfillan AM. Roles of adaptor molecules in mast cell activation. Chem Immunol Allergy (2005) 87:43–58.
- Hitomi T, Zhang J, Nicoletti LM, Grodzki AC, Jamur MC, Oliver C, et al. Phospholipase D1 regulates high-affinity IgE receptor-induced mast cell degranulation. Blood (2004) 104(13):4122–8.
- Barbu EA, Zhang J, Berenstein EH, Groves JR, Parks LM, Siraganian RP. The transcription factor Zeb2 regulates signaling in mast cells. J Immunol (2012) 188(12):6278–86.
- Shalit M, Levi-Schaffer F. Challenge of mast cells with increasing amounts of antigen induces desensitization. Clin Exp Allergy (1995) 25(9):896–902. doi:10.1111/j.1365-2222.1995.tb00033.x
- Norrby K. Mast cells and angiogenesis. APMIS (2002) 110(5):355–71.
- Bulfone-Paus S, Bahri R. Mast cells as regulators of T cell responses. Front Immunol (2015) 6:394. doi:10.3389/fimmu.2015.00394
- Goto Y, Kurashima Y, Kiyono H. The gut microbiota and inflammatory bowel disease. Curr Opin Rheumatol (2015) 27(4):388–96.
- Marshall JS. Mast-cell responses to pathogens. Nat Rev Immunol (2004) 4(10):787–99. doi:10.1038/nri1460
- Metz M, Siebenhaar F, Maurer M. Mast cell functions in the innate skin immune system. Immunobiology (2008) 213(3–4):251–60.
- Varadaradjalou S, Féger F, Thieblemont N, Hamouda NB, Pleau JM, Dy M, et al. Toll-like receptor 2 (TLR2) and TLR4 differentially activate human mast cells. Eur J Immunol (2003) 33(4):899–906.
- McCurdy JD, Olynych TJ, Maher LH, Marshall JS. Cutting edge: distinct toll-like receptor 2 activators selectively induce different classes of mediator production from human mast cells. J Immunol (2003) 170(4):1625–9.
- Orinska Z, Bulanova E, Budagian V, Metz M, Maurer M, Bulfone-Paus S. TLR3-induced activation of mast cells modulates CD8+ T-cell recruitment. Blood (2005) 106(3):978–87.
- Kulka M, Alexopoulou L, Flavell RA, Metcalfe DD. Activation of mast cells by double-stranded RNA: evidence for activation through toll-like receptor 3. J Allergy Clin Immunol (2004) 114(1):174–82.
- Stelekati E, Bahri R, D’Orlando O, Orinska Z, Mittrücker HW, Langenhaun R, et al. Mast cell-mediated antigen presentation regulates CD8+ T cell effector functions. Immunity (2009) 31(4):665–76.