Ultimo aggiornamento 2019-11-08 9:49:19 PM
Per osteoporosi si intende una osteopatia cronica ad etiologia  multifattoriale caratterizzata da una riduzione della densità ossea (massa ossea/unità di volume) ed un’alterazione della microarchitettura cui consegue una maggiore fragilità ossea e rischio di fratture (World Health Organization -WHO- 1994). Femore, polso e vertebre sono le sedi più colpite da fratture. In Italia, ogni anno, si verificano circa 250.000 fratture da osteoporosi di cui oltre 80.000 di femore.
multifattoriale caratterizzata da una riduzione della densità ossea (massa ossea/unità di volume) ed un’alterazione della microarchitettura cui consegue una maggiore fragilità ossea e rischio di fratture (World Health Organization -WHO- 1994). Femore, polso e vertebre sono le sedi più colpite da fratture. In Italia, ogni anno, si verificano circa 250.000 fratture da osteoporosi di cui oltre 80.000 di femore.
Si stima che in italia siano affetti da osteoporosi circa 3,5 milioni di donne e 1 milione di uomini. Il costo del trattamento per le fratture da osteoporosi supera i sette miliardi di euro all’anno.
L’osteoporosi inizia in maniera silente, motivo per cui è stata definita  “epidemia silenziosa” dell’età adulta. La sintomatologia si manifesta in genere dopo i 50 anni con aggravamento progressivo nell’età senile. Le donne sono più colpite rispetto agli uomini perchè posseggono una quantità minore di osso ed in genere vanno incontro ad un periodo più protratto di perdita di massa scheletrica. Per la donna si può dire che l’incidenza della malattia passa dal 14% nella quinta decade di vita al 70% dopo gli 80 anni.
“epidemia silenziosa” dell’età adulta. La sintomatologia si manifesta in genere dopo i 50 anni con aggravamento progressivo nell’età senile. Le donne sono più colpite rispetto agli uomini perchè posseggono una quantità minore di osso ed in genere vanno incontro ad un periodo più protratto di perdita di massa scheletrica. Per la donna si può dire che l’incidenza della malattia passa dal 14% nella quinta decade di vita al 70% dopo gli 80 anni.
FRATTURE DI FEMORE – Con il progressivo invecchiamento della popolazione, in particolare di quella italiana che è tra le più anziane, è da attendersi un incremento esponenziale delle fratture di femore. Le percentuali di incidenza di frattura del femore aumentano esponenzialmente dai 65 anni in poi, raddoppiandosi all’incirca ogni 5 anni di età fino ad interessare 2-4/100 di donne >85 anni. Si stima che i cambiamenti demografici del prossimi anni comporteranno un aumentato numero di fratture del femore nel mondo da 1.66 milioni del 1990 ai 6.26 milioni del 2050. La frattura del femore presenta una mortalità del 5% in fase acuta e del 15-25% entro un anno. La disabilità deambulatoria è permanente nel 20% dei casi e solo il 30-40% riacquista autonomia compatibile con le precedenti attività della vita quotidiana. La frattura della estremità prossimale del femore nella maggior parte è dovuta a caduta, anche banale, dalla stazione eretta e, molto raramente, avviene spontaneamente quando le condizioni dell’osso sono gravemente compromesse.
Fratture vertebrali – sono tra le più frequenti complicanze dell’osteoporosi ma troppo spesso sottovalutate. Infatti solo il 25-30% arriva alla diagnosi e ancora meno al trattamento. Anche perché non sono come le classiche fratture in giovane età, ma sono caratterizzate da riduzione in altezza e deformazione del corpo vertebrale a causa di lacune che si creano nell’osso trabecolare. Le conseguenze sono dolore (a volte assente) che spesso diventa cronico, riduzione di statura e incurvamento, ridotta mobilità e depressione.
Una tipica sede di frattura da osteoporosi è quella del polso (fratture di Colles) che si instaura per un trauma da caduta nel tentativo di proteggersi portando le braccia in avanti.
Quando la frattura non è diagnosticata correttamente o tempestivamente l’approccio più comunemente attuato è quello conservativo con analgesici, busto, fisioterapia e riposo a letto.
Classificazione dell’osteoporosi:
1) tipo I, post-menopausale
2) tipo II, senile
3) tipo III, secondaria ad altre patologie o interventi chirurgici o assunzione di farmaci.
L’osteoporosi si differenzia dalla demineralizzazione ossea che definisce una diminuzione dei soli componenti inorganici delle ossa (calcio e fosforo).
Le donne moderne hanno una densità ossea molto inferiore a quella delle loro trisavole. Un’ipotesi è che le donne nei secoli scorsi facevano molto più movimento, soprattutto camminavano di più. In passato la diagnosi di osteoporosi si limitava ad una valutazione qualitativa della diminuzione della massa ossea basata sull’aumentata radiotrasparenza dei segmenti scheletrici. L’aumento della radiotrasparenza però è visibile solo quando almeno il 30% della massa ossea è perduto.
L’osso è composto principalmente da calcio e fosforo unite in idrossiapatite di calcio (65%) + collagene, proteine e lipidi (35%). L’osso è strutturato in una parte esterna corticale e una parte interna o trabecolare spugnosa. Gli osteociti ricoprono la superficie dell’osso non in crescita.
Gli osteoblasti sono cellule specializzate nella produzione di tessuto osseo. Hanno forma globosica o poliedrica, monostratificata; tendono a giustapporsi l’un l’altro rivestendo piccole aree di matrice ossea, formando il cosiddetto fronte di mineralizzazione.
Gli osteoblasti sintetizzano le varie componenti tessutali, sia fibrose che amorfe, partecipando alla formazione dell’osteoide e alla regolazione dei processi di mineralizzazione dello stesso.
L’osteoide è dato da un supporto di fibre di collagene allineate a formare una matrice organica, sulla quale si legano i cristalli di idrossipatite ed altre componenti minerali. Le fibrille di collagene si dispongono in base a linee preferenziali di forza, in modo tale da conferire all’osso proprietà di resistenza alle sollecitazioni meccaniche.
L’osteocita, la cellula più abbondante nel tessuto osseo, deriva dalla trasformazione dell’osteoblasto, il quale dopo aver secreto la matrice extracellulare rimane intrappolato in essa e diventa una cellula quiescente con scarsissima attività metabolica.
Gli osteociti rimangono comunque collegati tra loro tramite prolungamenti che giungono fino al canale di Havers che ne consente il nutrimento. L’osteocita in caso di trauma o frattura ossea può riprendere la sua attività sintetica ritrasformandosi quindi in osteoblasto.
L’osteocita è contenuto in spazi di forma lenticolare dette lacune o osteoplasti. Al contempo, i suoi prolungamenti citoplasmatici sono alloggiati in canali o tunnel scavati nella matrice che prendono il nome di canalicoli, i quali sfociano nel canale di Havers, contenente i vasi sanguigni.
FISIOLOGIA DEL METABOLISMO OSSEO:
Il modellamento osseo è soggetto, oltre che all’apporto di calcio, ad un’interazione fra osteoblasti, osteoclasti, ormoni sistemici e fattori locali di crescita. La mineralizzazione ossea è favorita da apporto di calcio, vitamina D, estrogeni, calcitonina, attività fisica, testosterone, IGF-1, ormoni tiroidei, dieta ed esposizione solare. Il paratormone (PTH) svolge sia la funzione favorente l’osteoclastogenesi che la funzione protettiva osteoblastica mediante la sintesi delle proteine RNKLE e OPG rispettivamente.
Il picco di massa ossea si raggiunge alla fine della IIa decade di vita; dopo di allora si ha una lenta diminuzione della massa ossea che interessa soprattutto la parte trabecolare dell’osso e molto meno la parte corticale che addirittura aumenta in alcune donne. Nelle donne la perdita di tessuto osseo trabecolare si accelera con il crollo della concentrazione sierica degli estrogeni.
A) Calcitonina, ormone polipeptidico secreto dalle cellule parafollicolari (cellule C) della tiroide. La concentrazione sierica normale si aggira sui 15 pg/ml. La secrezione di calcitonina è stimolata da alti livelli plasmatici di calcio e dagli estrogeni.
La calcitonina stimola il deposito di calcio nelle ossa (azione antagonista al paratormone), riduce il livello di calcemia, inibisce l’attività degli osteoclasti già differenziati; antagonizza la fusione e la differenziazione dei precursori osteoclastici; riduce i livelli sierici di interleukina I, IL-11 e IL-6 che inducono il riassorbimento osseo.
deposito di calcio nelle ossa (azione antagonista al paratormone), riduce il livello di calcemia, inibisce l’attività degli osteoclasti già differenziati; antagonizza la fusione e la differenziazione dei precursori osteoclastici; riduce i livelli sierici di interleukina I, IL-11 e IL-6 che inducono il riassorbimento osseo.
B) Paratormone (PTH): ormone polipeptidico ipercalcemizzante e osteoclastico. Sintetizzato e secreto dalle paratiroidi, quattro piccolissime ghiandole situate posteriormente alla tiroide e al timo. Circola nel sangue in forma libera ed in concentrazione di 30 pg/ml. Il frammento N-terminale biologicamente attivo ha un’emivita di pochi minuti. La produzione di PTH è regolata essenzialmente dalla concentrazione di calcio nel sangue in maniera opposta alla cacitonina: un’aumentata concentrazione di calcio inibisce la secrezione di PTH tramite 2 meccanismi principali:
- stimolazione dei calciomimetici -cinacalcet- che si legano ai recettori del calcio sulle paratiroidi e ne impediscono la secrezione di PTH;
- stimolazione del recettore CaR (3q13.3-21) da parte del Ca++e conseguente attivazione PLC ed inibizione dell’adenil-ciclasi con riduzione della secrezione di PTH. Sono state descritte mutazioni inattivanti del recettore CaR (3q13.3-21), che determinano ipocalcemia ipercalciurica.La Familial Hypocalciuric Hypercalcemia (FHH) è una sindrome caratterizzata da un alterato setpoint della sensibilità del PTH ai valori della calcemia (resistenza delle paratiroidi all’effetto inibitorio del Calcio sulla secrezione di PTH) e da aumentato riassorbiment renale di Ca++. Si La FHH è una sindrome caratterizzatada una solitamente asintomatica con alterazione dei valori della calcemia, con relativa ipocalciuria e valoriinappropriatamente nella norma di PTH
In presenza di una riduzione del 5% della calcemia, le paratiroidi, dotate di recettori specifici per il calcio, rispondono rapidamente con un incremento di 4 volte la normale secrezione di PTH. Il PTH agisce direttamente sugli osteoblasti e indirettamente sugli osteoclasti (cellule deputate alla disgregazione della matrice ossea e al riassorbimento osseo) aumentando la mobilizzazione del calcio dalle ossa. Inoltre il PTH stimola l’assorbimento intestinale e il riassorbimento tubulare di calcio e l’eliminazione renale di fosfato.
In breve, il PTH aumenta la concentrazione plasmatica di calcio e ne diminuisce la concentrazione ossea.
C) Estrogeni: favoriscono l’osteogenesi con vari meccanismi:
- favoriscono l’azione del PTH sulla sintesi della proteina OPG nel reticolo endoplasmatico degli osteoblasti con depressione dell’osteoclastogenesi.
- stimolano la secrezione e l’azione della calcitonina nella depressione degli osteoclasti
- aumentano l’assorbimento intestinale di calcio tramite l’aumento dei recettori per il calcitriolo
- stimolano la sintesi epatica di Thyroxine-binding globulin (TBG), inducendo in tal modo un aumento complessivo della concentrazione plasmatica degli ormoni tiroidei ed in particolare della calcitonina.
- inibiscono la secrezione delle interleuchine IL-I, IL-6 e IL-11 e del TNF-β favorenti l’osteoclastogenesi.
D) Vitamina D: esistono 5 isoforme di vitamina D. Le più importanti sono la vitamina D3 (colecalciferolo), derivante dal colesterolo e sintetizzato negli organismi animali e la vitamina D2 (ergocalciferolo) di provenienza vegetale. La vitamina D ottenuta dall’esposizione solare o attraverso la dieta è presente in una forma biologicamente non attiva e deve subire due reazioni di idrossilazione per essere trasformata nella forma biologicamente attiva, il calcitriolo o 1,25(OH)2D. La funzione del calcitriolo è quella di:
- favorire l’assorbimento intestinale del calcio e dei fosfati legandosi ai recettori specifici della vitamina D (VDR) a livello della mucosa intestinale e stimolando la sintesi di una proteina legante il calcio, la calbindina.
- creare una via di rapido assorbimento del calcio (“transcaltachia”) tramite il legame del calcitriolo con una proteina della membrana cellulare distinta dai suoi recettori specifici VDR.
- favorire il riassorbimento tubulare del calcio
- favorire, nel citoplasma degli osteoblasti, la sintesi di proteine (quali l’osteocalcina -la principale proteina della matrice ossea- e l’osteopontina) e la fosfatasi alcalina che idrolizza i monoesteri fosforici.
E) Calcio: è l’elemento fondamentale dell’osteogenesi. E’ assorbito a livello dell’intestino tenue tramite l’azione della vitamina D e degli estrogeni. Il calcio contenuto nell’organismo umano è quasi tutto (98%) concentrato nelle ossa in forma stabile (95%) e in un pool labile del 5%. Il calcio plasmatico costituisce appena l’1% di tutto il calcio del corpo umano e circola in forma labile, ionizzato (Ca++), attivo, prontamente utilizzabile (5.5 mg/dl) ed al 50% legato all’albumina o complessato in forma di sali con (fosfato, citrato, etc); la quota legata all’albumina aumenta in caso di pH basico del sangue e viceversa in caso di abbassamento del pH ematico. L’1% è costituito dal calcio intracellulare ed extracellulare.
Ipercalcemia si verifica in caso di iperparatiroidismo, neoplasie, intossicazione da vitamina D, S. di Burnett (ipercalcemia e pH del sangue alcalino per eccessiva ingestione di latte e/o utilizzo di antiacidi), farmaci tiazidici, M. di Paget (aumento del riassorbimento osteoclastico a cui fa seguito una reazione riparativa ossea o fibrosa, disordinata e riccamente vascolarizzata), pH acido del lume intestinale mentre l’ipoparatiroidismo, il malassorbimento intestinale, un pH basico del lume intestinale, dieta iperlipidica e/o ricca di fosfati determinano ipocalcemia.
Il metabolismo del calcio è modulato dall’azione di PTH, calcitonina, vitamina D, estrogeni, funzionalità renale e intestinale. L’assorbimento intestinale del calcio apportato con la dieta e la regolazione della calcemia avvengono attraverso molteplici meccanismi:
- trasporto passivo regolato dal gradiente osmotico tra il lume intestinale e il torrente circolatorio tale gradiente dipende dalla quantità di calcio ionizzato (Ca++) presente nel lume intestinale e nel sangue.
- trasporto attivo ad opera della Ca-binding protein (Ca-BP) stimolata dalla vitamina D che si lega al recettore specifico (VDR) presente sulla superficie della Ca-BP. La vitamina D favorisce inoltre il riassorbimento tubulare del calcio.
- Assorbimento rapido del calcio (transcalchia) ad opera della vitamina D che si avvale dell’azione di una proteina distinta dalla Ca-BP.
- trasporto diretto operato dagli estrogeni. Gli estrogeni inoltre stimolano la sintesi dei VDR.
- azione del PTH nel favorire l’assorbimento intestinale di calcio e nel suo riassorbimento tubulare renale.
- l’assorbimento intestinale è depresso dalla calcitonina che deprime anche il riassorbimento tubulare.
F) BMPs (Bone morphogenetic proteins): fattori di crescita appartenenti alla stessa superfamiglia dei TGF-β (transforming growth factor beta); stimolano l’osteogenesi. Infatti il BMP-2 può essere utilizzato in vari interventi terapeutici, quali difetti ossei, fratture non-unione, fusione spinale, osteoporosi e chirurgia del canale radicolare (1,2).
OSTEOCLASTOGENESI
L’osteoclasto è una cellula molto grande polinucleata (sincizio) e ricca di lisosomi. Contiene tra 3 e 100 nuclei per cellula, ma di solito sono presenti 10-20 nuclei per cellula. Appartiene alla linea dei monociti-macrofagi, deriva cioè dalla cellula mesenchimale emopoietica.
Presenta una membrana apicale e una membrana basale che è ricca di molte estroflessioni che le conferiscono un orletto a spazzola ricco di enzimi proteolitici e idrogenioni.
Il paratormone (PTH) stimola l’osteoclastogenesi in maniera indiretta agendo sugli osteoblasti. Questi ultimi sotto l’influenza del PTH secernono una citochina, la M-CSF, per la quale i monociti possiedono un recettore specifico, il c-fms. Affinchè si abbia il passaggio “linea monocitaria => precursore osteoclastico” occorre un segnale da parte dell’osteoblato che, sotto l’influenza del PTH, secernono il M-CSF (Macrophage-colony stimulating factor), nonché citochina per la quale i monociti possiedono un recettore specifico. Il legame fra M-CSF e il suo recettore c-fms promuove la differenziazione dei monociti in in osteoclasti.
Inoltre, sempre stimolati dal PTH gli osteoblasti secernono una proteina chiamata RANKL, per la quale i monociti possiedono il recettore specifico RANK. Queste molecole prodotte dagli osteoblasti interagiscono quindi con i monociti, inducendoli a differenziarsi in osteoclasti. Infine gli osteoblasti per mitigare l’azione di RANKL secernono un finto recettore solubile, chiamato osteoprotegerina (OPG), che legandosi a RANKL, ne impedisce l’interazione con il corretto recettore monocitario RANK presente, come detto, sulla superficie dei monociti. L’equilibrio fra la produzione di RANKL, M-CSF e OPG stabilisce il livello di osteoclastogenesi.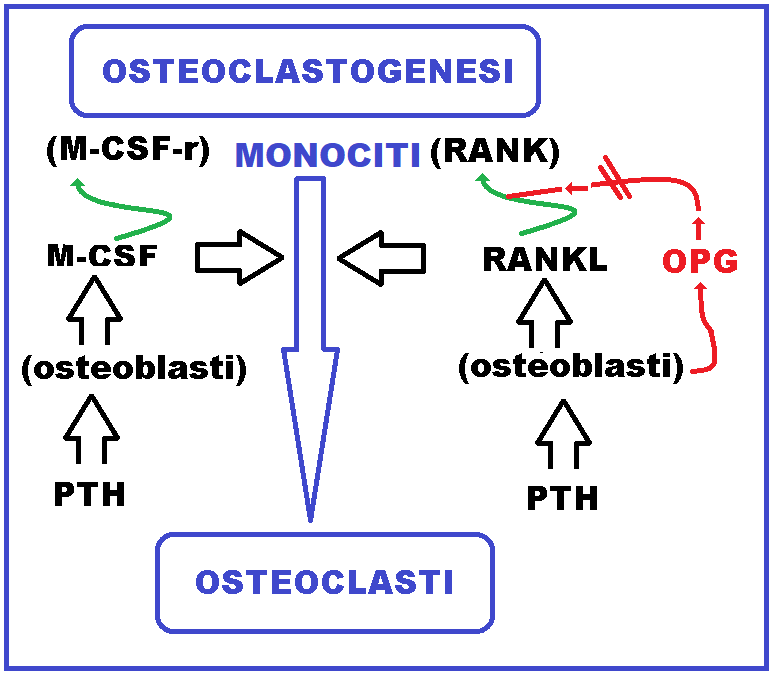
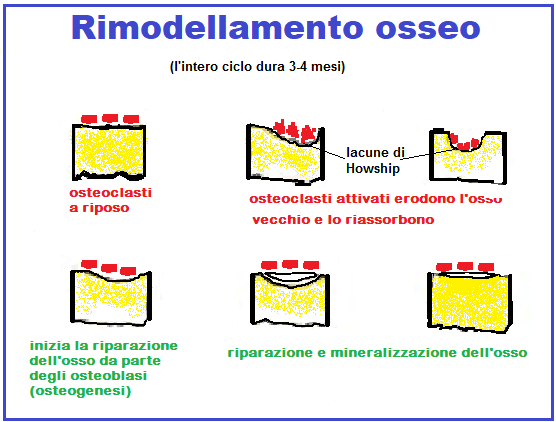
RIMODELLAMENTO OSSEO – Gli osteoclasti vanno a contatto con la matrice ossea e hanno la funzione fisiologica di eliminare la parte vecchia dell’osso. Quando gli osteoclasti sono adesi sulla superficie ossea, sotto la cellula si forma un caratteristico “pozzo di riassorbimento” in corrispondenza della zona di adesione. La capacità di scavare in modo efficiente l’osso è una funzione unica degli osteoclasti e richiede molti sistemi specializzati e una regolazione squisita per mantenere l’osso sano.
L’eccessivo rimodellamento osseo è una caratteristica di un certo numero di stati patologici, come l’artrite reumatoide, ipercalcemia maligna, malattia di Paget ossea, e l’osteoporosi, mentre un difettoso rimodellamento osseo è osservato nell’osteopetrosi (malattia delle ossa di marmo). Nei bambini affetti da osteopetrosi non si ha rimozione di osso e, intorno ai 3 anni d’età, vanno incontro, tra i vari sintomi, a cecità per obliterazione del forame ottico con danno irreversibile al nervo ottico, ma anche a sordità per obliterazione del meato acustico interno (danno ai nervi faciale e vestibolo-cocleare).
Senza rimodellamento, lo scheletro alla fine crollerebbe. Gli umani rimodellano il loro scheletro a velocità diverse a seconda della posizione dell’osso e della fisiologica attività di numerosi fattori tra cui forze meccaniche, stato dell’ormone autocrino e paracrino e influenze immunologiche.
Il rimodellamento osseo da parte degli osteoclasti si svolge in 3 fasi:
- l’adesione degli osteoclasti alla matrice ossea da riassorbire,
- la creazione di un ambiente acido che solubilizza la matrice minerale,
- la digestione enzimatica della matrice organica.
Di seguito avviene la riparazione e mineralizzazione dell’osso.
EZIOLOGIA DELL’OSTEOPOROSI
L’osteoporosi si presenta allorché viene a mancare l’equilibrio fra distruzione dell’osso e la sua  rigenerazione. Poiché l’osteoporosi è un fenomeno che si registra soprattutto dopo la menopausa, si deduce che, nelle donne, il fattore etiologico principale dell’osteoporosi sia la brusca carenza di estrogeni che si verifica nella donna in menopausa o con senescenza ovarica o sottoposta ad ovariectomia chirurgica o teratogena. Gli estrogeni agiscono soprattutto inibendo l’adesione recettoriale della proteina RANKLE al loro recettore specifico RANK, attivando l’azione della calcitonina e l’assorbimento intestinale del calcio.
rigenerazione. Poiché l’osteoporosi è un fenomeno che si registra soprattutto dopo la menopausa, si deduce che, nelle donne, il fattore etiologico principale dell’osteoporosi sia la brusca carenza di estrogeni che si verifica nella donna in menopausa o con senescenza ovarica o sottoposta ad ovariectomia chirurgica o teratogena. Gli estrogeni agiscono soprattutto inibendo l’adesione recettoriale della proteina RANKLE al loro recettore specifico RANK, attivando l’azione della calcitonina e l’assorbimento intestinale del calcio.
 Ma nel meccanismo di insorgenza dell’osteoporosi sono massicciamente coinvolti anche gli ormoni tiroidei e paratiroidei, le interleuchine e i monociti. La presenza e il ruolo fondamentale di questi ultimi ha fatto ipotizzare recentemente come il fattore flogistico sia un elemento essenziale della patologia osteoporotica. Così alcuni AA. sono giunti ad affermare che l’osteoporosi possa essere essenzialmente una malattia infiammatoria.
Ma nel meccanismo di insorgenza dell’osteoporosi sono massicciamente coinvolti anche gli ormoni tiroidei e paratiroidei, le interleuchine e i monociti. La presenza e il ruolo fondamentale di questi ultimi ha fatto ipotizzare recentemente come il fattore flogistico sia un elemento essenziale della patologia osteoporotica. Così alcuni AA. sono giunti ad affermare che l’osteoporosi possa essere essenzialmente una malattia infiammatoria.
A) Ipoestrogenismo menopausale o iatrogeno: gli estrogeni sono fondamentali nel complesso meccanismo del metabolismo osseo che risulta orientato in direzione catabolica in caso di diminuita concentrazione plasmatica degli estrogeni con i seguenti meccanismi:
- viene a mancare la produzione di OPG da parte degli osteoblasti
- Diminuzione della secrezione di calcitonina e dell’intensità di azione
- calo del trasporto digestivo vitamina D mediato
- calo dell’assorbimento intestinale del calcio senza modificazioni significative dei livelli circolanti della vitamina D. Ciò conferma che gli estrogeni favoriscono l’assorbimento del calcio non solo attraverso la mediazione della vitamina D ma anche attraverso un meccanismo diretto.
- mancata inibizione della secrezione delle interleuchine IL-I, IL-6 e IL-11 e del TNF-β, tutti fattori favorenti l’osteoclastogenesi.
- diminuito riassorbimento tubulare del calcio e dei fosfati
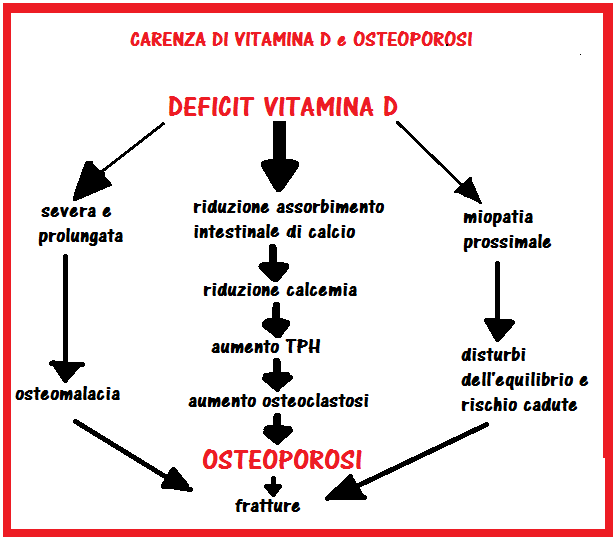
B) Deficit di vitamina D:
un deficit prolungato e severo determina demineralizzazione nelle ossa altrimenti normali; nei bambini è definito meglio come rachitismo. Il deficit di vitamina D determina diminuito assorbimento intestinale e ipocalcemia e di conseguenza aumento dell’osteoclastosi attivata dal TPH e osteoporosi.
C) Iperparatiroidismo primario o secondario: Il paratormone (PTH) stimola l’osteoclastogenesi in maniera indiretta, agendo cioè sugli osteoblasti. Questi ultimi sotto l’influenza del PTH secernono una citochina, la M-CSF dotata di azione attivante la trasformazione dei monociti in osteoclasti. I monociti possiedono un recettore specifico per la M-CSF, il recettore c-fms. Inoltre. sempre sotto stimolazione da parte del PTH, gli osteoblasti secernono una proteina chiamata RANK-L (RANK-ligando), per la quale i monociti possiedono il recettore specifico RANK. La RANK-L interagisce con i monociti, inducendoli a differenziarsi in osteoclasti. Infine gli osteoblasti per mitigare l’azione di RANK-L secernono, con l’aiuto dell’estradiolo, un finto recettore solubile, chiamato osteoprotegerina (OPG), che legandosi a RANKL, ne impedisce l’interazione con il corretto recettore (RANK) presente, come detto, sulla superficie dei monocitii. L’iperproduzione di PTH rompe l’equilibrio fra la produzione di RANKL, M-CSF e OPG.
- Fattori genetici
- familiarità
- Razza bianca o asiatica
- Menopausa precoce (<45 anni)
- Menarca tardivo (>16 anni)
- Nulliparità
- Amenorrea secondaria prolungata
- Iatrogena: corticosteroidi, anticonvulsivanti. Pazienti in terapia per asma, artrite reumatoide, orticaria cronica, molte immunopatie, trapianti, lupus, polimialgia reumatica, sarcoidosi, linfoma di Hodgkin, miastenia gravis.
- Sindrome da PTH ectopico (neoplasie)
- Magrezza costituzionale, basso BMI (<20)
- Scarsa esposizione al sole
- Stile di vita: scarso movimento, fumo, caffè, insufficiente apporto di calcio
- Stress meccanico: l’applicazione di protesi meccaniche inserite all’interno dell’osso può provocare flogosi croniche e queste, anche se apirogene, possono indurre apoptosi degli osteoblasti, attivazione degli osteoclasti e osteoporosi.
DIAGNOSI di OSTEOPOROSI:
A) Anamnesi ed esame clinico sistematico.
B) SINTOMATOLOGIA: L’osteopororosi spesso avanza silenziosamente; la sintomatologia dolorosa inizialmente è rara ed interessa quasi sempre il rachide e si riduce con il riposo a letto. L’osteoporosi  del rachide provoca collasso vertebrale e si manifesta con diminuzione di altezza e aumento della cifosi dorsale con proiezione del capo e delle spalle in avanti (stooped posture). Assenza di sintomatologia dolorosa fino a che non si verifichino fratture spontanee. In tal caso il dolore può essere brusco ed intenso tanto da determinare una importante limitazione funzionale, dopo un trauma od uno sforzo di minima entità (sollevare pesi, chinarsi). La sede più spesso riferita è il rachide al tratto dorso lombare e la causa del dolore sono le fratture o microfratture vertebrali. Tale dolore può essere molto intenso e rendere difficile i movimenti della colonna. Può durare anche alcuni mesi ed è alleviato, in parte, dal riposo a letto. Successivamente può permanere un dolore di minore intensità legato al sovraccarico di alcune strutture osteoarticolari (legamenti, dischi intervertebrali) ed alla distensione o contrattura delle componenti muscolari. Con il tempo, ed in caso di ripetuti episodi fratturativi si accentua la curvatura del dorso (cifosi dorsale) che comporta una modifica della gabbia ossea toracica con ridotta espansione toracica e quindi possibili disturbi respiratori. Si assiste ad un progressivo calo della statura e, per riduzione di altezza della cavità addominale, l’addome può apparire globoso e protruso con conseguenze sulla canalizzazione intestinale con ernia iatale, dispepsia, rigurgiti, stipsi. È importante ricordare tuttavia che le fratture vertebrali sono eventi ampiamente sottostimati. Questo accade perché da una parte la maggioranza delle deformità vertebrali in corso di osteoporosi non comportano una sicura emergenza sul piano dei sintomi e dall’altra è possibile che molte fratture vertebrali, che comportano dolore, possano sfuggire ad una diagnosi corretta e venir confuse con affezioni dolorose come la spondiloartrosi o patologie miofasciali.
del rachide provoca collasso vertebrale e si manifesta con diminuzione di altezza e aumento della cifosi dorsale con proiezione del capo e delle spalle in avanti (stooped posture). Assenza di sintomatologia dolorosa fino a che non si verifichino fratture spontanee. In tal caso il dolore può essere brusco ed intenso tanto da determinare una importante limitazione funzionale, dopo un trauma od uno sforzo di minima entità (sollevare pesi, chinarsi). La sede più spesso riferita è il rachide al tratto dorso lombare e la causa del dolore sono le fratture o microfratture vertebrali. Tale dolore può essere molto intenso e rendere difficile i movimenti della colonna. Può durare anche alcuni mesi ed è alleviato, in parte, dal riposo a letto. Successivamente può permanere un dolore di minore intensità legato al sovraccarico di alcune strutture osteoarticolari (legamenti, dischi intervertebrali) ed alla distensione o contrattura delle componenti muscolari. Con il tempo, ed in caso di ripetuti episodi fratturativi si accentua la curvatura del dorso (cifosi dorsale) che comporta una modifica della gabbia ossea toracica con ridotta espansione toracica e quindi possibili disturbi respiratori. Si assiste ad un progressivo calo della statura e, per riduzione di altezza della cavità addominale, l’addome può apparire globoso e protruso con conseguenze sulla canalizzazione intestinale con ernia iatale, dispepsia, rigurgiti, stipsi. È importante ricordare tuttavia che le fratture vertebrali sono eventi ampiamente sottostimati. Questo accade perché da una parte la maggioranza delle deformità vertebrali in corso di osteoporosi non comportano una sicura emergenza sul piano dei sintomi e dall’altra è possibile che molte fratture vertebrali, che comportano dolore, possano sfuggire ad una diagnosi corretta e venir confuse con affezioni dolorose come la spondiloartrosi o patologie miofasciali.
C) Diagnostica strumentale: In pratica si utilizza la DEXA o gli Ultrasuoni
1° Radiografia convenzionale: non evidenzia alcuna rarefazione ossea  se quest’ultima non supera il 30%. Nella fase avanzata l’esame radiologico mostra una diffusa radiotrasparenza delle strutture ossee, particolarmente evidente a livello delle vertebre, oltre all’eventuale presenza di fratture,
se quest’ultima non supera il 30%. Nella fase avanzata l’esame radiologico mostra una diffusa radiotrasparenza delle strutture ossee, particolarmente evidente a livello delle vertebre, oltre all’eventuale presenza di fratture,
2° ISTOMORFOMETRIA: effettuata su carote di osso prelevato dalla cresta iliaca. Permette la misurazione della quantità di osso mineralizzato sia corticale che trabecolare, la quantità relativa di tessuto osteoide e la velocità di neoapposizione e riassorbimento osseo. Con tale tecnica si è riscontrata una notevole eterogeneicità dell’osteoporosi. E’ una metodica cruenta e non facilmente ripetibile.
3° MINERALOMETRIA OSSEA COMPUTERIZZATA (MOC): può essere effettuata con varie metodiche; al momento quella più diffusa ed attendibile è la DEXA, una tecnica che consiste nel misurare l’assorbimento osseo di RAGGI X detta anche DEXA (Dual Emission X-ray Absorptiometry): si basa sull’attenuazione di uno o due fasci fotonici emessi da una sorgente radioattiva quando incontrano il tessuto osseo. Si applica a livello del rachide lombare (spondili L2-L4), del femore prossimale (triangolo di Ward a livello del collo del femore), dell’anca, dell’avambraccio e dell’intero scheletro. Nei primi studi, la massa ossea  veniva misurata a livello del carpo o del polso; questi distretti sono composti prevalentemente da osso a struttura corticale compatta. E’ un’indagine certamente affidabile ma si limita a fotografare la situazione attuale dei diversi segmenti ossei senza informarci della velocità della perdita di sostanza ossea per anno. Ciò ostacola un’efficace azione preventiva. Inoltre necessita di un’attrezzatura costosa e utilizza pur sempre radiazioni. La densitometria ossea ha una discreta specificità, per cui il rischio di frattura è senza dubbio elevato in pazienti con bassi valori di BMD. La densità ossea (BMD, Bone Mineral Density) viene misurata come valore assoluto (g/cm2 o g/cm3) e come T- o Z-score, dove per T-score si intende il numero di deviazioni standard dal valore medio di soggetti giovani, al picco di massa ossea (circa 30 anni), mentre lo Z score fa riferimento al numero delle deviazioni standard dal valore medio del soggetto di pari sesso ed età. L’O.M.S. ha definito come osteoporosi il valore di T-score <2,5 SD, valore che identifica come osteoporotiche il 15-20 % delle donne in
veniva misurata a livello del carpo o del polso; questi distretti sono composti prevalentemente da osso a struttura corticale compatta. E’ un’indagine certamente affidabile ma si limita a fotografare la situazione attuale dei diversi segmenti ossei senza informarci della velocità della perdita di sostanza ossea per anno. Ciò ostacola un’efficace azione preventiva. Inoltre necessita di un’attrezzatura costosa e utilizza pur sempre radiazioni. La densitometria ossea ha una discreta specificità, per cui il rischio di frattura è senza dubbio elevato in pazienti con bassi valori di BMD. La densità ossea (BMD, Bone Mineral Density) viene misurata come valore assoluto (g/cm2 o g/cm3) e come T- o Z-score, dove per T-score si intende il numero di deviazioni standard dal valore medio di soggetti giovani, al picco di massa ossea (circa 30 anni), mentre lo Z score fa riferimento al numero delle deviazioni standard dal valore medio del soggetto di pari sesso ed età. L’O.M.S. ha definito come osteoporosi il valore di T-score <2,5 SD, valore che identifica come osteoporotiche il 15-20 % delle donne in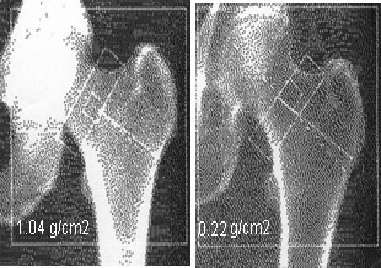 menopausa di età superiore ai 50 anni. Secondo la Consensus Conference del 1994 la Organizzazione Mondiale della Sanità ha definito i seguenti criteri diagnostici della malattia in base ai valori densitometrici:
menopausa di età superiore ai 50 anni. Secondo la Consensus Conference del 1994 la Organizzazione Mondiale della Sanità ha definito i seguenti criteri diagnostici della malattia in base ai valori densitometrici:
• Normale se T score -1 o maggiore
• osteopenia se T score compreso tra -1 e -2.5
• osteoporosi se T score minore di -2.5
• osteoporosi severa se T score minore di -2.5 + frattura.
La misurazione densitometrica della colonna lombare è preferita nel primo periodo della età post-menopausale perché è un sito precocemente interessato dalla malattia. L’accuratezza della misurazione si riduce in presenza di artrosi e di calcificazioni extrascheletriche. Per questo la densitometria femorale in età senile può essere più accurata e clinicamente più utile perché la più predittiva del rischio di frattura più temuto.
4° USG: L’indagine è effettuata sulle metafisi distali delle falangi prossimali delle dita lunghe, sul calcagno e sulla tibia perché esse presentano lo stesso turnover osseo delle vertebre e quindi le loro alterazioni possono essere considerate come rappresentative dell’intero sistema scheletrico (1). Le caratteristiche essenziali della ultrasonografia ossea sono l’assenza di radiazioni, la facilità di esecuzione dell’esame, la compliance della paziente ed il basso costo. Inoltre l’USG, oltre a fornire dati affidabili sulla BMD fornisce dati anche sulla struttura ossea. Molto interesse per questo tipo di tecnica è derivato dalla possibilità di ottenere informazioni anche sulla struttura ossea. Per quanto riguarda le correlazioni tra parametri ultrasonografici e tradizionali metodiche densitometriche radiografiche, pur risultando sempre significative, i risultati non hanno mai raggiunto valori elevati, ad indicare probabilmente che l’ultrasonografia esprime caratteristiche diverse dell’osso. E stato tuttavia ampiamente dimostrato che i parametri ultrasonografici sono in grado di predire in modo indipendente dalla BMD il rischio di frattura osteoporotica sia vertebrale che femorale nella popolazione femminile, anche se in misura inferiore rispetto alle tradizionali metodiche densitometriche, e come l’uso combinato di tecniche densitometriche e ultrasonografiche possa aumentare la predizione del rischio di frattura (5-9).
5° ATTIVAZIONE NEUTRONICA: è attualmente limitata solo a scopo di ricerca e studio per la notevole irradiazione a cui è sottoposto l’intero organismo ed in particolare il midollo osseo. Essa consiste nell’utilizzo di una sorgente neutronica ad alta energia, che attiva tutto il calcio presente nell’organismo trasformandolo da Ca48 in Ca49. La radioattività emessa in seguito al ritorno successivo del Ca49 a Ca48 viene misurata con un gamma counter e dà un’idea del calcio corporeo totale.
D) DIAGNOSTICA DI LABORATORIO:
- Ca++ (v.n. 9.4-10.4 mg/dl)
- Creatininemia
- Ormone paratiroideo (PTH)
- 1,25-OH-vitamina D
- Fosfatasi alcalina specifica ossea tartrato-resistente (indicatore di attività osteoblastica (la fosfatasi alcalina dosata di routine è prodotta da fegato e ossa per l’80%).
- Fosfatasi acida tartrato: prodotta dagli osteoclasti ma anche da processi emolitici.
- Osteocalcina sierica
- Idrossiprolina urinaria (marcatore dell’attività osteoclastica), ma si libera anche durante la neoformazione ossea. Può essere assunta con la dieta (alimenti di origine animale).
- N-telopeptide urinario (NTx)
- Calciuria
- Marcatori bioumorali specifici del turnover osseo:
a) Calcitonina plasmatica (marcatore dell’attività osteoclastica)
b) Estrogeni plasmatici (fanno aumentare la sintesi di calcitonina ed inibiscono la secrezione di IL-1 da parte dei monociti)
c) IL-1, IL-6 e IL-11: sono potenti stimolatori del riassorbimento osseo (2).
TERAPIA:
- Estrogeni: Sono i classici farmaci usati – in genere associati o alternati ciclicamente ai progestinici – nella terapia ormonale sostitutiva post-menopausale. Il ricorso alla HRT, come detto, è giustificabile solo per l’osteoporosi femminile in menopausa. Agiscono sull’osso riducendo il riassorbimento di calcio e determinando una stabilizzazione dei livelli di massa ossea; a livello vertebrale inoltre sembra indurre anche un modesto aumento della massa ossea. Questo riduce significativamente il rischio di fratture, in particolare delle vertebre. In genere la terapia viene iniziata subito dopo l’entrata in menopausa e deve essere continuata per almeno qualche anno. I suoi effetti continuano per tutta la sua durata. Gli estrogeni proteggono non solo l’osso, ma riducono anche i tumori intestinali, ma a livello uterino determinano un aumento del rischio di ca. endometriale.
- Bifosfonati (Ac. Alendronico: Adronat® cpr 70 mg, Fosamax® cpr 70 mg; Zometa® 1 fl 5 ml ev 4 mg) – per la prevenzione dell’osteoporosi: 10 mg/die oppure 70 mg/die da assumere con un bicchiere di acqua al mattino ad assoluto digiuno; mantenere la posizione eretta e digiuno per almeno 30 minuti. I bifosfonati vanno a depositarsi sui cristalli di idrossiapatite rallentando sia la crescita che il dissolvimento delle ossa. Impediscono l’adesione degli osteoclasti alla superficie ossea e inducono apoptosi degli stessi osteoclasti. Sono impiegati anche nella m. di Paget e nell’ipercalcemia neoplastica. Effetti indesiderati dei bifosfonati sono esofagiti più o meno gravi e disturbi dell’apparato digestivo in genere. Da alcuni anni è stata segnalata una rara anche se potenzialmente grave complicanza dell’uso dei bifosfonati, la cosiddetta osteonecrosi della mandibola. (11-13) ZOMETA® è il nome comune commerciale per l’Italia di un medicinale che contiene il principio attivo l’Acido Zoledronico, ed è disponibile in polvere e solvente per infusione endovenosa (1 fl ev/anno).
- Calcitonina: molto usato negli anni ’80; oggi è stato quasi del tutto abbandonato. Ormone polipeptIdico prodotto dalle cellule C dela tiroide. Meccanismo di azione antiriassorbitiva della calcitonina di salmone: inibisce l’attività degli osteoclasti già differenziati; antagonizza la fusione e la differenziazione dei precursori osteoclastici; riduce i livelli sierici di interleukina I che induce il riassorbimento osseo. L’effetto dell’ormone sulla massa ossea può essere entro certi limiti dose-dipendente. Dopo 12-18 mesi circa di somministrazione continua compare una resistenza al trattamento. La resistenza non è dovuta alla comparsa di anticorpi, ma alla comparsa di una ridotta sensibilità dei recettori alla calcitonina (down regulation). Per evitare la comparsa del fenomeno della resistenza è opportuno effettuare la terapia a cicli di tre mesi con altrettanti di intervallo. La via di somministrazione parenterale può provocare vampate di calore (hot-flushing) e anche nausea e vomito; Con l’impiego dello spray nasale si è osservata una netta riduzione degli effetti collaterali. Posologia: 100 U/die in una sola narice.
- Calcio (Tonacal D3®, Rock D3® cpr masticabili: una compressa contiene Calcio 500 mg + Vit D3 800 UI (20 μg) + Vitamina K 45 μg): riduce la perdita di massa ossea totale con effetti benefici sia gli arti inferiori che sulla colonna vertebrale. Nessun effetto collaterale importante tranne la stipsi. E’ opportuno somministrarlo a sera e durante i pasti per aumentarne l’assorbimento.
- Vitamina D3 o Colecalciferolo (Rocaltrol® cpr, Difix® cpr 0,25 e 0.50 µg): Aumenta l’assorbimento intestinale del calcio e favorisce la mineralizzazione dell’osso. L’80% del fabbisogno di vitamina D è garantita dall’irradiazione solare. Pochi alimenti contengono quantità apprezzabili di vitamina D concentrata soprattutto nei grassi animali. Un alimento particolarmente ricco è l’olio di fegato di merluzzo. Seguono, poi, i pesci grassi (come i salmoni e le aringhe), il latte ed i suoi derivati, le uova, il fegato e le verdure colorate. Reuterin D3 cpr (Vitamina D3 + fermenti lattici attivi)

- SERMs (Modulatori Selettivi dei Recettori Estrogenici): Raloxifene (Optruma® cpr; Evista® cpr 60 mg, 120 mg) e Bazedoxifene (Conbriza® cpr 20 mg): hanno un’azione estrogenica e progestinica e lievemente androgenica. Svolgono un’azione protettiva estrogenica su scheletro e sistema cardiocircolatorio ed azione antiestrogenica su endometrio e mammella. Associati con preparati a base di calcio, i SERMs permettono di aumentare la mineralizzazione ossea (bone mineral density) (14-41).
- PTH: L’ormone paratiroideo (o paratormone, spesso abbreviato PTH) è l’ormone normalmente secreto dalle ghiandole paratiroidi in risposta a uno stato di ipocalcemia (concentrazione troppo bassa di calcio nel sangue). È il più potente stimolatore del riassorbimento osseo da parte degli osteoclasti, e permette una rapida mobilizzazione di calcio dallo scheletro, riportando rapidamente la calcemia a livelli normali (effetto ipercalcemizzante). Ovviamente, un eccesso di secrezione di PTH per qualunque causa (iperparatiroidismo) porta a un eccesso di riassorbimento osseo e a una perdita di massa ossea.
Da alcuni anni, la ricerca scientifica ha dimostrato che nel nostro organismo, in condizioni normali, a ogni stimolazione del riassorbimento osseo, corrisponde una risposta di “neodeposizione” di osso da parte degli osteoblasti, e per questo motivo il paratormone – dopo lunghi studi – è stato introdotto nella terapia dell’osteoporosi. Si è infatti visto che, usato una volta al giorno per periodi limitati, esso può ottenere un risultato che gli altri farmaci anti-osteoporosi non sono in grado di dare: un recupero di massa ossea attraverso lo stimolo alla neoformazione. Ovviamente, a causa dei suoi possibili effetti “a doppio taglio”, è un farmaco da usare con cautela, solo da parte di specialisti esperti, con regolari controlli del metabolismo osseo.
Oggi in Italia è disponibile solo il “frammento attivo” della molecola del paratormone (chiamato “teriparatide” e commercializzato con il nome di Forsteo®). frammento dell’ormone paratiroideo (in sperimentazione): hPT (1-31) NH2; a differenza dell’ormone completo è dotato solo di un effetto osteosintetico. Da somministrare in modo intermittente. Si usa per iniezione sottocutanea, una volta al giorno, con una speciale penna-siringa, a cicli di 6 mesi (ripetibili al massimo per 4 volte, cioè 24 mesi). A causa della delicatezza del suo uso,è prescrivile solo da parte di Centri specialistici autorizzati dalle varie Regioni o Province autonome, su piano terapeutico. - Sali di stronzio (Protelos®, Osseor® bustine 20 mg): una bustina al dì lontano dai pasti, preferibilmente a sera 2 ore dopo cena.
- Sali di fluoro: Stimolano la neoformazione ossea aumentando il reclutamento e differenziazione degli osteoblasti. Dovrebbero sempre essere somministrati con Calcio e vitamina D. Possono causare gastrite e lower extremity pain syndrome.
- Ipriflavone (Iprosten® cpr 200 mg): inibitore del riassorbimento osseo, utilizzabile, come alternativa o in combinazione con la terapia ormonale sostitutiva, nell’osteoporosi. Previene la perdita ossea menopausale e sembra efficace nel ridurre le fratture vertebrali del 50%.
-
Deflazacort (Deflan® cpr 6 o 30 mg Guidotti) è un nuovo corticosteroide di sintesi privo dell’effetto osteopenico.
-
Denosumab: Prolia® siringa preriempita da 60 mg somministrata una volta ogni 6 mesi, come singola iniezione sottocutanea.
Anticorpo monoclonale, della classe IgG2, interamente umano indicato per la prevenzione delle fratture ossee in post-menopausa. Agisce per competizione recettoriale con i recettori RANK annullando la stimolazione osteoclastica. La Food and Drug Administration (FDA) nel 2019 ha approvato -
Evenity® (romosozumab) Anticorpo monoclonale che blocca gli effetti della sclerostina, una proteina prodotta dagli osteociti, che frena l’attività degli osteoblasti. Si tratta del primo e unico agente osseo con un effetto duale che aumenta la formazione ossea e, in misura minore, riduce il riassorbimento osseo (o la perdita ossea) per ridurre rapidamente il rischio di frattura. Una dose di romosozumab consiste in due iniezioni, una immediatamente successiva all’altra, somministrate una volta al mese da un operatore sanitario. L’effetto di formazione ossea diminuisce dopo 12 dosi, per cui non si devono usare più di 12 dosi. Poiché l’osteoporosi è una malattia cronica, una volta completata la terapia con romosozumab si dovrebbe considerare la possibilità di proseguire la terapia con un agente antiriassorbitivo. Black box warning: il farmaco può aumentare il rischio di infarto, ictus e morte cardiovascolare e non deve essere utilizzato in pazienti che hanno avuto un attacco cardiaco o un ictus nell’anno precedente. Costerà 1.825 dollari al mese o 21.900 dollari per un trattamento completo di 12 mesi.
MISURE TERAPEUTICHE COMPLEMENTARI

- Abolizione del fumo: il fumo anticipa la menopausa anche di 2 anni perché riduce la steroidogenesi ovarica e quindi la concentrazione sierica di estrogeni.
- Dieta iposodica, ipocalorica, ricca di verdure. aumentare l’assunzione di rucola (300 mg di calcio in 100 gr di alimento), verza (150 mg di calcio in 100 gr di verza), cavolo riccio (140/100), cavolo cappuccio e cime di rapa (100/100), broccoli (50/100), cipolle (20 mg/100 gr), fagioli e ceci (140/100), spremuta d’arancia (40/100), carciofi, crescione, lenticchie. Le verdure, oltre all’apporto di fibre e minerali, sono ricche di calcio e sostanze a pH basico. Aumentare, con moderazione, l’assunzione di tofu (derivato dal latte di soya, contiene 350 mg di calcio in 100 gr di tale formaggio), latte scremato, yogurt magro e formaggi ligt. L’uso eccessivo di formaggi e latticini produce un ambiente acido a livello del circolo renale con necessità da parte del rene di attingere alle riserve di calcio per equilibrare tale acidità: un paradosso in negativo della dieta latteo-casearia.
- Erbe e aromi: li usiamo tutti i giorni per rendere più saporita la nostra cucina, senza sospettare che contengono enormi quantità di calcio: la santoreggia ne contiene 2132 mg, la maggiorana 1990 mg, il timo 1890 mg, la salvia 1652 mg, l’origano 1576 mg, la menta 1488 mg, il rosmarino 1280 mg, i semi di finocchio 1196 mg, l’alloro 834 mg, solo per citare i più ricchi e comunemente utilizzati! Un motivo in più per utilizzarli ad ogni pasto, considerando che rendono anche più digeribili e gustosi legumi e cereali, oltre ad avere numerose proprietà salutari.
- Riduzione di caffè, cioccolato, cibi piccanti ed alcool
Fisiokinesiterapia specifica e maggiore attività fisica (molto raccomandate le lunghe passeggiate), massaggi, yoga e meditazione. L’attività fisica rinforza il metabolismo attivo delle ossa mentre tutte le altre pratiche menzionate fanno liberare endorfine che determinano un senso di benessere.
Life style – Tra i fattori legati allo stile di vita il più importante nel determinare la densità ossea è l’esercizio fisico. Innanzitutto, una regolare attività fisica che comporti sia lavoro dell’osso contro la forza di gravità, sia contrazione muscolare è fondamentale per la salute dell’osso, come è stato dimostrato dall’osteopenia degli astronauti dopo  una prolungata assenza di peso. L’attività fisica regolare ha numerosi effetti positivi per individui di tutte le età, ma l’impatto più significativo si ha se cominciata prima della pubertà. Uno studio ha addirittura dimostrato un effetto più marcato dell’esercizio fisico rispetto all’assunzione di calcio sullo sviluppo della massa ossea in pubertà, ma diversi studi concordano nel sostenere un loro effetto additivo. Anche se l’esercizio fisico non fa direttamente aumentare la massa ossea negli adulti, vari studi dimostrano che le persone che lo praticano regolarmente (passeggiate, corse, ballo, giardinaggio) hanno un rischio dimezzato di frattura di femore rispetto a persone poco attive.
una prolungata assenza di peso. L’attività fisica regolare ha numerosi effetti positivi per individui di tutte le età, ma l’impatto più significativo si ha se cominciata prima della pubertà. Uno studio ha addirittura dimostrato un effetto più marcato dell’esercizio fisico rispetto all’assunzione di calcio sullo sviluppo della massa ossea in pubertà, ma diversi studi concordano nel sostenere un loro effetto additivo. Anche se l’esercizio fisico non fa direttamente aumentare la massa ossea negli adulti, vari studi dimostrano che le persone che lo praticano regolarmente (passeggiate, corse, ballo, giardinaggio) hanno un rischio dimezzato di frattura di femore rispetto a persone poco attive.
BIBLIOGRAFIA:
-
Chen D, Ahao M, Mundy GR: “Bone morphogenetic proteins”. Growth Factors. 2004 Dec;22(4):233-41.
-
Chen D, Zhao M, Harris SE, Mi Z.; “Signal transduction and biological functions of bone morphogenetic proteins”. Front Biosci. 2004 Jan 1; 9:349-58. Epub 2004 Jan 1.
- B. Bianco, M. D’Aniello e V. trotta: “Screening dell’osteoporosi: tecniche a confronto”. Giorn. It. Ost. Gin. N. 4/1997.
- Pfeilschfter J et al.: “Interleukin 1 and Tumor Necrosis Factor stimulate the formation of human osteoclast-like cells in vitro”. J. Bone Min. Res. 4:113,1989.
- Njeh CF, Boivin CM, Langton CM. The role of ultrasound in the assessment of osteoporosis: a review. Osteoporos Int. 1997;7(1):7-22.
- The utility of dual-energy X-ray absorptiometry, calcaneal quantitative ultrasound, and fracture risk indices (FRAX® and Osteoporosis Risk Assessment Instrument) for the identification of women with distal forearm or hip fractures: A pilot study.
Esmaeilzadeh S, Cesme F, Oral A, Yaliman A, Sindel D.Endocr Res. 2016 Aug; 41(3):248-60. Epub 2016 Feb 11.
- Does the combination of quantitative ultrasound and dual-energy X-ray absorptiometry improve fracture discrimination? Frost ML, Blake GM, Fogelman I.Osteoporos Int. 2001; 12(6):471-7.
- Quantitative ultrasound and bone health. Knapp KM.Salud Publica Mex. 2009; 51 Suppl 1:S18-24.
- The role of quantitative ultrasound in the assessment of bone: a review. Prins SH, Jørgensen HL, Jørgensen LV, Hassager C.Clin Physiol. 1998 Jan; 18(1):3-17. J Osteoporos. 2011;2011:810697.
- Bilateral femoral insufficiency fractures likely related to long-term alendronate therapy. Gudena R, Werle J, Johnston K.
-
Gudena R, Werle J, Johnston K.Bilateral femoral insufficiency fractures likely related to long-term alendronate therapy.J Osteoporos. 2011;2011:810697. Epub 2011 May 5.
-
Choi A, Gang H, Whang J, Gwak H.Pharmacokinetic characteristics of formulated alendronate transdermal delivery systems in rats and humans. Drug Deliv. 2010 May;17(4):249-54.
-
Cheng A, Mavrokokki A, Carter G, Stein B, Fazzalari NL, Wilson DF, Goss AN.The dental implications of bisphosphonates and bone disease.Aust Dent J. 2005 Dec;50(4 Suppl 2):S4-13.
- British national formulary, Guida all’uso dei farmaci 4 edizione, Lavis, agenzia italiana del farmaco, 2007.
-
Nelson ER, Wardell SE, McDonnell DP. The molecular mechanisms underlying the pharmacological actions of estrogens, SERMs and oxysterols: implications for the treatment and prevention of osteoporosis. Bone. 2013;53:42–50.
-
Paterni I, Granchi C, Katzenellenbogen JA, Minutolo F. Estrogen receptors alpha (ERα) and beta (ERβ): subtype-selective ligands and clinical potential. Steroids. 2014;90:13–29.
- Palacios S.: Modulatori selettivi dei recettori degli estrogeni: il futuro nel trattamento della menopausa. Minerva Ginecologica 2011 June;63(3):275-86.
- Johnson SR. Menopause and hormone replacement therapy. Med Clin North Am. 1998;82:297–320.
- Archer DF. The gynecologic effects of lasofoxifene, an estrogen agonist/antagonist, in postmenopausal women. Menopause. 2011;18:6–7.
- Silverman SL, Chines AA, Kendler DL, et al. Sustained efficacy and safety of bazedoxifene in preventing fractures in postmenopausal women with osteoporosis: results of a 5-year, randomized, placebocontrolled study. Osteoporos Int. 2012;23:351–363.
- Nelson ER, Wardell SE, McDonnell DP. The molecular mechanisms underlying the pharmacological actions of estrogens, SERMs and oxysterols: implications for the treatment and prevention of osteoporosis. Bone. 2013;53:42–50.
- Paterni I, Granchi C, Katzenellenbogen JA, Minutolo F. Estrogen receptors alpha (ERα) and beta (ERβ): subtype-selective ligands and clinical potential. Steroids. 2014;90:13–29.
- Boonen S, Ferrari S, Miller PD, et al. Postmenopausal osteoporosis treatment with antiresorptives: effects of discontinuation or long-term continuation on bone turnover and fracture risk: a perspective. J Bone Miner Res. 2012;27:963–974.
- Goldstein SR, Neven P, Cummings S, et al. Postmenopausal Evaluation and Risk Reduction With Lasofoxifene (PEARL) trial: 5-year gynecological outcomes. Menopause. 2011;18:17–22.
- Kaufman JM, Palacios S, Silverman S, Sutradhar S, Chines A. An evaluation of the Fracture Risk Assessment Tool (FRAX®) as an indicator of treatment efficacy: the effects of bazedoxifene and raloxifene on vertebral, nonvertebral, and all clinical fractures as a function of baseline fracture risk assessed by FRAX® Osteoporos Int. 2013;24:2561–2569.
- Maeda SS, Lazaretti-Castro M. An overview on the treatment of postmenopausal osteoporosis. Arq Bras Endocrinol Metabol. 2014;58:162–171.
- Bozovic-Spasojevic I, Azambuja E, McCaskill-Stevens W, Dinh P, Cardoso F. Chemoprevention for breast cancer. Cancer Treat Rev. 2012;38:329–339.
- Kim K, Svedbom A, Luo X, Sutradhar S, Kanis JA. Comparative cost-effectiveness of bazedoxifene and raloxifene in the treatment of postmenopausal osteoporosis in Europe, using the FRAX algorithm. Osteoporos Int. 2014;25:325–337.
- Uebelhart D, Frey D, Frey-Rindova P, Goerres G, Michel BA. Therapy of osteoporosis: bisphosphonates, SERM’s, teriparatide and strontium. Z Rheumatol. 2003;62:512–517.
- Licata AA. Bisphosphonate therapy. Am J Med Sci. 1997;313:17–22.
- 14. Huas D, Debiais F, Blotman F, et al. Compliance and treatment satisfaction of post menopausal women treated for osteoporosis: compliance with osteoporosis treatment. BMC Womens Health. 2010;10:26.
- Sambrook PN, Seeman E, Phillips SR, Ebeling PR Osteoporosis Australia; National Prescribing Service. Preventing osteoporosis: outcomes of the Australian Fracture Prevention Summit. Med J Aust. 2002;176:S1–S16.
- Girgis CM, Seibel MJ. Atypical femur fractures: a review of the evidence and its implication to clinical practice. Ther Adv Musculoskelet Dis. 2011;3:301–314.
- Cummings SR, Eckert S, Krueger KA, et al. The effect of raloxifene on risk of breast cancer in postmenopausal women: results from the MORE randomized trial. Multiple Outcomes of Raloxifene Evaluation. JAMA. 1999;281:2189–2197.
- Jacobsen SJ, Cooper C, Gottlieb MS, Goldberg J, Yahnke DP, Melton LJ., 3rd Hospitalization with vertebral fracture among the aged: a national population-based study, 1986-1989. Epidemiology. 1992;3:515–518.
- Davies GC, Huster WJ, Lu Y, Plouffe L, Jr, Lakshmanan M. Adverse events reported by postmenopausal women in controlled trials with raloxifene. Obstet Gynecol. 1999;93:558–565.
- Nayfield SG, Gorin MB. Tamoxifen-associated eye disease: a review. J Clin Oncol. 1996;14:1018–1026.
- Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst. 2005;97:1652–1662.
- Saphner T, Tormey DC, Gray R. Venous and arterial thrombosis in patients who received adjuvant therapy for breast cancer. J Clin Oncol. 1991;9:286–294.
- Messalli EM, Scaffa C. Long-term safety and efficacy of raloxifene in the prevention and treatment of postmenopausal osteoporosis: an update. Int J Womens Health. 2010;1:11–20.
- Siris ES, Pasquale MK, Wang Y, Watts NB. Estimating bisphosphonate use and fracture reduction among US women aged 45 years and older, 2001-2008. J Bone Miner Res. 2011;26:3–11.











12 commenti
I don’t even know how I ended up here, but I thought this post was great.
I do not know who you are but certainly you’re going to a famous
blogger if you are not already 😉 Cheers!
It’s really very complex in this active life to listen news on Television, so I only
use world wide web for that reason, and get the most up-to-date information.
Fascinating blog! Is your theme custom made or did you download it from somewhere?
A design like yours with a few simple tweeks would really
make my blog stand out. Please let me know where you got your
theme. Bless you
Way cool! Some extremely valid points! I appreciate you penning this article and also the rest of
the website is also very good.
Nice post. I was checking continuously this blog and I’m impressed!
Extremely useful information particularly the last part :
) I care for such information a lot. I was looking for this certain information for a
long time. Thank you and good luck.
This article presents clear idea in favor of the new
viewers of blogging, that genuinely how to
do blogging and site-building.
Keep this going please, great job!
Every weekend i used to visit this site, as i wish for enjoyment, as this this website conations genuinely good
funny stuff too.
It’s an amazing article designed for all the online
visitors; they will take advantage from it I am sure.
Hello, yup this post is in fact fastidious and I have learned lot of things
from it about blogging. thanks.
I feel that is among the such a lot vital info for me.
And i’m happy studying your article. But want
to remark on few general issues, The web site taste is wonderful, the articles is truly excellent : D.
Good job, cheers
My brother suggested I might like this website. He was totally
right. This post actually made my day. You cann’t imagine
just how much time I had spent for this information! Thanks!