Ultimo aggiornamento: 04/10/2023
indice:
Definizione, Sviluppo, Funzione, Configurazione,
Variazioni di volume della placenta
Anomalie di inserzione del cordone
Patologie di inserzione della placenta
Placenta nelle gravidanze multiple
Placenta nell’eritroblastosi fetale
Disordini vascolari della placenta
Patologie del cordone ombelicale
Patologie delle membrane fetali
Endocrinologia placentare: HPL,
***********************************
Definizione: la placenta umana é un organo che permette lo scambio gassoso e nutrizionale fra il feto e la madre nel corso della gravidanza. Insieme al cordone ombelicale e alle membrane amnio-coriali fa parte degli annessi embrio-fetali (1-3).
Classificazione: La placenta umana è di tipo discoidale, deciduale, villosa ed emocoriale (i villi sono a diretto contatto con il sangue materno).
Sviluppo: l’uovo umano viene fertilizzato nel terzo distale della tuba di Falloppio ed arriva nella cavità uterina 5 giorni dopo la fecondazione allo stadio di blastocisti. Durante la sua migrazione nella tuba l’uovo fecondato (zigote) moltiplica i suoi blastomeri e si trasforma in morula. Quest’ultima si differenzia in un cumulo cellulare interno (inner cell mass) che costituisce il disco embrionale (embrioblasto) e in uno strato cellulare periferico deputato alla nutrizione dell’embrione e perciò denominato trofoblasto.
Successivamente la morula si trasforma in blastocisti caratterizzata da una cavità centrale ripiena di liquido detta blastocele.
La blastocisti rimane sospesa nel liquido della cavità uterina per 2-3 giorni mentre si sviluppa ulteriormente: la porzione del foglietto trofoblastico prossimo alla decidua che si duplica in uno strato esterno detto sinciziotrofoblasto e in uno strato interno denominato citotrofoblasto (4).
Con la disgregazione della zona pellucida il sinciziotrofoblasto prende contatto con l’endometrio per apposizione, circa al 21° giorno del ciclo, con l’aiuto delle Matrix Metallo-proteinasi (MMP) dette anche matricine che agiscono su integrine e matrice extra-cellulare (ECM). Le  integrine sono glicoproteine transmembrana che colllegano le proteine della matrice extracellulare ai microfilamenti intracitoplasmatici costituendo un ponte che stabilizza il rapporto cellula-ECM e rende possibile la traduzione dei segnali da ECM al citoscheletro e quindi rendendo possibile un collegamento funzionale fra le cellule di un organo o tessuto. Nell’endometrio sono presenti 22 tipi di integine e le principali sono, vitronectina, fattore di Von Willebrand e osteopondina mentre nell’embrione è presente la fibronectina. La porzione extra-cellulare delle integrine è provvista di 6 siti di legame (ligandi) che si agganciano ai ligandi embrionali in un’azione sinergica ed in tal modo le integrine sono in grado di mediare, “guidare” l’adesione della blastocisti all’endometrio. (87-89).
integrine sono glicoproteine transmembrana che colllegano le proteine della matrice extracellulare ai microfilamenti intracitoplasmatici costituendo un ponte che stabilizza il rapporto cellula-ECM e rende possibile la traduzione dei segnali da ECM al citoscheletro e quindi rendendo possibile un collegamento funzionale fra le cellule di un organo o tessuto. Nell’endometrio sono presenti 22 tipi di integine e le principali sono, vitronectina, fattore di Von Willebrand e osteopondina mentre nell’embrione è presente la fibronectina. La porzione extra-cellulare delle integrine è provvista di 6 siti di legame (ligandi) che si agganciano ai ligandi embrionali in un’azione sinergica ed in tal modo le integrine sono in grado di mediare, “guidare” l’adesione della blastocisti all’endometrio. (87-89).
Per la stabilizzazione dell’annidamento occorre però ancora un altro processo: la scissione delle matrici extra-cellulari. A tale scopo i trofoblasti secernono 22 tipi di enzimi specializzati. le Matrix Metallo-Proteinase (MMP), presenti sia sulle cellule endometriali che nell’embrione. Esse scindono le matrici extra-cellulari (ECM) della decidua permettendo la penetrazione del sinciziotrofoblasto e quindi l’impianto dell’embrione. Oltre ai substrati della matrice extracellulare (ECM), le metalloproteinasi degradano anche alcune molecole cellulari di superficie ed altre proteine pericellulari. La loro attività proteolitica è controllata dagli inibitori endogeni (α-macroglobulina) e dagli inibitori tissutali delle metalloproteinasi (Tissue Inhibitors Metalloproteinases – TIMPs) (91). Le principali classi di MMP sono le Collagenasi, le gelatinasi e le Stromelisine (90-92). Le metalloproteinasi-2 e -9 (dette anche gelatinasi 2 e 9) dirigono la proteolisi peri-cellulare e inoltre stimolano l’angiogenesi: favorendo la migrazione delle cellule endoteliali e la formazione della struttura dei capillari grazie al rilascio di fattori di crescita angiogenici dalla matrice extracellulare. Inoltre sono provviste di azione opposta inibente la neoangiogenesi mediante fattori inibitori in un complesso gioco di equilibrio fondamentale nello sviluppo placentare come nello sviluppo dei processi neoplastici che includono molteplici pathways (92).
Il sinciziotrofoblasto prolifera e penetra nella parete uterina (per circa 1/3 della parete uterina), abitualmente a livello del fondo dell’utero (zona in cui il miometrio è meno tonico), più raramente sulla parete posteriore o anteriore, intorno all’8° giorno dalla fecondazione. Verso la fine della 3ª settimana, la placenta riveste il 20% dell’utero ed è una massa discoidale di tessuto spugnoso attraverso la quale avvengono tutti gli scambi tra madre ed embrione; alla fine del 5° mese ricopre il 50% dell’utero; a fase di massimo sviluppo è al 7° mese quando misura circa 15-20 cm di diametro e raggiunge i 500-600 g (1-3).
In questa fase l’endometrio, sotto lo stimolo del progesterone, è in trasformazione deciduale: diventa iperplastico e le ghiandole aumentano di numero e di volume e secernono un liquido ricco di glicogeno e lipidi che forniranno nutrimento all’eventuale impianto della blastocisti (21). A processo compiuto (25° giorno del ciclo, poco dopo l’eventuale annidamento dell’embrione) l’endometrio si presenterà con uno strato superficiale (la decidua), situata immediatamente al di sotto dell’epitelio di rivestimento dell’endometrio, ed uno strato profondo di consistenza spongiosa dovuta alle numerose ghiandole ripiene di liquido secretivo (11-16).
La decidua a sua volta si differenzia in tre tipi:
- decidua basale: situata immediatamente sotto il bottone embrionale. Parteciperà alla formazione della pars materna della placenta.
- decidua capsulare: è la porzione di decidua che ricopre l’estremo embrionale rivolto verso la cavità uterina.
- decidua parietale: porzione della decidua che ricopre la restante parte della cavità uterina.

La decidualizzazione dell’endometrio è accelerata dall’impianto e rappresenta un meccanismo di difesa materna per impedire ulteriori processi di impianto. La “finestra” per l’impianto (implantation window) è situata prima della decidualizzazione completa della mucosa e precisamente fra il 19° e il 24° giorno di un ciclo mestruale normale; dopo il 24° giorno è molto difficile che un uovo fecondato riesca ad impiantarsi in utero (11-16).
Dal 10° al 14° giorno diventano visibili i villi primari, piccoli, non vascolarizzati, formati dal sinciziotrofoblasto superficiale e dal citotrofoblasto sottostante. Questi invadono il tessuto deciduale e le arteriole spirali, che nel frattempo hanno perso la tunica muscolare; l’invasione trofoblastica determina lo stravaso del sangue materno negli spazi intervillosi creando così le lacune ematiche. Questo consente l’adeguamento circolatorio materno alla gravidanza, praticamente le arterie si aprono al flusso di sangue e riducono le proprie resistenze, come testimoniato dalla caduta degli indici di resistenza della flussimetria delle arterie uterine, progressiva nel corso della gestazione.
Successivamente i villi primari aumentano di volume e tra di essi si insinua un abbozzo di setto mesodermico proveniente dallo strato spongioso della decidua: si formano i villi secondari che si trasfomano in villi terziari caratterizzati dalla presenza di setti deciduali ben definiti che dividono i villi in gruppi di cotiledoni. I villi terziari sono costituiti da uno strato di cellule sinciziotrofoblastiche superficiali e da un sottostante strato di cellule citotrofoblastiche; lo stroma dei villi è molto scarso; i vasi sanguigni fetali (rami terminali delle arterie e vena ombelicali) sono presenti all’interno dei villi.
All’esterno i villi presentano un bordo a spazzola prominente (chorion frondosum), che gioca un ruolo chiave nei fenomeni di assorbimento dei gas di scambio e dei principi nutritivi. Ricerche eseguite con il microscopio elettronico hanno dimostrato che il bordo libero dei villi coriali presenta una serie di microvilli capaci di inglobare con i loro movimenti macromolecole proteiche o lipoproteiche. Le sostanze di peso molecolare inferiore attraversano la barriera placentare con altre modalità, che richiedono in molti casi la partecipazione attiva del villo. Mentre per alcune sostanze (acqua, elettroliti, ossigeno, anidride carbonica, urea ecc.) gli scambi tramite la placenta avvengono in entrambe le direzioni in rapporto a fattori di ordine fisico-chimico (pressione idrostatica, pressione osmotica, pressione oncotica, diversa concentrazione esistente nei due versanti ecc.), per altre intervengono meccanismi biochimici di natura enzimatica, che regolano la direzione e la velocità degli scambi stessi, e talora impediscono il passaggio di determinate sostanze dall’organismo materno a quello fetale o viceversa: così, per es., alcuni composti (come l’adrenalina e la serotonina), sebbene capaci per la loro struttura chimica di attraversare rapidamente la placenta, in effetti non riescono a raggiungere l’organismo fetale (sul quale potrebbero esplicare azioni indesiderabili) perché vengono chimicamente inattivati o demoliti da enzimi (monoaminossidasi ecc.). La placenta costituisce anche una valida barriera, che nella maggior parte dei casi protegge il feto da eventuali microrganismi presenti nel sangue della madre o da altre sostanze tossiche o incongrue; tuttavia, non riesce a impedire il passaggio di alcuni virus e degli agenti piogeni delle infezioni massive (17-20).
Dalla fine della 3a w, elementi cellulari mesodermici penetrano nei villi e formano un vero sostegno interno di tessuto connettivo. Con l’accrescersi dei villi coriali si osserva un aumento del tessuto connettivo ed una crescita dei vasi sanguigni fetali.
I villi coriali possono anche essere classificati in base alla loro funzione:
- Floating villi: questi villi galleggiano liberamente nello spazio intervilloso.
- Villi di ancoraggio: questi villi agiscono per stabilizzare l’interfaccia placentare materno-fetale.
Funzione: La placenta ha la funzione di organo fetale accessorio, che controlla molte funzioni: la respirazione metabolica, l’assorbimento di sostanze nutritive, l’escrezione dei cataboliti, la secrezione ormonale, la sintesi proteica ed enzimatica, la regolazione del circolo materno-fetale (21).
- La placenta normalmente è formata da una sola massa placentare rotonda o ovale divisa in cotiledoni multipli che si possono facilmente distinguere esaminando la faccia materna della placenta.
- presenta due superfici appiattite e un margine,
- due appendici: le membrane fetali ed il cordone ombelicale.
- Il suo peso è intorno ai 400-500 grammi, con una variabilità da 300 a 700 gr.; il 10% del peso è dovuto al contenuto di sangue materno.
- Le misure medie sono 1,5-3 cm di spessore; 12-15 x 16-20 cm di diametro.
La placenta propriamente detta è formata dai villi coriali e dal piatto amnio-coriale
- I villi coriali: sono formati da una complessa arborizzazione di vasi sanguigni fetali, coperti rispettivamente da stroma, cellule del citotroblasto e cellule del sincizio-trofoblasto. Sono presenti da 15 a 20 cotiledoni anatomici (da 4 a 6 unità funzionali), che sono nutriti da coppie di arterie e vene, ramificazioni dei vasi ombelicali.
- Piatto amnio-coriale: le membrane fetali originano dal margine della placenta, sono formate da una sottile e lucente membrana amniotica e da un chorion più spesso ed opaco; sono separate dall’utero da una sottile decidua capsulare. In caso di emissione di meconio da parte del feto, il piatto coriale assume un colorito verdastro dovuto all’impregnazione di acidi biliari presenti in elevata concentrazione nel meconio.
Una descrizione dettagliata dell’anatomia macroscopica della placenta, secondo le indicazioni dal Gruppo Italiano di Anatomia Patologica dell’Embrione, del Feto e dei loro Annessi (G.I. APEFA) e della Società Italiana di Anatomia Patologica e Citodiagnostica-Sezione Italiana della International Academy of Pathology (SIAPEC-IAP), può essere di grande aiuto per eventuali complicanze del post-partum come pure per altre patologie che possano insorgere in gravidanze successive.
STIMA DEL VOLUME PLACENTARE (EPV)
il volume placentare può essere ecograficamente misurato dalla 7a alla 36a settimana; a fine gravidanza la misurazione del volume placentare (EPV) è difficoltosa a causa dell’eccessiva larghezza di impianto della placenta. L’EPV dipende in gran parte dalla sua irrorazione, HPL e PIGF. Un ridotto volume placentare equivale a scarsa irrorazione e è predittivo di IUGR specialmente nel II° trimestre mentre nel I° trimestre si è riscontrata una stretta correlazione fra volume placentare e concentrazione sierica materna di vitamina D, proteina PAPP-A , fattore di crescita placentare (PIGF) e crescita fetale (65-82). La larghezza massima è misurata da punta a punta (giallo). L’altezza e la spessore (arancio) sono gli stessi e vengono misurati una volta per ottenere entrambi i valori. Il volume è uguale a base x spessore x altezza.
VARIAZIONI DI VOLUME DELLA PLACENTA:
Placenta voluminosa: di solito si può osservare nella sifilide congenita, nel diabete mellito e nell’eritroblastosi fetale, soprattutto quando si verifica un idrope fetale. Si può osservare in genere nelle gravidanze multiple.
Placenta piccola: la prematurità è forse la più frequente causa di placente piccole. Può anche essere una atrofia placentare con degenerazione e infarti come si osserva nella morte fetale intrauterina per gestosi ipertensiva.
ANOMALIE MORFOLOGICHE:
Le anormalità morfologiche della placenta sono da mettere in relazione al luogo definitivo di impianto dell’uovo fecondato in utero. La configurazione e la dimensione globale della placenta dipendono dalla precisa distribuzione e dallo stato di sviluppo e di funzionamento dei villi coriali. E’ stato stimato che il 20% della superficie delle vescicole coriali verrà occupata da placenta a termine, il resto dalle membrane fetali (27-30).
Placenta bi- tri- multi-partita (lobata): si tratta di una divisione incompleta della placenta in 2, 3 o più lobi (ognuno dei quali costituito da più cotiledoni). Non rappresenta alcuna patologia.
Placenta succenturiata: si tratta di una completa divisione della placenta in una massa centrale e in uno o più piccoli lobi. L’impianto basso del lobo accessorio può dar luogo a placenta previa (vasa previa). La rottura dei vasi velamentosi nel peduncolo vascolare può dar luogo ad emorragie come per i vasi previ. Infine il lobo minore spesso è abnormemente aderente e presenta difficoltà allo scollamento nel periodo del secondamento.
Placenta spuria: placenta succenturiata in cui il lobo accessorio non presenta una connessione vascolare con la massa placentare principale.
Placenta membranacea: si tratta di una condizione nella quale i villi coriali funzionanti includono il sacco amniotico nella sua interezza. Questo è il risultato di un impianto profondo con una mancata regressione del chorion laeve. Esso è evento raro ed è correlato ad un accrescimento fetale intrauterino ritardato e dal travaglio prematuro. La placenta si presenterà come una placenta previa.
Placenta fenestrata: si tratta di una placenta particolare, che si presenta con una apertura irregolare o ovale a pieno spessore dovuta ad una involuzione localizzata del corion frondosum.
Placenta circumvallata: questa placenta presenta un piatto coriale ristretto dovuto alla reduplicazione delle membrane fetali lungo il margine periferico che può essere completamente circondato. A volte l’anello di reduplicazione può essere incompleto e non ben formato. Fra i due strati di reduplicazione si riscontra fibrina e decidua degenerata.
Placenta circummarginata: il margine della placenta si proietta al di là dell’inserzione della membrane fetali, così è possibile osservare un tessuto placentare che rimane non ricoperto. Questo tipo di alterazione strutturale si riscontra frequentemente nelle placente di gemelli. Esso presenta uno scarso significato clinico.
ANOMALIE DI INSERZIONE DEL CORDONE
Inserzione velamentosa e vasa previa: il cordone ombelicale si inserisce sulle membrane fetali anziché‚ sulla placenta propriamente detta con una suddivisione dei vasi che successivamente passano per una lunghezza variabile nelle membrane fino alla placenta.
Placenta a racchetta: il cordone ombelicale è inserito sul margine laterale della placenta.
Sia l’inserzione velamentosa che la placenta a racchetta possono essere complicate da una compressione dei vasi sanguigni ombelicali da parte del feto sulle pareti pelviche durante il travaglio.
PATOLOGIE DI INSERZIONE DELLA PLACENTA:
Normalmente la placenta si distacca dalla parete uterina attraverso lo strato fibrinoide di Nitabuch situato nello strato spongioso delle decidua basale. Approssimativamente si perdono 250 cc. di sangue.
A) Distacco intempestivo di placenta
C) Placenta marginale: quando la placenta ha una posizione bassa ma non propriamente previa, si può verificare la lacerazione del seno venoso marginale nel momento in cui si verifica la rottura delle membrane fetali durante il travaglio. La lacerazione può estendersi al margine placentare dove si inseriscono le membrane fetali con il risultato di una rottura dei vasi del seno marginale.
F) GRAVIDANZE MULTIPLE (mono-poliovulare): I gemelli dizigoti hanno sempre placenta bicoriale, mentre i gemelli monozigoti possono avere
- una placenta bicoriale
- una placenta monocoriale e biamniotica,
- placenta monocoriale e monoamniotica (raramente).
Tutte queste varietà possono verificarsi nelle gravidanze gemellari monozigote e prendere forma prima che lo sviluppo placentare sia realmente cominciato, per segmentazione allo stadio di morula. Esse possono anche formarsi dopo lo sviluppo del corion ma prema della formazione della cavità amniotica oppure per divisione dell’embrione dopo che l’amnios si e formato. Le gravidanze gemellari hanno maggiori complicazioni perinatali specialmente nel caso di placente monocoriali monoamniotiche. Ci può essere tensione di uno o entrambi i cordoni ombelicali intorno alle varie parti del feto con ostruzione del flusso sanguigno. Occasionalmente si verifica l’amputazione di una estremità fetale. Nei gemelli con placente monocoriali si può riscontrare una fistola artero-venosa che mette in comunicazione e cotiledoni fetali, il sangue arterioso di un feto in tal caso rifornisce uno o più cotiledoni comuni, mentre questi sono drenati da vasi venosi verso l’altro gemello. Questo comporta che un gemello presenta policetemia e polidramnios mentre l’altro gemello presenta anemia e oligoidramnios. Nelle gravidanze gemellari è presente un’aumentata incidenza di inserzioni velamentose del cordone ombelicale, con i rischi precedentemente ricordati: si osserva che una maggiore frequenza di mancanza congenita di un’arteria ombelicale.
G) Placenta in caso di eritroblastosi fetale: L’eritroblastosi fetale può provocare un ingrandimento della placenta nei casi gravi di sensibilizzazione materna. L’idrope fetale invariabilmente presenta una placenta ingrandita che è di colorito variabile dal grigiastro al rossastro e relativamente compatta. L’esame microscopico rivela alcune divisioni irregolari nell’arborizzazione dei villi con aspetti a clava cui si associa la presenza di fibrosi e di cellule di Hofbauer (istiociti) e persistenza del citotroblasto di Langhans. I vasi sanguigni fetali possono mostrare eritrociti nucleati. Il neonato può presentare idrope, ascite, anemia grave, emopoiesi extramidollare in vari organi, splenoepatomegalia e Kernicterus (ittero nucleare) dei gangli della base e del tronco dell’encefalo. Il test di Coombs diretto eseguito nel sangue del cordone è positivo per anticorpi Rho (D) materni.
VARIAZIONI DI VOLUME DELLA PLACENTA:
Placenta voluminosa: di solito si può osservare nella sifilide congenita, nel diabete mellito e nell’eritroblastosi fetale, soprattutto quando si verifica un idrope fetale. Si può osservare in genere nelle gravidanze multiple.
Placenta piccola: la prematurità è forse la più frequente causa di placente piccole. Può anche essere una atrofia placentare con degenerazione e infarti come si osserva nella morte intrauterina per tossiemia e ipertensione cronica.
FLOGOSI PLACENTARI:
Corionite o Corionamnionite: una flogosi significativa del chorion e dell’amnios si può riscontrare, insieme ad iperpiressia materna, nella rottura prolungata delle membrane fetali. L’amnios non contiene vasi sanguigni propri e di conseguenza l’infiammazione si diffonde per continuità, secondaria alla flogosi del corion.
Funicoliti: l’infiammazione perivascolare del cordone ombelicale è di solito associata con corionite o corionamnionite ed è da mettere in relazione agli stessi agenti causali.
Sifilide congenita: la placenta è di solito ingrandita, pastoso, di colorito giallastro o grigiastro con cotiledoni friabili. L’esame microscopico mostra i villi coriali a forma di clava con arborizzazione irregolare. E’ presente fibrosi dello stroma dei villi con endoarterite: le spirochete del Treponema Pallidum possono essere evidenziate con colorazioni particolari.
DISORDINI VASCOLARI DELLA PLACENTA:
Ematoma retroplacentare: si osserva nel distacco di placenta come una raccolta ematica tra la decidua basale e la placenta. Ematoma intraplacentare: questa evenienza si verifica nella rottura del seno marginale con emorragia intraplacentare nella forma di un ematoma intraparenchimale.
Ematoma della faccia placentare fetale: da distacco delle membrane amnio-coriali dal piatto coriale.
Infarti placentari: questi hanno forma conica, sono compatti, di colore rosso, grigio o biancastro con contorni netti relativamente definiti. Essi sono causati dall’ischemia dei villi corionali, per trombosi dai vasi sanguigni fetali che penetrano nei cotiledoni fetali. Microscopicamente è presente una necrosi coagulativa dei villi con depositi intervillosi di fibrina e marcate lesioni emorragiche. Intorno all’infarto si può osservare un margine che circonda la lesione infiltrato da cellule della flogosi acuta.
Cisti placentari: cisti isolate della placenta riscontrate durante il primo trimestre di gravidanza possono essere considerate benigne e generalmente scompaiono durante il 2° trimestre (6) ma possono anche dar luogo ad emorragie intracistiche e provocare scollamento della membrana amniotica dal piatto coriale.
SENESCENZA PLACENTARE:
Nella gravidanza oltre il termine si realizza il quadro della cosiddetta senescenza placentare, che sta ad indicare il perduto optimum di funzionalità raggiunto con la maturazione (43). Ecograficamente possiamo stabilire un grading 0-3 corrispondente alle capacità funzionali placentare. Non c’è correlazione fra grading placentare e maturità polmonare (43-48) mentre c’è stretta correlazione fra senescenza placentare precoce e outcome fetale e neonatale.
Grado 0: pattern omogeneo delimitato dalla linea regolare del piatto coriale; usualmente osservabile fino alla 30a settimana di gravidanza
Grado 1: il pattern placentare è lievemente disomogeneo per la presenza di alcune piccole zone iperecogene; la linea del piatto coriale si presenta ondulato
Grado 2: presenza di aree iperecogeniche a forma di virgola (“comma-shaped”) diffuse nel parenchima placentare
Grado 3: presenza di echi francamente iperriflettenti ed irregolari da attribuire ad aree di calcificazione dei setti interlobari. Il 50% delle placente mostrano calcificazioni dalla 33a w. Lo spessore della placenta supera i 5 cm per edema e presenza di calcificazioni. E’ associato con IUGR, Ipertensione arteriosa e fumo. All’esplorazione con color-Doppler l’a. ombelicale presenta un IR superiore ai valori normali (threshold security value: 0.64) a ulteriore dimostrazione che le alterazioni del circolo placentare siano il crinale per il viraggio fra placenta fisiologicamente invecchiata a 39-41 settimane e la senescenza patologica (51-55).
Un grado 3 prima della 34a w è definito come senescenza placentare precoce ed è associata con IUGR e gestosi ipertensiva nel 50% dei casi (43,46).
Accanto alle alterazioni funzionali, sono riconoscibili quelle morfologiche,
A) ALTERAZIONI MORFOLOGICHE:
1) Degenerazione fibrinoide dei villi:
Aumento progressivo dello spessore della membrana endoteliale che mostra fenomeni di degenerazione fibrinoide. Questo fenomeno è più accentuato nelle regioni sottostanti la placca coriale, nelle quali per effetto della rarefazione dei villi, la superficie di scambio placentare è già significativamente inferiore alla superficie media di scambio di tutta la placenta. Questa alterazione, osservabile in misura ridotta nella normale placenta a termine, è particolarmente frequente ed accentuato nella placenta di gravidanza serotina; conseguentemente diminuisce notevolmente lo scambio materno-fetale.
2) Ispessimento progressivo della membrana basale, che separa il trofoblasto dall’endotelio dei capillari del villo.
3) Addensamento progressivo e calcificazione della stroma del villo, per aumento del numero e dello spessore delle fibre collagene.
4) Comparsa di gruppi di villi terminali ipovascolarizzati o del tutto avascolari.
5) Abnorme sviluppo dei bottoni sinciziali, cioè di focolai di addensamento di nuclei del sincizio che si osservano alla superficie del villo terminale. Questo fenomeno che è presente anche nella placenta matura, mentre è raro in quella immatura, è invece tipico della senescenza, e sembra dovuto al ridotto flusso ematico del villo; infatti è significativa l’associazione del reperto con trombosi di rami arteriosi dell’albero feto-placentare o con la sofferenza ischemica di vicinanza, nelle zone adiacenti agli infarti o alle placche di estesa deposizione di fibrina (44).
6) Proliferazione accentuata delle cellule di Langhans, anch’essa reattiva nei riguardi di una riduzione del flusso ematico materno diretto alla placenta.
B) ALTERAZIONI FUNZIONALI:
sono espressione di modificazioni funzionali della placenta che iniziano già alla fine del IX° mese, ma che si rendono certamente più evidenti nelle gravidanze ipermature.
1) Diminuzione della saturazione di ossigeno del feto:
E così per quanto riguarda la funzione respiratoria della placenta, è ormai sufficientemente dimostrato che nella gravidanza protratta la saturazione in ossigeno del feto diminuisce; il metabolismo respiratorio del feto risponde a questa mancanza di ossigeno con una riduzione dei suoi bisogni; da dati sperimentali risulta che il contenuto di ossigeno è di appena 8 volumi, corrispondente al 30%, alla 43a settimana (45,46).
2) Modificazione negativa del quadro ossimetrico tissutale materno:
Altre osservazioni dimostrano la necessità di una indagine emossimetrica completa, realizzata in modo da ottenere una esatta valutazione degli scambi di ossigeno tra sangue e tessuti materni. Con questa metodica è stata infatti rilevata una modificazione negativa del quadro ossimetrico tessutale nei casi di sindrome di postmaturanza.
La determinazione del coefficiente di utilizzazione tessutale e la percentuale di ossigeno materno possono rappresentare quindi un mezzo di un certo valore per la valutazione del danno fetale da gravidanza protratta (47).
ENDOCRINOLOGIA DELL’UNITA’ FETO-PLACENTARE:
fino a pochi decenni fa la placenta era considerata un organo steroidogenetico completo, cioè capace di sintetizzare gli estrogeni e il progesterone a partire da precursori semplici. Oggi si è dovuto modificare tale concetto per quanto riguarda la steroidogenesi: la placenta è soprattutto un organo di ricambio e non di produzione. Essa accumula e soprattutto modifica steroidi preesistenti in circolo, prodotti dagli organi materni e fetali, grazie alla presenza di taluni enzimi (deidrogenasi, idrossilasi, solfatasi) molto attivi in essa presenti. Esistendo poi una certa diversa distribuzione di tali enzimi tra feto e placenta, le attività steroidogenetiche risultano per così dire integrate. Nella placenta mancano quasi completamente la 17-idrossilasi e le 17-20 desmolasi mentre nel feto manca la 3-β-idrossisteroido deidrogenasi (56,57).
La placenta produce numerosi ormoni e sostanze che abitualmente riconoscono altre sedi di origine in condizione di non gravidanza. In tal modo la placenta assume funzioni molto simili all’ipotalamo, ipofisi, fegato, surrene, ovaio e corpo luteo. Queste sostanze regolano il meccanismo immunitario dell’impianto, il metabolismo e la crescita fetale, lo scambio gassoso feto-materno e la contrattilità uterina. Alcuni peptidi placentari esprimono la funzionalità placentare e soprattutto permettono di diagnosticare precocemente alterazioni funzionali prima che la patologia gravidica si manifesti.
Gn-RH: neuropeptide placentare simile a quello ipotalamico. La sua secrezione e concentrazione plasmatica aumenta parallelamente a quella dell’HCG. La secrezione di HCG è stimolata da estrogeni e attivina mentre è inibita da inibine e progesterone. L’HCG stimola la secrezione di HCG dal sinciziotrofoblasto (58,59).
Thyrotropin Releasing Hormone (TRH): prodotto dal sinciziotrofoblasto prima e dalla placenta poi durante tutta la gravidanza ed è riversato nel sangue materno ma soprattutto nel sangue fetale ed è capace di stimolare una minima quantità di TSH dall’ipofisi fetale (60,61).
Corticotropin Releasing Factor (CRF): neuropeptide simili a quello ipotalmico coinvolto nelle risposte dell’organismo allo stress, in grado di stimolare la secezione dell’adrenocorticotropin-releasing hormone (ACTH) ipofisario il quale a sua volta stimola la secrezione di cortisolo dal surrene. La placenta, la decidua e il miometrio sono in grado di sintetizzare il CRF con meccanismo sovrapponibile a quello ipotalamico. Il CRF placentare stimola le contrazioni uterine direttamente tramite i suoi recettori miometriali sia indirettamente tramite le prostaglandine, e l’ossitocina. Inoltre il CRF è in grado di indurre vasodilatazione del circolo utero-placentare tramite il pathwaydel monossido di azoto.In circolo è legato alla CRF-BP; in caso di eclampsia si riscontra una ridotta concemntrazione della CRF-BP (62,63) .
- azione trofica e iperplastica sul miometrio
- azione trofica sui dotti mammari
- azione trofica sui genitali esterni
- sui legamenti pelvici e della sinfisi pubica trasformando il tessuto connettivo da compatto in lasso
- stimolano la formazione dei recettori per l’ossitocina
- stimolano la secrezione placentare di progesterone
- Inducono ipercortisolemia aumentando la produzione delle Binding Proteins del cortisolo (CBG).
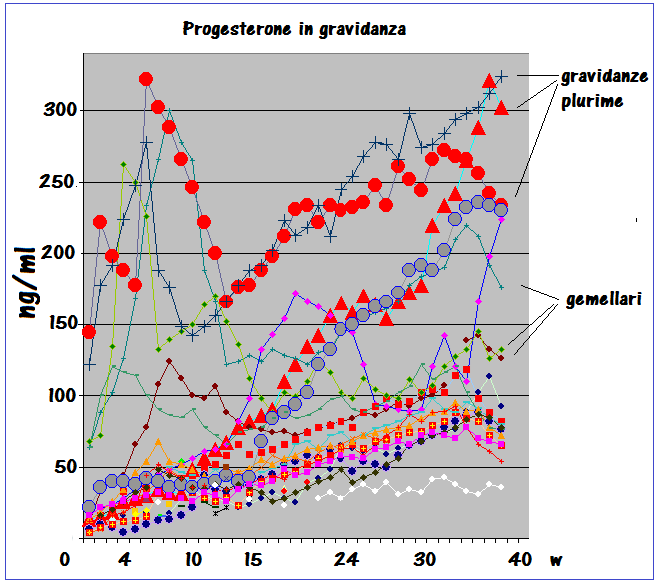
PROGESTERONE: principale ormone steroideo della gravidanza, secreto dal corpo luteo prima e dalla placenta dalla 10a settimana di gestazione quando la placenta ne diventa la maggiore fonte di produzione (69). La concentrazione plasmatica del progesterone in gravidanza presenta una curva di crescita qualitativamente simile a quella presente nel ciclo mestruale con un picco alla 10a settimana seguito da una modesta deflessione ed un secondo picco alla 34a settimana. La P450c17 non è espressa nella placenta umana e dunque il progesterone non può essere convertito a androgeni nella placenta (70-72).
Anche a livello placentare, come nell’ovaio e corpo luteo, il progesterone è sintetizzato a partire dal colesterolo che viene metabolizzato in OH-colesterolo che ad opera della desmolasi è convertito in pregnenolone nei mitocondri. Il pregnenolone è convertito in progesterone grazie all’azione degli enzimi 3-beta-idrossisteroidodeidrogenasi (3-β-HSD) e isomerasi nelle piccole cellule luteiniche e nelle cellule placentari. Tutto il procedimento è modulato dall’azione di LH e HCG.
Le funzioni principali del progesterone sono:
- stimolare la secrezione ghiandolare uterina e tubarica
- cambiare il pattern delle proteine secrete
- indurre la differenziazione stromale dell’endometrio
-
Facilitare l’impianto stimolando la sintesi di enzimi responsabili della lisi della zona pellucida e la secrezione endometriale di CRF e Attivina A
-
Indurre la proliferazione e differenziazione cellulare del prodotto gravidico nelle prime fasi di gravidanza attraverso la regolazione della sintesi dei fattori di crescita locali, l’espressione dei loro recettori specifici, la sensibilità cellulare agli effetti dei fattori di crescita
- evitare le contrazioni uterine inibendo la sintesi della prostaglandina PGF2alfa e aumentando la sintesi della prostaglandin-15-deidrogenasi in opposizione all’estradiolo; interferendo sulla capacità dell’estradiolo di indurre l’espressione di membrana di recettoriα-adrenergici; aumentando il potenziale di riposo delle cellule miometriali, prevenendo il coupling elettrico fra le cellule miometriali, inibendo l’uptake del calcio extra-cellulare e downregolando l’espressione di geni che codificano per le subunità dei canali del calcio voltaggio-dipendenti. Inoltre il progesterone inibisce l’azione dell’ossitocina.
- stimolare lo sviluppo degli alveoli mammari
- stimolare lo sviluppo delle sacche alveolari
- inibire la risposta immunitaria attraverso l’attivazione del Corticotropin-Releasing Factor (CRF)
- il progesterone è il principale substrato per la sintesi di cortisolo e aldosterone da parte del surrene fetale
- Inibisce la sintesi dei recettori per gli estrogeni .
- L’inibina è un eterodimero glicoproteico costituito da una subunità α e una sbunità β ci cui esistono due sottotipi (A e B) per cui esiste l’inibina α (α-βA) e l’inibina β (α-βB). Le inibine sono prodotte quasi esclusivamente dall’ovaio e, in gravidanza, da decidua, corpo luteo e placenta. Inibiscono la secrezione ipotalamica di di Gn-RH, la secrezione ipofisaria di FSH e LH e la secrezione del progesterone. La inibina beta deprime la secrezione di HCG da parte del sinciziotrofoblasto (16,17).
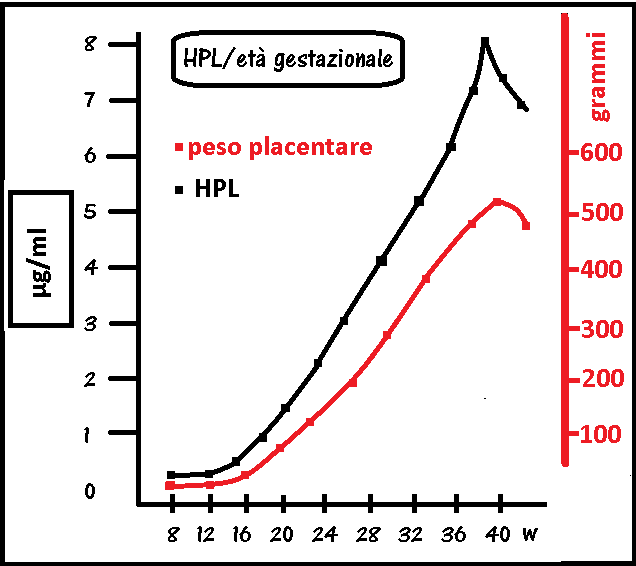
- Attivina: è secreta da organi extra-gonadali ed, in gravidanza, da decidua e dalla placenta da dove viene riversata in circolo e nel liquido amniotico. L’attivina modula positivamente la secrezione di GH-RH, la differenziazione eritrocitaria, la secrezione di HPL e la steroidogenesi placentare (75,76).
- Insulin-Like Growth Factors (IGFs) o Somatomedine: peptidi con peso molecolare, struttura ed effetti metabolici simili all’insulina, inizialmente conosciuti esclusivamente come mediatori dell’azione dell’ormone della crescita (GH o Somatotropina) che ne stimola la sintesi a livello epatico, ovarico e placentare. In circolo gli IGFs viaggiano legati alle IGF-BP (IGF-binding proteins) che ne aumentano l’emivita plasmatica (da 10 minuti a 3-4 ore).
Al contrario del GH, l’IGF-I induce una diminuzione dell’insulino-resistenza e quindi contrasta l’insorgenza del diabete tipo II e facilita l’assorbimento dei glicidi sia nel compartimento materno che soprattutto in quello fetale. IGFs sono dotati inoltre di azione anabolizzante (stimolando la proteosintesi tissutale) e perciò coinvolti nella crescita del feto e del bambino (40,,53-55) e continuano ad esercitare la loro azione metabolica nell’adulto. L’IGF-I stimola le connessioni neuronali, inibisce la morte dei neuroni e in generale produce grandi benefici ai malati di malattie neurodegenerative compresa la SLA oltre che nella terapia dell’osteoporosi, distrofia muscolare e nanismo.
I due sottotipi più noti di IGF sono l’IGF-I e IGF-II secreti dalla placenta insieme alle IGF-BP fin dalla nona settimana di gestazione. Alla secrezione di IGF-BP contribuisce anche la decidua e l’IGF-BP aumenta fino alla 12a w per rimanere poi elevata fino a termine di gravidanza probabilmente per difendere l’endometrio da un’eccessiva invasione trofoblastica. Però l’eccessiva produzione di IGF-BP è stata identificata come principale fattore eziologico del mancato impianto embrionale e della sindrome gestosica ipertensiva. La produzione locale di IGFs è molto importante perché molti effetti di questo ormone ricadono direttamente sulle cellule vicine (meccanismo paracrino). Infatti gli IGFs svolgono da subito la loro azione facilitando l’impianto e l’invasione trofoblastica, la crescita dei villi coriali e la vasodilatazione distrettuale. IGFs, HG e HPL sono i principali fattori favorenti la crescita fetale.
- Leptina: peptide prodotto dal tessuto adiposo bianco, esprime una modulazione negativa sul centro della fame in opposizione al NPY . E’ prodotto anche dalla placenta in concentrazioni correlate all’età gestazionale e al peso fetale e che risultano eccessivamente elevate in caso di pre-eclampsia (63,64). In gravidanza, come nella donna non gravida, esercita un’azione favorente la neoangiogenesi, la secrezione di FSH, TSH e GH. Gli estrogeni e il sovrappeso favoriscono la ipersecrezione della leptina . La placenta e la decidua sono provvisti di recettori specifici per la leptina (77,78)
- EGF (Epidermal Growth Factor), FGF (Fibroblast Growth Factor), NGF (Nerve Growth Factor) e il TGF (Transforming Growth Factor) sono altri fattori di crescita poco studiati ma inevitabilmente implicati nei fenomeni di crescita e proliferazione che caratterizzano la gravidanza (75,76).
Glicodelina o proteina placentare 14 (PP14) o progesterone-associated endometrial protein (PEP) o β uterin protein: è una proteina, omologa della β-lattoglobulina, è sintetizzata e secreta dalle ghiandole endometriali nella fase luteale tardiva sotto l’azione di stimolo del progesterone (63). La concentrazione di PP14 misurata sul liquido di secrezione endometriale al giorno LH + 10 o LH + 12 o nel sangue mestruale di un ciclo spontaneo erano significativamente più basse (P < 0.05) nelle pazienti con aborto ricorrente (media: 1000, range: 9-2900 ng/ml) che nelle donne che portano a termine la gravidanza (media: 1440, range: 4-12 100 ng/ml) durante una successiva gravidanza (64-66), ma non nel plasma (79). La concentrazione di glicodelina è inferiore alla norma nel plasma seminale di pazienti infertili (80,81).
Ossitocina (OT): sintetizzata dalla neuroipofisi, è ulteriormente sintetizzata da decidua, miometrio e placenta in gravidanza (68-70). Le concentrazioni plasmatiche si mantengono costanti in gravidanza e aumentano solo in travaglio avanzato di parto (82-84).
Relaxina: proteina prodotta dal corpo luteo gravidico, placenta e decidua con incremento fino alla 12a settimana di gravidanza e costante diminuzione da tale epoca. Agisce sul collagene della cervice uterina e dei ligamenti pubici facilitandone la dilatazione (85,86).
Bibliografia:
- Frank H. Netter, Atlante di anatomia umana, terza edizione, Elsevier Masson, 2007. ISBN 978-88-214-2976-7
- Anastasi G. e altri, “Trattato di anatomia umana” Edi Ermes 2006
- Testut L. et Latarjet A.: “Traitè d’anatomie humaine”. G. Doin & CIE Editeurs;1949.
- Neil M. Gude, Claire T. Roberts, Bill Kalionis, Roger G. King: “Growth and function of the normal human placenta” Thrombosis Research. Volume 114, Issues 5–6, 2004, Pages 397–407
- Xiong J, Stehle T, Diefenbach B, Zhang R, Dunker R, Scott D et al. (2001). “Crystal structure of the extracellular segment of integrin alpha Vbeta3”. Science 294 (5541): 339–45
- Sauer F, Fütterer K, Pinkner J, Dodson K, Hultgren S, Waksman G. “Structural basis of chaperone function and pilus biogenesis”. Science 285 (5430): 1058–61
- Hynes R (2002). “Integrins: bidirectional, allosteric signaling machines”. Cell 110 (6): 673–87.
- Humphries M (2000). “Integrin structure”. Biochem. Soc. Trans. 28 (4): 311–339.
- Nermut M, Green N, Eason P, Yamada S, Yamada K (December 1988). “Electron microscopy and structural model of human fibronectin receptor”. EMBO J. 7 (13): 4093–9.
- Hynes R (2002). “Integrins: bidirectional, allosteric signaling machines”. Cell 110 (6): 673–87.
- Gellersen B1, Brosens IA, Brosens JJ.: Decidualization of the human endometrium: mechanisms, functions, and clinical perspectives. Semin Reprod Med. 2007 Nov;25(6):445-53.
- Dunn CL1, Kelly RW, Critchley HO.Decidualization of the human endometrial stromal cell: an enigmatic transformation. Reprod Biomed Online. 2003 Sep;7(2):151-61.
- Florio P, Rossi M, Sigurdardottir M, Ciarmela P, Luisi S, Viganò P, Grasso D, Fiore G, Cobellis L, Di Blasio AM, et al. Paracrine regulation of endometrial function: interaction between progesterone and corticotropin-releasing factor (CRF) and activin A. Steroids. 2003 Nov; 68(10-13):801-7.
- Matsumoto H, Sakai K, Iwashita M.: “Insulin-like growth factor binding protein-1 induces decidualization of human endometrial stromal cells via alpha5beta1 integrin”. Mol Hum Reprod. 2008 Aug; 14(8):485-9. Epub 2008 Jun 26.
- Larsen, William J. : Human embryology. Sherman, Lawrence S.; Potter, S. Steven; Scott, William J. 3. ed.
- Baniţă IM, Bogdan F.: “Study of chorial villi formation and evolution”. Rom J Morphol Embryol. 1998 Jan-Dec;44(1-4):11-6.
- Castellucci M, Kosanke G, Verdenelli F, Huppertz B, Kaufmann P.: “Villous sprouting: fundamental mechanisms of human placental development”. Hum Reprod Update. 2000 Sep-Oct; 6(5):485-94.
- Castellucci M, Scheper M, Scheffen I, Celona A, Kaufmann P.: The development of the human placental villous tree. Anat Embryol (Berl). 1990; 181(2):117-28.
- Gude NM1, Roberts CT, Growth and function of the normal human placenta. Kalionis B, King RG. Thromb Res. 2004;114(5-6):397-407.
- Meyer WW, Rumpelt HJ, Yao AC, Lind J (July 1978). “Structure and closure mechanism of the human umbilical artery”. Eur. J. Pediatr. 128 (4): 247–59.
- Kiserud, T.; Acharya, G. (2004). “The fetal circulation”. Prenatal Diagnosis 24 (13): 1049–1059
- McDonald, SJ; Middleton, P; Dowswell, T; Morris, PS (Jul 11, 2013). “Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes.”. The Cochrane database of systematic reviews 7
- McDonald, S. J.; Middleton, P.; Dowswell, T.; Morris, P. S. (2013). McDonald, Susan J, ed. “Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes”. The Cochrane Library 7
- Hutton EK, Hassan ES (March 2007). “Late vs early clamping of the umbilical cord in full-term neonates: systematic review and meta-analysis of controlled trials”.JAMA 297 (11): 1241–52.
- Lal Baksh Khaskhelli, Samreen Memon, Pushpa Goswami, Shamshad Bano Change in Normal Morphology of Placenta and Its Possible Effects on Fetal Outcome in Diabetic Mothers as Compared to Non-Diabetic Mothers JLUMHS JANUARY-APRIL 2013; Vol 12: No. 01
- Desoye, G. and E. Shafrir, The human placenta in diabetic pregnancy. Diabetes Rev,1996.4:p.70-89. 2.
- Calderon, I.M., et al., Morphometric study of placental villi and vessels in women with mild hyperglycemia or gestational or overt diabetes. Diabetes Res Clin Pract, 2007. 78: p. 65-71.
- Lilja M. Infants with single umbilical artery studied in a national registry: general epidemiological characteristics. Paediatr Perinat Epidemiol 1991; 5: 27-36.
- Saller DN Jr, Keen CL, Sun CC, Schwartz S. The association of single umbilical artery with cytogenetically abnormal pregnancies.
- Clausen I. Umbilical cord anomalies and antenatal fetal demise. Obstet Gynecol Surv.1989; 44: 841-5.
- Chow JS, Benson CB, Doubilet PM. Frequency and nature of structural anomalies in fetuses with single umbilical arteries. J Ultrasound Med 1998 Dec;17(12):765-8.
- Painter D, Russell P. Four-vessel umbilical cord associated with multiple congenital anomalies. Obstet Gynecol 1977 Oct;50(4):505-7
- 20 Chiappa E, Viora E, Botta G, Abbruzzese PA, Ciriotti G, Campogrande M: “Arteriovenous fistulas of the placenta in a singleton fetus with large atrial septal defect and anomalous connection of the umbilical veins”. Ultrasound Obstet Gynecol 1998 Aug;12(2):132-5
- Schimmel MS, Eidelman AI Supernumerary umbilical vein resulting in a four-vessel umbilical cord. Am J Perinatol 1998 May;15(5):299-301
- Rodriguez MA Four-vessel umbilical cord without congenital abnormalities. South Med J 1984 Apr;77(4):539
- Meyer WW, Lind J, Moinian M An accessory fourth vessel of the umbilical cord. A preliminary study. Am J Obstet Gynecol. 1969 Dec 1;105(7):1063-8
- Adeniran AJ, Stanek J, (2007). “Amnion nodosum revisited: clinicopathologic and placental correlations”. Arch Pathol Lab Med 131 (12): 1829–33
- Adeniran, A. and J. Stanek . Amnion nodosum revisited: clinicopathologic and placental features. Presented at: 50th Annual Meeting of the Paediatric Pathology Society; April 22–24, 2004; Cape Town, South Africa.
- Stanek, J. and A. Adeniran . Chorion nodosum: a placental feature of the severe early amnion rupture sequence. Pediatr Dev Pathol 2006. 9:353–360.
- Faye-Petersen, O. M. , D. S. Heller , and V. V. Joshi . Handbook of Placental Pathology. 2nd ed. London, England: Taylor and Francis; 2006.
- Harold Fox: “Aging of placenta” Arch Dis Child Fetal Neonatal Ed 1997;77:F171-F175 doi:10.1136/fn.77.3.F171
- Vorherr H (1975) Placental insufficiency in relation to to postterm pregnancy and fetal postmaturity: evaluation of fetoplacental function: management of the postterm gravida. Am J Obstet Gynecol 123:67–103.
- Romero-Gutiérrez G, González-Ramos R, Valadez-Ortega MA, Bribiesca-López JA: “Perinatal morbimortality associated with placental senescence”. Ginecologia y Obstetricia de Mexico [1997, 65:8-12]
- Kaufmann P, Sen DK, Schweikhart G (1979) Classification of human placental villi. I. Histology and scanning electron microscopy. Cell Tissue Res 200:409–423.7
- Fox H (1997) Pathology of the placenta. (WB Saunders, London), 2nd edn..
- Mayhew TM, Jackson MR, Boyd PA (1993) Changes in oxygen diffusive conductances of human placentae during gestation (10-41 weeks) are commensurate with the gain in fetal weight. Placenta 14:51–61
- Carmen Mihaela: “Placental, Morphological, and Ultrasonographical Particularities in Post-Term Pregnancies”. Leonardo Electronic Journal of Practices and Technologies2004; Issue 4:51-56.
- Zimmermann P., Alback T., Kovkimen J., Vaalamo P., Tuimala R., Ranta T., Doppler flow velocimetry of the umbilical artery, uteroplacental arteries and fetal middle cerebral artery in prolonged pregnancy, Ultrasound Obstet. Gynecol., 1995, 5, p. 189- 197.
- Devine P.A., Bracero L.A., Lysikiewicz A., Evans R., Middle cerebral to umbilical artery Doppler ratio in post date pregnancies, Obstet. Gynecol., 1994, 84, p. 856-860.
- Mihu D., Mihu C., Ombilical Doppler Ultrasound Examination in Prolonged Pregnancies, Romania Journal of Ultrasonography, 1999, 1, p. 49-54.
- HILL LYNDON M., BRECKLE ROBERT RT, RAGOZZINO MARK W. WOLFGRAM, KIM O’BRIEN, PETER C.: “Grade 3 Placentation: Incidence and Neonatal Outcome”. Obst & Gynecol 1983;61,6:673-784.
- CARRASSET Gilles, FRITEL Xavier, BENIFLA Jean-Louis: “Surveillance du placenta. Diagnostic de la sénescence placentaire = Placental monitoring. PLacental ageing diagnostic”. Congrès Signaux placentaires et naissance : Quel rôle pour le placenta dans le déterminisme de l’accouchement? Réunion, Paris, FRANCE (01/03/2002) 2003, vol. 16, no 1-2 (69 p.) [Document: 4 p.] (17 ref.), pp. 67-70 [4 page(s)