Ultimo aggiornamento 2020-02-12 23:41:56
L’endometriosi è una malattia caratterizzata dalla presenza in sede ectopica di mucosa e stroma di tipo endometriale che risponde ai normali ciclici stimoli ormonali ed è capace di infiltrarsi e persino di propagarsi in maniera simile ad un tessuto maligno anche se la degenerazione maligna è rara.
Gli organi principalmente interessati all’infiltrazione endometriosica sono il peritoneo pelvico, le ovaie e il setto rettovaginale. Si accompagna sempre a processo flogistico locale con tendenza a cronicizzarsi in forma attiva. Fu descritta per la prima volta da Sampson nel 1921 (1).
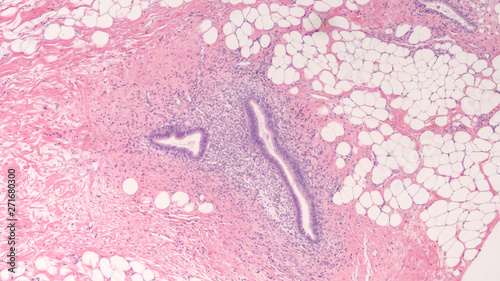
L’adenomiosi (in passato detta anche endometriosi interna) è una condizione anatomo-patologica caratterizzata dalla presenza di ghiandole e stroma endometriali nel contesto del miometrio. Esistono due forme di adenomiosi: la diffusa e la nodulare. Nella prima i foci sono diffusamente distribuiti nel miometrio mentre nella nodulare i foci sono concentrati in poche zone e costituiscono gli adenomiomi. I due processi pur avendo matrice comune, sono probabilmente ad etiologia differente; ne sono prova le diverse caratteristiche delle due popolazioni interessate: nell’adenomiosi diffusa l’età media è compresa tra i 40 e i 50 anni, vi sono limitati problemi di sterilità e spesso si tratta di grandi pluripare (2).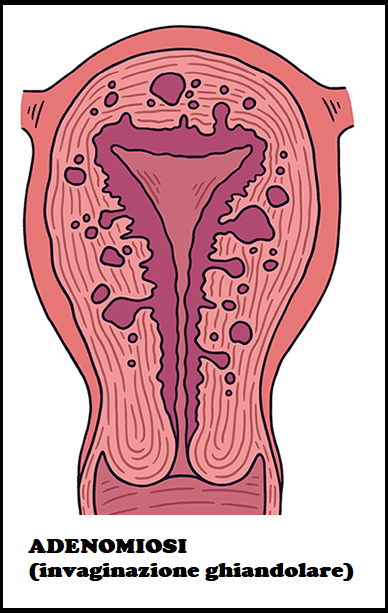
Endometriosi stromale: è una varietà di adenomiosi nella quale all’interno del miometrio invece di trovarsi ghiandole endometriali come nell’adenomiosi, si reperiscono aree di cellule rotonde simili a quelle dello stroma endometriale. Tali gruppi di cellule si dispongono attorno a cavità che sembrano di natura linfatica. L’endometrio di queste pazienti presenta di solito una iperplasia ghiandolare cistica.
Frequenza dell’endometriosi: l’endometriosi è, dopo la fibromatosi uterina, la più frequente patologia pelvica: 5-18% delle donne in età fertile. E’ quindi una vera e propria malattia di tipo sociale. Delle donne affette da endometriosi il 40% è sterile. E’ possibile indicare una frequenza di endometriosi di circa il 50% nelle donne sottoposte ad indagine endoscopica per sterilità inspiegata e/o dolore pelvico cronico. Nelle pazienti con fibromatosi uterina la percentuale di endometriosi è del 12%. L’endometriosi nelle tee-agers è estremamente eccezionale e frequentemente è associata a malformazioni uterine come anomalie dell’istmo, emiutero, etc.(3). E’ più frequente nella popolazione di razza bianca e dell’Estremo Oriente (3).
L’analisi degli studi prospettici effettuati su donne asintomatiche sottoposte a sterilizzazione tubarica rivela una frequenza di endometriosi ben superiore alla percentuale attesa. I dati più recenti variano dal 6% al 43%. Nel nostro secolo si è verificata una costante tendenza alla riduzione dell’età del menarca. Le donne inoltre ritardano spesso la prima gravidanza, limitano il numero dei concepimenti e riducono la durata dell’allattamento. In conseguenza di ciò il numero di mestruazioni che si verifica nel periodo fertile è in progressivo aumento nella società moderna. E’ probabile che la quantità complessiva di endometrio rifluito nella pelvi sia oggi decisamente maggiore rispetto al passato.
Il classico principio che l’endometriosi colpisca prevalentemente soggetti di elevata classe sociale può essere in parte correlato alla maggiore attenzione posta da donne benestanti e di elevato livello culturale a problemi di salute relativamente non gravi.
I progressi della ricerca negli ultimi anni hanno dimostrato una frequenza sempre maggiore della endometriosi tanto che ultimamente si tende addirittura a considerare tale riscontro più fisiologico che patologico soprattutto nelle sue forme minime. E’ da considerare veramente patologica solo nei casi progressivi. La laparoscopia ha portato ad un sensibile incremento nella diagnosi di lesioni minime o lievi.
 Localizzazione (endometrial shedding): pelvica o extra-pelvica, principalmente a carico delle ovaie e/o del peritoneo ma anche di salpingi, legamenti uterini, vagina, appendice, retto, vescica e reni (4).
Localizzazione (endometrial shedding): pelvica o extra-pelvica, principalmente a carico delle ovaie e/o del peritoneo ma anche di salpingi, legamenti uterini, vagina, appendice, retto, vescica e reni (4).
SINTOMATOLOGIA e DIAGNOSI: La diagnosi di certezza dell’endometriosi è basata esclusivamente sul reperto visivo ed istologico. Qualsiasi altro criterio clinico e strumentale può essere di ausilio diagnostico ma non permette mai di confermare o di escludere in maniera assoluta la presenza della malattia. La diagnosi di endometriosi si avvale di anamnesi, visita ginecologica, ecografia pelvica laparoscopia, risonanza magnetica nucleare e dosaggio di markers sierici (1-3).
Anamnesi: IL 25% delle pazienti endometriosiche appaiono asintomatiche. La principale sintomatologia si riferisce a dolore (40%) e sterilità (60%). Frequentemente sono presenti menometrorragie e disordini ormonali.
- Dolore pelvico: Una relazione causale tra endometriosi e dolore pelvico sembra probabile, anche se è esperienza comune enucleare voluminose cisti endometriosiche in donne totalmente asintomatiche. Il dolore non è sempre proporzionale alla gravità della lesione. Tradizionalmente si riteneva che il dolore fosse correlato alle minicriptomestruazioni che avvengono nell’ambito dei focolai endometriosici e quindi dei mediatori chimici liberati; attualmente si ritiene che la patogenesi del dolore possa risiedere a 3 livelli:
a) azione locale biochimica dei focolai che, in ipossiemia, provocano un dolore trafittivo simile a quello dell’infarto del miocardio;
b) rilascio di interleuchine, chinine e soprattutto prostaglandine da parte del tessuto endometriale di recente formazione. Invece il tessuto endometriale più vecchio o non secerne queste sostanze o le secerne dentro le bleds cicatriziali inattive non più vascolarizzate.
c) patologie della sfera emotivo-affettiva distorcenti la dimensione cognitiva della sensazione dolorosa.
Le espressioni cliniche più frequenti del dolore pelvico sono:
-
dismenorrea ingravescente: con dolore irradiato alla faccia supero-interno della coscia e al retto.
- Peritonite pelvica acuta da rottura di cisti endometriosica. Infatti il materiale contenuto nelle cisti color cioccolato è molto irritante.
- Dispareunia: caratteristica, insieme al dolore, nelle lesioni dei ligamenti utero-sacrali
2. Metrorragia e menorragia correlate alla gravità della malattia
3. Alterazioni ormonali: la fase follicolare può essere più corta del normale e il P normale o basso; i livelli di E2 spesso sono inferiori alla norma come il picco dell’LH. Si può osservare deficit della fase luteale pur essendo normale il livello ematico del progesterone e LUF syndrome per la difficoltà dell’ovaio ad espellere l’ovocita normalmente maturato. Le pazienti LUF presentano endometriosi nel 63% dei casi mentre le pazienti endometriosiche sviluppano la LUF-S nel 35% dei casi vs. l’11% delle donne normali.
L’adenomiosi può essere asintomatica, oppure può causare l’aumento di volume dell’utero, dolori pelvici soprattutto durante le mestruazioni, flusso mestruale abbondante e prolungato.
PRESIDI DIAGNOSTICI
A. Visita ginecologica: L’esame pelvico della paziente va sempre condotto con modalità vagino-rettale combinata. E’ in grado spesso di far sospettare la presenza di focolai endometriosici la modificazione di strutture palpabili dall’operatore. E’ importante esaminare il fornice vaginale posteriore e la zona retrocervicale alla ricerca di placche infiltranti la tonaca muscolare vaginale. La retroversione uterina fissa è un reperto tipico ma non frequente. Grande attenzione va posta alla palpazione dei legamenti utero-sacrali che sono spesso anelastici, nodulari e dolenti. Deve essere valutata la mobilità delle masse annessiali.
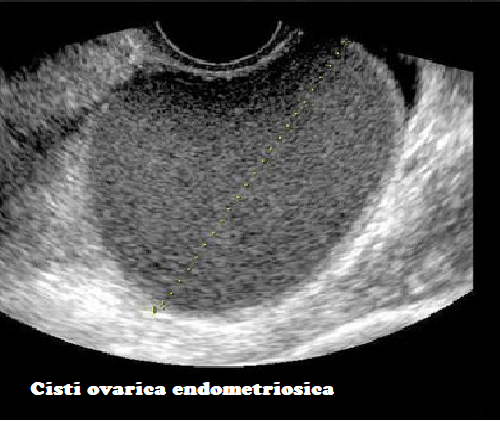
B. Ecografia: imaging di primo livello, non è di nessuna utilità in caso di lesioni <1 cm e comunque non permette una stadiazione delle lesioni. Le lesioni di tipo lieve non sono correttamente evidenziabili dati i limiti della tecnica. Sandler fu il primo a descrivere l’aspetto ecografico polimorfo della cisti endometriosica riconoscendo tre diversi pattern ecografici: cistico, mixed e solido (7-9).
- “Cistic pattern”: è riscontrabile soprattutto nelle lesioni di maggiori dimensioni. Le cisti endometriosiche non hanno pareti definite e lineari e possono presentare iniziali sepimentazioni. Tale aspetto ecostrutturale può essere confondibile con quello di ascessi pelvici e di ematomi. Una cisti endometriosica di ridotte dimensioni dovrebbe essere ignorata.
 Durante il pick-up ovocitario in corso di terapia FIV, la cisti endometriosica non deve essere aspirata o punta perché fa aumentare notevolmente il rischio di infezione del pick-up. Se durante il pick-up la cisti dovesse essere punta inavvertitamente, occorre istituire una buona copertura antibiotica. Il materiale contenuto nelle cisti color cioccolato è molto irritante e quindi può provocare una peritonite.
Durante il pick-up ovocitario in corso di terapia FIV, la cisti endometriosica non deve essere aspirata o punta perché fa aumentare notevolmente il rischio di infezione del pick-up. Se durante il pick-up la cisti dovesse essere punta inavvertitamente, occorre istituire una buona copertura antibiotica. Il materiale contenuto nelle cisti color cioccolato è molto irritante e quindi può provocare una peritonite. - “Mixed pattern”: è caratterizzato dalla contemporanea presenza delle due componenti: solida e cistica.
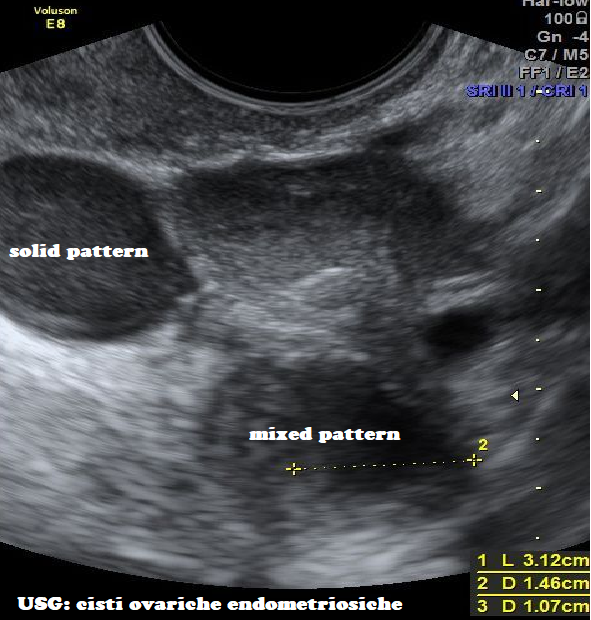
- Solid pattern”: caratteristico di masse di piccole dimensioni, è caratterizzato da echi di bassa intensità uniformemente distribuiti. Tale aspetto è determinato dall’organizzazione del materiale ematico in coaguli contenenti tessuto fibroso, precipitati lipidici e pigmenti emosiderinici (10-17).
- Falda liquida nel Douglas: frequentemente si osserva nelle pazienti endometriosiche una raccolta liquida a bassa ecogenicità e disomogenea per la presenza di microscopiche formazioni irregolari iperiflettenti da riferire a residui emosideinici in aggregazione.
L’endometriosi colpisce l’ovaio sx nel 47% dei casi, il destro nel 33% e entrambe le ovaie nel 18% (49).
Nei quadri di tipo moderato e grave è possibile evidenziare:
- La dislocazione delle ovaie e il loro prolassarsi nel Douglas;
- La presenza di contorni meno definiti delle stesse per lo stretto addossarsi delle anse intestinali per fenomeni aderenziali;
- La presenza di tessuto disomogeneamente ecogenico che riempie lo scavo del Douglas e che resta immutato al variare del decubito ed in osservazioni ripetute;
- Segni indiretti come l’alterazione della silhouette vescicale;
- Presenza di cisti endometriosiche.
In caso di endometrioma la cisti appare di diametro >4 cm, a pareti sottili, non ben definite e a contenuto finemente corpuscolato (contenuto ematico) a volte plurisettato. La diagnosi differenziale va fatta con con i tumori ovarici o con i corpi lutei emorragici.
L’USG rettale fornisce indicazioni “quantitative” che difficilmente la LPS può fornire (63).
Quadri ecografici di adenomiosi: L’adenomiosi può essere presente in forma diffusa (foci di adenomiosi distribuiti diffusamente nel miometrio) o in forma nodulare (presenza di aggregati di foci). I noduli endometriosici indovati nel tessuto miometriale possono  essere facilmente confusi con miomi specialmente in presenza di trasformazione cistica. La diagnosi è aiutata dall’anamnesi: in caso di adenomiosi è presente dismenorrea, pregressa o concomitante endometriosi ovarica, volume aumentato e consistenza diminuita dell’utero alla visita ginecologica; inoltre nell’adenomiosi si osserva un quadro ecostrutturale dei noduli estremamente suggestivo: diffuse aree rotondeggianti ipo-anecogene (immagine a nido d’ape), del diametro di 5-7 mm, non capsulate mentre il leiomioma ha contorni ben definiti per la presenza di una pseudocapsula creata dalla compressione che il tumore esercita sul miometrio circostante.
essere facilmente confusi con miomi specialmente in presenza di trasformazione cistica. La diagnosi è aiutata dall’anamnesi: in caso di adenomiosi è presente dismenorrea, pregressa o concomitante endometriosi ovarica, volume aumentato e consistenza diminuita dell’utero alla visita ginecologica; inoltre nell’adenomiosi si osserva un quadro ecostrutturale dei noduli estremamente suggestivo: diffuse aree rotondeggianti ipo-anecogene (immagine a nido d’ape), del diametro di 5-7 mm, non capsulate mentre il leiomioma ha contorni ben definiti per la presenza di una pseudocapsula creata dalla compressione che il tumore esercita sul miometrio circostante.
C. RMN: La risonanza magnetica può essere utile nella diagnosi e può, in molti casi, aiutare a distinguere la presenza e l’estensione della malattia, soprattutto per le lesioni profonde, e può differenziarla dai fibromi. Masse con segnale di bassa intensità scarsamente marginati rispetto al tessuto circostante. Sensibilità del 100%; specificità del 90%; scarsa capacità di evidenziare lesioni minime e la stadiazione della malattia. Buona possibilità di applicazione nelle lesioni medio-gravi in quanto evidenzia bene il sangue e i suoi derivati e le placche parietali delle lesioni datate (62). Con la RMN inoltre è possibile evidenziare eventuali focolai endometriosici a carico degli ureteri, peraltro molto rara (0.05%). Gli endometriomi appaiono iperintensi nelle sequenze T1 pesate e ipointensi o iperintensi nelle sequenze T2 pesate. L’accumulo di ferro negli endometriomi dà luogo al fenomeno “shading, ombra”.
L’esame standard prevede:
-
piani di scansione sagittali, coronali, obliqui trasversi ed assiali
-
magneti ad alto campo
-
bobine phased-array
-
sequenza TSE T2 HR (3 mm)
-
T1 flash e T1 SE FS
-
mezzo di contrasto in casi selezionati (noduli parietali)
D. Laparoscopia: ha portato ad un sensibile incremento nella diagnosi di lesioni minime o lievi. E’ l’unica vera indagine che permette un quadro completo dello sviluppo della malattia della pelvi. Da praticare preferibilmente in fase follicolare precoce, subito dopo la fine delle mestruazioni; in fase pre-ovulatoria se si vuole valutare lo sviluppo follicolare mentre in fase post-ovulatoria è possibile osservare l’avvenuta ovulazione e la formazione del corpo luteo.
Occorre sistematicamente esplorare:
- la superficie peritoneale
- le pareti pelviche
- il cavo del Douglas
- il setto retto-vaginale
- la superficie ovarica
- la superficie e la pervietà tubarica
- i legamenti utero-sacrali
- le aderenze
- le pareti intestinali
- quantità di liquido peritoneale, in genere superiore rispetto alle pazienti non endometriosiche; simile o inferiore a quella delle pazienti con infertilità inspiegata di lunga durata.
E’ utile procedere sempre ad esame istologico delle lesioni osservabili e non; Brosens ed altri hanno dimostrato focolai endometriosici nel 15-30% di biopsie su peritoneo “normale” (8).
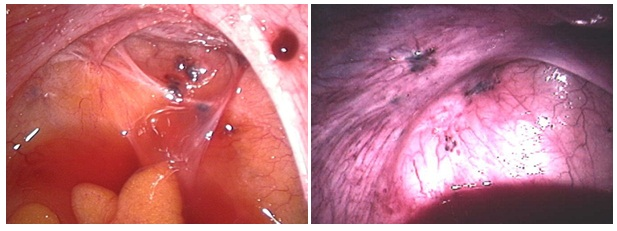
Osservazione delle lesioni endometriosiche: le lesioni recenti appaiono come papule chiare che successivamente assumono una colorazione rossastra che poi vira dapprima verso il blu e quindi verso il nero. Evolvendo, le lesioni determinano prima un “freezing” dei tessuti interessati e quindi la fibrotizzazione degli stessi.
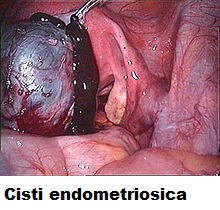
- endometriosi ovarica: si presenta come lesione emorragica superficiale oppure, nelle forme più severe, come cisti emorragiche: cisti ovariche endometriosiche (endometriomi ovarici) comunemente chiamate cisti “color cioccolata” (1).
- lesioni superficiali: usualmente localizzate sulla superficie laterale dell’ovaio; presentano forte tendenza a formare aderenze con gli organi viciniori colpiti dalla stessa patologia (in particolare tuba e lig. largo). La lesione endometriosica può approfondirsi nel tessuto ovarico formando una piccola cavità ripiena di sangue e fibrina e con le pareti ricoperte da “ciuffi” di tessuto endometriosico. Il sangue presente sulle lesioni superficiali e profonde (endometriomi o cisti cioccolata) deriva non da “micromestruazioni” del tessuto endometriosico ma dallo stravaso emorragico cronico derivante dai vasi limitrofi che protrudono dalle pareti delle cavità endometriosiche e che ciclicamente, in corrispondenza delle mestruazioni del tessuto endometriale eutopico, vanno incontro a congestione, degenerazione e necrosi (7).
- endometrioma ovarico (cisti color cioccolata): lesione endometriosica insita profondamente nel tessuto ovarico come un fibroma. La diagnosi macroscopica di endometrioma è difficile; anche nei casi di aspetto “a cioccolata” occorre effettuare un esame della parete interna della cisti, mediante ovarioscopio, alla ricerca di “ciuffi endometriosici” ed esame istologico, alla ricerca delle ghiandole e stroma endometriali, per poter differenziare con certezza l’endometrioma endometriosico dalle le cisti emorragiche non endometriosiche (8,9).
Salpingocromoscopia (SHSG): Si inietta l’indaco-carminio o il blu di metilene nelle tube per esaminare la loro pervietà e struttura alla ricerca delle dilatazioni tipiche dell’endometriosi. Occorre ricordare che spesso si osserverà fuoriuscire dall’ampolla solo bolle di aria e non colorante e spesso da una sola tuba senza che ciò costituisca certezza di stenosi od occlusione tubarica.izione distorta stravolgendo i normali rapporti topografici. In un rapporto prospettico tipo di lesioni/età le lesioni chiare si evidenziano all’età di 21 anni, le blu e le nere a 31 anni. La malattia progredisce nel 60% delle donne non trattate e nel 20% delle donne sottoposte ad adeguata terapia.
Le lesioni minime sono meglio evidenziate con la LPS transvaginale che utilizza soluzioni saline invece della CO2 .
Ovarioscopia: allo scopo di ottenere una diagnosi estemopranea durante l’intervento. Si avvale di un endoscopio del diametro di 2.6 mm inserito in una camicia operativa di 5 mm che consente l’introduzione di una cannula per irrigazione/aspirazione e forbici da biopsia o argon laser. Sotto controllo laparoscopico, l’ovarioscopio è introdotto nella lesione o nella cisti e il contenuto viene aspirato per l’esame citologico; quindi una soluzione salina viene iniettata nella cavità che si distende e osservata nei dettagli alla ricerca dei “ciuffi endometriosici. Si procede all’osservazione e toccamento delle pareti cavitarie che, in caso di endometriosi, si presentano ispessite e sclerotiche ed con segni di flogosi (elementi tutti che non si osservano in caso di corpi lutei emorragici). Si procede con biopsia dei ciuffi e di alcuni punti delle pareti per l’esame istologico ed alla coagulazione dei residui foci mediante argon laser (8).
 E. Isterosalpingografia: Presenza di diverticoli di forma e dimensioni molto variabili che dalla cavità
E. Isterosalpingografia: Presenza di diverticoli di forma e dimensioni molto variabili che dalla cavità
penetrano nel miometrio lungo i bordi e dal fondo o anche dal lume tubarico penetrano nello spessore della parete tubarica. La morfologia e le dimensioni di questi diverticoli sono molto variabili.
In genere l’endometriosi a localizzazione istmica si associa a sinechie loco-regionali endocavitarie provocate da ripetuti curetages.
E’ facile confondere l’endometriosi istmica con le ghiandole mucose endocervicali. E’ anche possibile che una “intravasazione” vascolare ematica o linfatica possa mimare un quadro endometriosico.
La localizzazione cornuale è particolarmente caratteristica, realizzando le classiche immagini “a  nebulosa” o “a bouquet di visco” formate da un intreccio di diverticoli molto serrato e ramificato.
nebulosa” o “a bouquet di visco” formate da un intreccio di diverticoli molto serrato e ramificato.
Il valore diagnostico di questi diverticoli è molto elevato qualunque sia il loro numero e la loro localizzazione. Purtroppo tale segno è incostante (30%).
Le forme nodulari (adenomiosi) modificano la cavità uterina come i fibromiomi producendo un’impronta rotondeggiante sul contorno della cavità uterina (minus di riempimento).
Occorre riempire bene la cavità uterina eventualmente somministrare antispastici per potere meglio riempire la cavità.
ENDOMETRIOSI e MENOPAUSA
Dopo la menopausa i focolai di endometriosi si atrofizzano e scompaiono nella maggioranza dei casi. La loro eventuale persistenza è legata alla secrezione follicolare residua o, più frequentemente, ad un trattamento ormonale sostitutivo (HRT).
ARTICOLI CORRELATI:
ENDOMETRIOSI TERAPIA CHIRURGICA
EMBOLIZZAZIONE DELLE ARTERIE UTERINE
EMBOLIZZAZIONE DELLE AA. OVARICHE
Enjoy this exciting new issue and stay tuned for more!
We value your opinion and are receptive to comments and suggestions.
Yours faithfully,
dr. Enzo Volpicelli
References list:
- Sampson J.A.: “Perforating haemorrhagic (chocalate) cysts of the ovary: their importance and especially their relation to pelvic adenomas of endometrial type (adenomyoma of the uterus, rectovaginal septum, sigmoid, etc.). Archives pf Surgery; 1921;3:245-323.
- Jenkins S, Olive DL, Haney AF. Endometriosis: pathogenetic implications of the anatomic distribution. Obstet Gynecol. 1986;67:335–338. MEDLINE
- Tran DK, Leroy JL: “Endometriose externe”. Encycl Med Chir (Elsevier, Paris, 1996), Gynecologie;150-A-10:1-10-
- Schenken RS: “Endometriosis”. In: Scott JR, Di Sain PJ, Hammond CB, Spellacy WN, eds. Danforth’s obstetrics and gynecology. 8th ed.Baltimore,MD: Lippincott, Williams and Wilkins, 1999; 669-675.
- Ballweg ML. Impact of endometriosis on women’s health: comparative historical data show that the earlier the onset, the more severe the disease. Best Pract Res Clin Obstet Gynaecol. 2004;18:201–218.
- Fauconnier A, Chapron C, Dubuisson JB, Vieira M, Dousset B, Breart G. Relation between pain symptoms and the anatomic location of deep infiltrating endometriosis. Fertil Steril. 2002;78:719–726.
- Chapron C, Fauconnier A, Dubuisson JB, Barakat H, Vieira M, Breart G. Deep infiltrating endometriosis: relation between severity of dysmenorrhoea and extent of disease. Hum Reprod. 2003;18:760–766.
- Cornillie F., Vasquez G, Brosens I.: “”The response of human endometriosic implants to the anti-progesterone steroid R2323; a istologic and ultrastructural study”. Pathology. Research and Practice. 1985; 180:647-655.
- Chapron C, Dubuisson JB, Pansini V, Vieira M, Fauconnier A, Barakat H, et al. Routine clinical examination is not sufficient for diagnosing and locating deeply infiltrating endometriosis. J Am Assoc Gynecol Laparosc. 2002;9:115–119. f,
- Brosens I. et Gordon A.: “Tubal infertility”. J.B. Lippincott Company Philadelphia and Gower Medical Publishing London-New York, 1990.
- Bergqvist A., Fernö M., Mattson S.: A comparisio of cathepsin D levels in endometriotic tissue and in uterine endometrium. Fertil. Steril. Vol. 65 n. 6 giu. 1996, pagg 1130-34
- Donnez J, Nisolle M, Squifflet J: “Ureteral endometriosis: a complication of rectovaginal endometriotic (adenomyotic) nodules”. Fertil Steril 2002 Jan, 77,1,32-37.
- Eyster KM: “DNA microarray analysis of gene expression markers of endometriosis”. Fertil Steril 2002 Jan, 77,1,38.
- Gazvani R et al: “Effect of interleukin-8 (IL-8), anti-IL-8, and IL-12 on endometrial cell survival in combined endometriale gland and stromal cell cultures derived from women with and without endometriosis”. Fertil Steril 2002 Jan,77,1,62-67.
- Smith SK: “Angiogenesis”. Semin Reprod Endocrinol 1997,15:221-227.
- Healy DL, Rogers PA, Hii L, Wingfield M: “Angiogenesis: a new theory for endometriosis”. Hum Reprod Update 1998; 4:756-740.
- Fasciani A et al.: “Vascular endothelial growyh factor and interleukin-8 in ovarian cystic pathology”. Fertil Steril 2001; 75,6:1218-1221.
- Fasciani A et al.: “Vascular Endothelial Growth Factor and Interleukin-8 in ovarian Cystic pathology”. Fertil Steril 2001;75,6:1218-1221.
- Brosens I, Gordts S, Campo R: “Transvaginal hydrolaparoscopy but not standard laparoscopy reveals subtle endometriotic adhesions of the ovary”. Fertil Steril 2001;75,5:1009-1012.
- Hye-Won Chung et al: “Matrix Metalloproteinase-9 and tissue inhibitor of metalloproteinase-3 mRNA expression in ectopic and eutopic endometrium in women with endometriosis: a rationale for endometriotic invasiness”. Fertil Steril 2001;75,1:152-159.
- Cancer 1997;75:1457-1463.
- Proc Nat Acad SCIUSA1987; 84:5277-5281.
- Science 1992;258:1798-1801.
- Taketani Y, Kuo TM, Mizuno M: “Comparison of cytokine levels and embryo toxicity in peritoneal fluid in infertile women with untreated or treated endometriosis”. Am J Obstet Gynecol 1992;167:265-270.
- Harada T et al.: “Increased interleukin-6 levels in peritoneal fluid of infertile patients with active endometriosis” Am J Obstet Gynecol 1997;176:593-597.
- Halme J: “Release of tumor necrosis factor-a by human peritoneal macrophages in vivo and in vitro”. Am J Obst Gynec 1989;161:1718-25.
- Rana Net al.: “Basal and stimulated secretion of cytokines by peritoneal macrophages in women with endometriosis”. Fertile Steril 1996;65:925-930.
- Hsu CC, Yang BC, Wu MH, Huang KE: “Enhanced interleukin-4 expression in patients with endometriosis“. Fertil Steril 1997;67:1059-1064.
- Koyama N, Matsuura K, Okamura H: “Cytokines in the peritoneal fluid of patients with endometriosis”. Int J Gynecol Obstet 1993;43:45-50.
- Buyalos RP et al.: « Elevated Interleukin-6levels in peritoneal fluid of patients with pelvic pathology ». Fertil Steril 1992;58:302-306.
- Punnonen J et al.: “Incresed levels of interleukin-6 and interleukin-10in the peritonela fluid of patients with endometriosis”. Am J Obst Gynecol 1996;174:1522-1526.
- Zeyneloglu HB et al.: ”The peritoneal fluid levels of interleukin-12 in women with endometriosis”. Am J Reprod Immunol 1998;39:152-156.
- McLaren J et al.: ”Decreased levels of the potent regulator of monocyte/macrophage activation, interleukin-13, in the peritoneal fluid of patients with endometriosis”. Human Reprod 1997;12:1307-10.
- Keenan Jaet al: “Interferon-gamma and interleukin-6 in peritoneal fluid and macrophafe-conditioned media of women with endometriosis”. Am J Reprod Immunol 1994;32:180-183.
- Tabibzadeh Ssanthanam V, Sehgel PB, May LT: “Cytokine-induced proction of IFN-b-2 by freshly explanted human endometriale stromal cells. Modulation by estradiol-17-b”. J Immunol 1989; 142:3134-3139.
- Betjes MGH et al.: ”Interleukin-8 production by human peritoneal mesothelial cells in response to tumor necrosis factor-a, interleukin-1, and medium conditioned by macrophages co-cultured with Staphylococcus epidermidis”. J Infect Dis 1993;168:1202-1210.
- Harada T, Iwabe T, Terakawa N : ”Role of cytokines in endometriosis”. Fertil Steril 2001;76,1:1-10.
- Akoum A,LemayA, Paradis I, Rheault N, Maheux R : ”Secretion of Interleukin-6 by human endometriotic cells and regulation by proinflammatory cytokines and sex steroids”. Human Reprod 1996;11:2269-2275.
- Tsudo T et al: “Altered gene expression and secretion of interleukin-6 stromal cells derived from endometriotic tissues”. Fertil Steril 2000; 73:205-211.
- Arici A, Seli E, Senturk LM, et al: “Interleukin-8 in human endometrium”. J Clin Endocrin Metab 1998;83:1783-7.
- Arici A, Seli E, Senturk LM, Oral M, Olive DL: “Interleukin-8 induces proliferation of endometrial stromal cells: ”a potential autocrine growyh factor”. J Clin Endocrin Metab 1998;83:1201-5.
- Iwabe T, Harada T, Tsudo T, Nagano Y, Tanikawa M, Terakawa N: ”Tumor Necrosis Factor-a promotes proliferation of the endometriotic stromal cells by inducing interleukin-8 gene and protein expression“. J Clin Endocrin Metab 2000;85:824-29.
- Wilson TJ et al: “Decreased natural killer cell activity in endometriosis patients: relationship to disease pathogenesis “. Fertil Steril 1994;62:1086-8.
- Oosterlynck DJ et al. : “Women with endometriosis show a defect in natural killer activity resulting in a decreased cytotoxicity to autologous endometrium”. Fertil Steril 1991;56:45-51.
- Harlow CR; Cahill DJ; Maile LA; Talbot WM; Mears J; Wardle PG; AD: “Reduced preovulatory granulosa cell steroidogenesis in women with endometriosis”. J Clin Endocrinol Metab. 1996 Jan. 81(1). P 426-9.
- Ming-Yang Chang et al. :The influence of endometriosison the success of Gamete Intrafalloppian Transfer (GIFT). J. Of Assisted Reproduction and Genetics, vol. 14, n. 2, feb. 1997.
- Rinesi L et al.:”Results of assisted reproductive technologies in patients with endometriosis”. Fertil Steril Jan 2002; 77,1:190-191.
- Welbery C: “Diagnosis and treatment of endometriosis” Am Fam Physician 1999;60:1753-1762,1767-1768.
- Curtis P, Jackson AE: “Adverse effects on sperm movement
- Malgorzata S et al.: “Antizona and antisperm antibodies in women with endometriosis and/or infertility”. Fertil Steril 2001;75,1:97-105.
- Mathur S., Garza DE, Smith LA: “Endometrial autoantigens eliciting immunoglobulin (IgG), IgA, and IgM responses in endometriosis”. Fertil Steril 1990;54.1:56-63.
- Lebovic DI et al: “Immunobiology of endometriosis”. Fertil Steril 2001;75,1:1-10.
- Sampson JA: “Peritoneal endometriosis due to menstrual dissemination of endometriale tissue into the peritoneal cavity”. Am J Obstet Gynaecol 1927;14:422-469.
- Ghezzi F, Beretta P, Franchi M, Parissis Mbolis P: “Recurrence of ovarian endometriosis and anatomical location of the primary lesion”. Fertil Steril 2001;75,1:136-140.
- Seli E et al: “Expression of aminopeptidase N in human endometrium and regulation of its activity by estrogen”. Fertil Steril 2001;75,6:1172-1176.
- The American Fertility Society. Revised American Fertility Society classification of endometriosis. Fertil Steril 1985;43:351.
- D’Ambrogio G, Somigliano E, Vignali M: “Nuove strategie terapeutiche”. GYNECOAOGOI N. 7, 2002, pagg 22-23
- HughesdonPE: “The structure of endometrial cystsof the ovary”. J Obstetr Gynaecol Brit 1957; 44:481.
- Ishihara H et al: “Gonadotropin-releasing hormone agonist and danazol normalize aromatase cytochrome P450 expression in eutopic endometrium from women with endometriosis, adenomiosis or leiomyomas”. Fertil Steril 2003; supplem 1: 735-742.
- Santanam M et al:”Antioxidant supplementation reduces total chemokines and inflammatory cytokines in women with endometriosis”. Fertil Steril 2003;80,suppl 3,S32.
- Gruppo Italiano per lo studio dell’endometriosi: “Prevalence and anatomical distribution of endometriosis in women with selected gynaecological conditions: results from a multicentric Italian study”. Human Reprod 1994; 9,6:1158-1162.
- Darrow SL, Vena JE, Batt RE et al: “Menstrual cycle characteristics and the risk of endometriosis”. Epidemiology 4:135-142,1993.
- Osteen KG, Bruner-TrKL, Eisenberg E: “Reduced progesterone action during endometrial maturation: a potential riskfor the development of endometriosis”. Fertil Steril 2005;83:529-537.
- Koninckx PR, Martin D. Treatment of deeply infiltrating endometriosis. Curr Opin Obstet Gynecol. 1994;6:231–241
- Bazot M., Lafont C., Rouzier R., Roseau G., Thomassin-Naggara I., Daraï E.: “Diagnostic accuracy of physical examination, transvaginal sonography, rectal endoscopic sonography, and magnetic resonance imaging to diagnose deep infiltrating endometriosis”. Fertil Steril; 2009;92,1: 1825-33.